AULA 03
-
EQUILÍBRIO QUÍMICO
-
TEORIA ATÔMICO MOLECULAR
-
RADIOATIVIDADE
-
GASES
-
ESTEQUIOMETRIA
01 - (Unievangélica GO/2014 MOD)
Segundo Avogadro, “Gases quaisquer, ocupando o mesmo volume, nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas”.
Considere os seguintes sistemas fechados contendo gases, todos com a mesma temperatura e pressão:
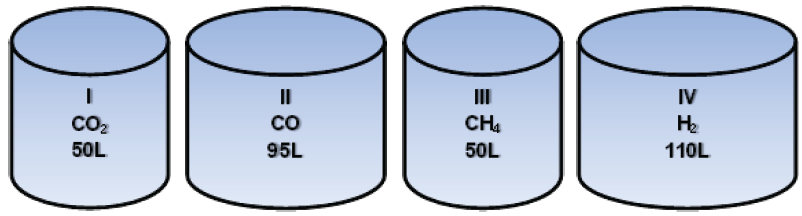
Há maior número de átomos de oxigênio e hidrogênio, respectivamente, em quais sistemas?
Dados: C = 12 O = 16 H = 1
02 - (FMJ SP/2013-MOD)
O isótopo do iodo, que apresenta número de massa 131, pode ser utilizado na medicina nuclear para avaliar o tamanho, a forma e a atividade da glândula tireoide. Uma das etapas de seu decaimento radioativo é:
![]()
Nessa reação, ![]() representa qual partícula?
representa qual partícula?
03 - (UCS RS/2013- mod)
A hemoglobina é uma metaloproteína que contém 0,35% de Fe em massa. Ela está presente nos glóbulos vermelhos e permite o transporte de oxigênio pelo sistema circulatório. Sabendo-se que a molécula de hemoglobina contém 4 átomos de Fe, qual a massa molar aproximada da hemoglobina?Dados: Fe = 56
04 - (UFG GO/2014)
A equação da lei dos gases ideais, P.V = n.R.T, é uma equação de estado que resume as relações que descrevem a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Considerando o exposto, demonstre, por meio de equações matemáticas, como a densidade de um gás qualquer varia em função da temperatura e determine a massa molar de um gás considerando os dados a seguir.
Dados: d = 0,97 g L–1; T = 210 ºC; P = 0,25 atm; R = 62,36 L.torr.mol–1.K–1; 1 atm = 760 torr.
05 - (Fac. de Ciências da Saúde de Barretos SP/2013)
Oxigênio, nitrogênio e hélio são gases utilizados em ambientes hospitalares com diversas aplicações em sistemas de manutenção da vida. Em geral, são fornecidos em cilindros, sob pressão.
Um técnico da central de gases de um hospital abasteceu dois cilindros de aço com oxigênio e hélio à temperatura de 27 ºC e alta pressão. O cilindro 1 foi abastecido com 0,96 kg de oxigênio e o cilindro 2 recebeu uma carga correspondente a 0,12 kg de hélio.
Dado: volume molar dos gases a CNTP = 22,4 L.
Para realizar o abastecimento em condições normais de temperatura e pressão, o técnico iria precisar de cilindros com capacidade igual a quanto? Dados: He = 4 O = 16
06 - (UCS RS/2013- MOD)
O BaSO4 é utilizado como contraste para a realização de exames de raios X do trato intestinal, no lugar de outros sais de bário que também refletem esse tipo de radiação. Essa preferência deve-se ao fato de ele ser pouco solúvel em água, o que minimiza a exposição do paciente ao íon Ba2+, que é tóxico.
Sabendo-se que 1 g de BaSO4 pode ser dissolvido em 400 L de água. Qual o produto de solubilidade (Kps) aproximado para esse sal ?
GABARITO E RESOLUÇÃO – R-2 – AULA - 03
ESTEQUIOMETRIA, RADIOATIVIDADE, GASES, TEORIA ATÔMICO MOLECULAR E EQUILÍBRIO QUÍMICO.
1-Resolução
Dica: “Quaisquer gases na mesma pressão e temperatura e ocupando o mesmo volume, possuem o mesmo número de mols”
Temos: PV = nRT V = n
2-Resolução
A questão fornece a reação nuclear, representada por:
![]()
A questão pede a partícula representada por ![]() .
.
Temos na reação a radiação gama que não possui massa e não possui carga. Verificamos que a massa permanece a mesma 131 e o número atômico aumenta uma unidade. Concluímos que a partícula que completa a reação é a beta -1 β0
3-Resolução
A hemoglobina contém 0,35% em massa de ferro. A questão informa que a molécula de hemoglobina contém 4 átomos de ferro ( a massa de Fe = 56 g/mol ).
Temos:
4 Fe --------------0,35%
224 g ------------ 0,35%
M ------------ 100 %
M = 64.000 g.mol-1
4-RESOLUÇÃO
P M = d R T , onde M = massa molar d = densidade em g/L
P = pressão R = constante T = temperatura em Kelvin .
Dados: d = 0,97 g L–1; T = 210 ºC; P = 0,25 atm; R = 62,36 L.torr.mol–1.K–1; 1 atm = 760 torr
M = dR T / P è M = 0,97 . 62,36 .483 / 190
M = 153,76 g.mol-1
DICA : Transformar a pressão (atm ) em torr.
1 atm = 760 mmHg = 760 torr
1 atm ----------- 760 torr
0,25 atm -------- x
X = 190 torr
5-Resolução
A questão indica que os gases estão nas CNTP. O volume molar ( volume de 1 mol ) é igual a 22,4 L.
Para determinar o volume dos gases, temos que calcular o número de mols de cada gás envolvido. A massa molar do gás oxigênio é 32 g.mol-1 e do hélio é igual a 4g.mol-1 .
Cálculo de volume para 960 g do gás oxigênio.
32 g O2 -------------- 22,4 L
960 g O2 ----------- X
X = 672 L
Cálculo de volume para 120 g do gás hélio.
4 g O2 -------------- 22,4 L
120 g O2 ----------- X
X = 672 L
Concluímos que a capacidade dos cilindros deve ser de 672 litros para os gases.
6-Resolução
A questão é referente a produto de solubilidade ( kps ).
1 BaSO4(S) 1Ba+2(aq) + 1 SO4-2 (aq)
Kps = [Ba+2] [SO4-2]
[ ] = concentração molar M = 233 g.mol-1 ( consultando uma tabela )
[BaSO4] = m/M. V . Portanto : [BaSO4] = 1/233. 400
[BaSO4] = 1,07 x 10-5 mol/L
Kps = [Ba+2] [SO4-2]
Kps = [1,07.10-5] [1,07.10-5] Kps = 1,14 . 10-10


