QUESTÕES ESTUDO DOS GASES.
01 - (UEL PR/2014)
Em um balão de paredes rígidas, foram colocados 0,200 g de gás hidrogênio, 6,400 g de gás oxigênio e um material sólido que absorve água. O volume do balão é de 4,480 L e é mantido à temperatura de 0 ºC. No balão, passa-se uma faísca elétrica de modo que haja reação e a água formada seja retirada pelo material absorvente, não exercendo pressão significativa. Com base nesse problema, responda aos itens a seguir.
a) Supondo um comportamento ideal, qual é a pressão no balão (em atmosferas) após inserção de oxigênio e hidrogênio? Considere: P x V = n x R x T e
![]()
b) Após a reação, mantendo-se a temperatura inicial e o volume, qual a pressão no interior do balão?
02 - (Unimontes MG/2013)
Durante uma corrida de automóvel, utilizou-se experimentalmente o hidrogênio como combustível. No início da corrida, para o tanque rígido de 30 L, admitiu-se 16,0 atm de hidrogênio a 298 K. No final da corrida, a temperatura do tanque manteve-se 298 K, porém a pressão caiu para 4,0 atm. Durante a corrida, foi queimada uma quantidade de matéria (mols) de hidrogênio, aproximadamente igual a
a)14,7 mols.
b)2195,1 mols.
c)1,20 mols.
d)195,1 mols.
03 - (ACAFE SC/2014)
No jornal Folha de São Paulo, de 01 de novembro de 2013, foi publicada um reportagem sobre uma Universidade paulista que foi construída sobre terra que contém lixo orgânico ´´[...] Com o passar do tempo, esse material começa a emitir gás metano, que é tóxico e explosivo […]”.
Quantos litros de O2(g) a 1,00 atm e 27ºC são necessários para reagir em uma reação de combustão completa com 40g de gás metano?
Dado: Constante universal dos gases (R): 0,082 atm.L.mol–.K–. C: 12 g/mol, H: 1 g/mol.
a)123L
b)61,5L
c)24,6 L
d)49,2 L
04 - (FUVEST SP/2014)
A tabela abaixo apresenta informações sobre cinco gases contidos em recipientes separados e selados.
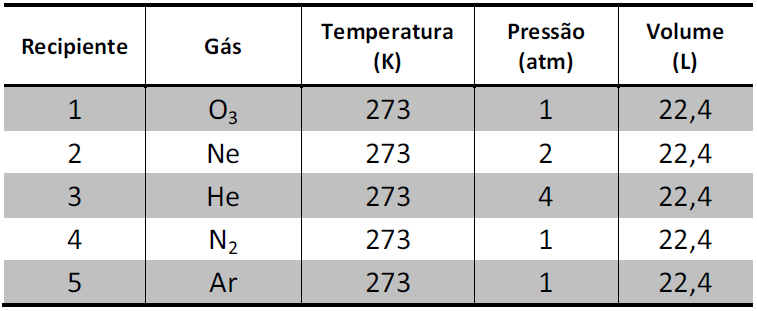
Qual recipiente contém a mesma quantidade de átomos que um recipiente selado de 22,4 L, contendo H2, mantido a 2 atm e 273 K?
a)1
b) 2
c) 3
d) 4
e)5
05 - (UFG GO/2013)
Em um processo industrial, um reator de 250 L é preenchido com uma mistura gasosa composta de 50 kg de N2O; 37 kg de NO e 75 kg de CO2. Considerando-se a temperatura de 527 ºC, a pressão interna, em atm, do reator, será, aproximadamente,
a)1
b)108
c)350
d)704
e)1069
06 - (UEFS BA/2014)
A aplicação da Lei do Gás Ideal permite deduzir expressões para o cálculo de grandezas referentes a misturas gasosas, a exemplo da constituída por 24g de hidrogênio, H2(g), e 64g de metano, CH4(g), que exerce pressão de 4atm em um recipiente de 100L.
Essas informações possibilitam a cálculo de determinadas grandezas utilizadas no estudo dos sistemas gasosos ideais e permitem corretamente afirmar:
a) A fração em mol de metano é igual a 4.
b) O volume parcial do hidrogênio na mistura gasosa é igual a 25L.
c) A porcentagem em volume de metano na mistura é igual a 75%.
d) A pressão parcial do hidrogênio é três vezes menor que a de metano na mistura.
e) A densidade do metano, a 27°C e à pressão de 1atm, é, aproximadamente, 0,650 g.L-1
07 - (FGV SP/2012)
O Brasil é um grande exportador de frutas frescas, que são enviadas por transporte marítimo para diversos países da Europa. Para que possam chegar com a qualidade adequada ao consumidor europeu, os frutos são colhidos prematuramente e sua completa maturação ocorre nos navios, numa câmara contendo um gás que funciona como um hormônio vegetal, acelerando seu amadurecimento. Esse gás a 27 ºC tem densidade 1,14 g * L–1 sob pressão de 1,00 atm. A fórmula molecular desse gás é ( C = 12 H = 1 O = 16 Xe = 131,3 N = 14 )
a) Xe.
b)O3.
c) CH4.
d)C2H4.
e) N2O4.
08 - (MACK SP/2013)
Considerando dois gases com comportamento ideal, CH4 e C2H6, contidos em compartimentos separados e fechados, ambos com volumes iguais a 10 L, sob mesmas condições de temperatura e pressão, de acordo com a hipótese de Avogadro, pode-se afirmar que ambos os gases
a) contêm a mesma quantidade de moléculas. b) possuem a mesma massa.
c) possuem a mesma massa molar. d) contêm, respectivamente, 2 e 5 mols.
e) possuem iguais velocidades de difusão.
09 - (FAMECA SP/2014)
Um médico prescreveu ao seu paciente o uso de gás oxigênio medicinal para realização de oxigenoterapia. Em um cilindro do gás recomendado eram encontradas as informações reportadas na figura.

Considere que todo o gás contido no cilindro indicado na figura, quando submetido à pressão de 1 bar e 25 ºC, ocupa um volume de 1,5 m3. É correto afirmar que o volume de oxigênio medicinal, nesse cilindro, em litros, é
a)50.
b)10.
c) 25.
d)15.
e) 5.
10 - (UNESP SP/2012)
Armadilhas para o CO2
Estudo de pesquisadores da Universidade Estadual Paulista, Unesp, em Presidente Prudente, abre a perspectiva de desenvolvimento de tecnologias que possibilitam capturar quimicamente o CO2 atmosférico, o principal gás de efeito estufa.
Os pesquisadores brasileiros demonstraram que uma molécula denominada DBN, em determinadas condições de temperatura e pressão, associa-se ao dióxido de carbono, formando carbamato (1) e bicarbonato de DBN (2). O processo está esquematizado a seguir.
(Unesp Ciência, dezembro de 2011. Adaptado.)
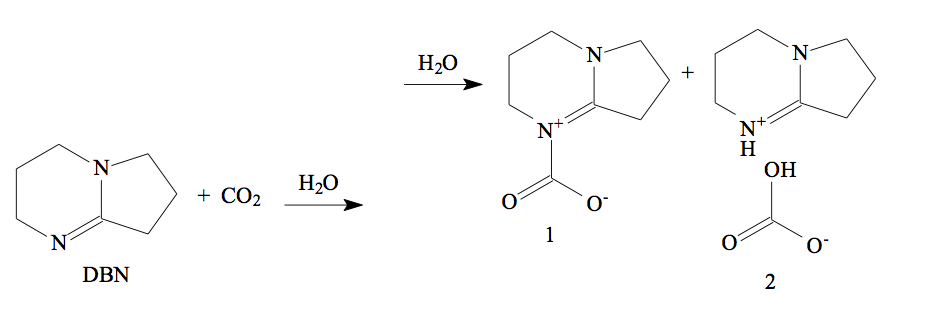
Determine a fórmula molecular da DBN. Com base nas informações fornecidas pelo esquema da reação, e dado R = 0,082 L * atm * K–1* mol–1, calcule o volume de CO2, em litros, que pode ser capturado na reação de 1 mol de DBN à temperatura de –23 ºC e pressão de 1 atm.

