RESOLUÇÃO COMENTADA
1-RESP: A
Foi dado que:
Nitrato = 1,45 mg/L = 1,45 X 10-3 g/L
Portanto temos:
2-RESP: C
1º passo
Vamos calcular a quantidade de mols de ácido sulfúrico que foram utilizados para neutralizar a base.
Equacionar a reação de neutralização total
Calculando o número de mols do ácido
3-RESP: B
A questão envolve mistura de soluções com reação química e o caráter ( ácido, basíco ou neutro)da solução será determinado após calcular o número de mols do reagente.
4-RESP: A
A questão envolve mistura de soluções com reação química e o caráter ( ácido, basíco ou neutro)da solução será determinado após calcular o número de mols do reagente.
Dica: A fenolftaleína é um indicador de ácido-base, que adquire coloração róseo-avermelhado em meio básico e incolor no meio ácido
5-RESP: E
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do etanol.
ΔH = HP - HR
ΔH = - 1645 – (-277,8)
ΔH = - 1367,2 kJ/mol etanol
Obs: Lendo atentamente o enunciado, notamos que foram consumidos 5 litros de etanol que possui densidade igual a 0,8g/cm3 = 800g/L ) e a questão quer o resultado para a queima de 1litro de etanol.
Através do enunciado,já sabemos que em 1L de etanol, temos 800g
Encontramos o valor de entalpia para 1 mol (46g) de etanol
46g etanol --------1367,2 Kj liberados
800g etanol -------- x
X = - 23777,4 kJ
Dica: Na combustão o valor de variação de entalpia, sempre será negativo, devido à liberação de calor.
A substância simples possui entalpia igual à zero no estado padrão.
6-Resolução
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do butano.
ΔH = HP - HR
ΔH = - 3003 – (-125,7)
ΔH = - 2877,3kJ/mol butano
7-Resolução
Esta questão é sobre relação entre as concentrações. A maneira mais fácil de resolver é utilizando a fórmula abaixo.
8-Resolução
Calculando o número de mols da base, encontraremos o número de mols do ácido através da proporção.
Para o ácido temos:
. v = 0,01L
. η= 0,01 mol
. ɱ = ?
0,01 mol ----------------- 0,01 L
X -------------------------- 1L
X = 1 mol/L de ácido
9-Resolução
ΔH = HP - HR
ΔH = - 4080 – (-156)
ΔH = - 3924kJ/mol cicloexano
10-RESP: D
Esta questão é sobre mistura de soluções de mesmo soluto, portanto não ocorre reação.
11-RESP: D
Portanto
ɱVA + ɱVB = ɱVF
3x.0,2 + x . 0,6 = 0,3 . 0,8
0,6x + 0,6x = 0,24
1,2x = 0,24
x = 0,2 mol/L
Solução A = 3x = 0,6 mol/L
Solução B = X = 0,2 mol/L
12-RESP: C
Esta questão é sobre mistura de soluções de mesmo soluto, portanto não ocorre reação.
Portanto
VA + VB = VFVA = 0,4 - VB
4(0,4 – VB ) + 1,5VB = 2,5 . 0,4
1,6 – 4VB + 1,5VB = 1
-4VB + 1,5VB = 1 – 1,6
2,5VB = 0,6
VB = 0,24 (240 mL )
VA = VF – 5
VA = 0,4 – 0,24
VA = 0,16L ( 160 mL )
13-RESP: B
Esta questão é sobre mistura de soluções de mesmo soluto, portanto não ocorre reação.
Portanto
VA + VB = VF
na + nb = nf
0,16 mol ------ 0,5L
X ---------------- 1L
X= 0,32 mol/L
14-RESP: A
Errata: onde está escrito normalidade, considerar Molaridade ( concentração molar )
Esta questão é sobre mistura de soluções de mesmo soluto, portanto não ocorre reação.
0,3 mol ----- 0,48L
X ------------- 1L
X = 0,625 mol/L
Como achar a concentração molar da solução B
1 mol HCl ---- 36,5g
X --------------- 14,6 g
X= 0,4 mol
0,4mol ------- 0,5L
X -------------1L
X = 0,8 mol/L
15-RESOLUÇÃO
1º PASSO
Equacionar a realização de neutralização total entre o ácido e a base.
2º PASSO
Vamos utilizar a relação abaixo, para transformar em g/L
C = ɱ.M
C = 0,25.60
C = 15 g/L
Dica: Nos ácidos carboxílicos, o hidrogênio ionizável é aquele ligado ao carbono da carboxila. Portanto a proporção é de 1:1
16-RESOLUÇÃO
1º PASSO
Equacionar a realização de neutralização total entre o ácido e a base, calculando a concentração molar do ácido.
2º PASSO
Vamos utilizar a relação abaixo, para transformar em g/L
C = ɱ.M
C = 0,666 . 60
C = 39,96 g/L
17- RESP: D
A questão fornece os dados e a reação não balanceada. Portanto temos apenas que utilizar a fórmula e calcular a variação de entalpia
CH4(g) + F2(g) ![]() CHF3(g) + HF(g).
CHF3(g) + HF(g).
Dados:
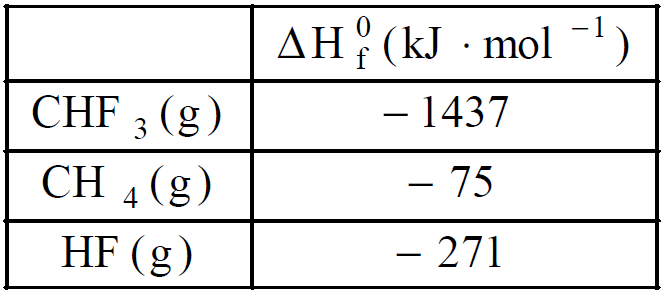
ΔH = HP - HR
ΔH = - 2250 – (-75)
ΔH = - 2175 kJ/mol metano
18-RESOLUÇÃO
A questão envolve mistura de soluções com reação química e a solução resultante será neutra, pois se trata de uma titulação.
19-RESOLUÇÃO
Esta questão é sobre relação entre as concentrações. A maneira mais fácil de resolver é utilizando a fórmula abaixo.
20- RESOLUÇÃO
A questão envolve mistura de soluções com reação química e a solução resultante será neutra de acordo com a informação no texto.
21- RESOLUÇÃO
A questão fornece a porcentagem (título), a densidade e diz que a solução é de cloreto de sódio (NaCl) e pede para calcular a concentração comum (C).
1º. Passo
Separar os dados:
22- RESOLUÇÃO
A questão é sobre a relação entre as concentrações, onde temos:
23- RESOLUÇÃO
Esta questão é envolve mistura de soluções com reação química ( titulação). O texto informa que ocorreu a neutralização.
O primeiro passo é equacionar a reação de neutralização total entre o ácido e a base. Lembrando que na neutralização total o sal formado é neutro, portanto o número de H+ é igual à quantidade de OH-
H2SO4 (aq) +2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (aq)
De acordo com o enunciado a solução resultante será neutra.
Dica: A solução resultante será neutra quando o número de mols dos reagentes obedecer a uma proporção.
Obs.: O sal formado na reação é neutro, mas nós estamos falando de uma solução.
Primeiro vamos determinar o número de mols dos reagentes.
Através do balanceamento da equação, notamos que a proporção é de 1:2
Com esta informação podemos calcular o número de mols da base e logo em seguida determinar a concentração molar desta solução.
TAMBÉM PODEMOS CALCULAR A CONCENTRAÇÃO MOLAR DA BASE, UTILIZANDO A FÓRMULA, POIS FOI INFORMADO QUE A SOLUÇÃO RESULTANTE É NEUTRA
Dica: prestar atenção na resolução, pois devido a um descuido você pode estar aplicando distributiva devido à presença do parênteses. Quando o correto é apenas a multiplicação.
24- RESOLUÇÃO
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do metano.
ΔH = HP - HR
ΔH = - 966 – (-75)
ΔH = - 891kJ/mol metano
Dica: Na combustão o valor de variação de entalpia, sempre será negativo, devido à liberação de calor.
A substância simples possui entalpia igual à zero no estado padrão.
25- RESP: D
Esta questão é envolve mistura de soluções com reação química ( titulação). O texto informa que ocorreu a neutralização.
O primeiro passo é equacionar a reação de neutralização total entre o ácido e a base. Lembrando que na neutralização total o sal formado é neutro, portanto o número de H+ é igual à quantidade de OH-
H2SO4 (aq) +2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (aq)
De acordo com o enunciado a solução resultante será neutra.
1º PASSO
Calcular a concentração molar da solução básica ( NaOH)
2º PASSO
A questão pede para calcular a concentração molar do sal formado ( solução final).
DICA:Podemos observar que a proporção(balanceamento) da equação é de 1:2:1,ou seja, reage 1 mol de ácido com 2 mol de base para formar 1 mol de sal (solução).
Através dos dados da questão, calculamos que temos 0,01 mol do ácido que reage com 0,02 mol da base para formar 0,01 mol do sal ( estamos seguindo a proporção ).
OBS: O volume é a soma, pois a solução final é resultado da mistura dos reagentes.
26- RESP: C
A questão indica que ocorreu uma titulação.Podemos concluir que a solução resultante é neutra e o número de mols dos reagentes obedece a uma proporção
27- RESP: C
A questão indica que ocorreu uma neutralização total. portanto concluímos que a solução resultante é neutra e o número de mols dos reagentes obedece a uma proporção
28- RESP: B
Obs.Nas alternativas,temos os valores de concentração em g/cm3. Para verificar a resposta correta, vamos transformar esta concentração molar em concentração em g/L e depois em g/cm3.
29- RESP: C
Questão envolvendo termoquímica, onde se pede para calcular a variação de entalpia (ΔH ).
Dica: Antes de iniciar a resolução já podemos afirmar que a variação de entalpia será negativa, pois se trata de uma combustão.
30- RESP: B
ΔH = HP - HR
ΔH = - 1180,5 – (-1155,7)
ΔH = - 24,8 kJ/mol Fe2O3
31- RESP: B
DICA : Reação endotérmica, a variação de entalpia tem sinal positivo.
32- RESP: A
ΔH = HP - HR
ΔH = - 680 – (-109)
ΔH = - 571kJ/mol
33- RESP: B
ΔH = HP - HR
ΔH = +228 – (-84)
ΔH = + 312kJ/mol
34- RESP: C
ΔH = HP - HR
ΔH = -4075,8 – (-1271)
ΔH = -2804,8 kJ/mol
35- RESP: D
A questão é sobre a relação entre as concentrações, onde temos:
Obs. Admitir a densidade da solução igual a 1g/mL












































