LISTA DE QUESTÕES DE ESTEQUIOMETRIA
01 - (FGV SP/2014)
O composto inorgânico alaranjado dicromato de amônio, (NH4)2Cr2O7, quando aquecido sofre decomposição térmica em um processo que libera água na forma de vapor, gás nitrogênio e também forma o óxido de cromo (III). Esse fenômeno ocorre com uma grande expansão de volume e, por isso, é usado em simulações de efeitos de explosões vulcânicas com a denominação de vulcão químico.

(http://pontociencia.org.br/experimentos-interna.php?experimento=204)
Quando 0,50 mol de dicromato de amônio decompõe-se termicamente, a quantidade em mol de vapor d’água formado é igual a
a) 0,25
b) 0,50
c) 1,0
d) 2,0
e) 4,0
02 - (UNICAMP SP/2014)
Na manhã de 11 de setembro de 2013, a Receita Federal apreendeu mais de 350 toneladas de vidro contaminado por chumbo no Porto de Navegantes (Santa Catarina). O importador informou que os contêineres estavam carregados com cacos, fragmentos e resíduos de vidro, o que é permitido pela legislação. Nos contêineres, o exportador declarou a carga corretamente - tubos de raios catódicos. O laudo técnico confirmou que a porcentagem em massa de chumbo era de 11,5 %. A importação de material (sucata) que contém chumbo é proibida no Brasil. Dados : Pb = 207,2
a) O chumbo presente na carga apreendida estava na forma de óxido de chumbo II. Esse chumbo é recuperado como metal a partir do aquecimento do vidro a aproximadamente 800 ºC na presença de carbono (carvão), processo semelhante ao da obtenção do ferro metálico em alto forno. Considerando as informações fornecidas, escreva a equação química do processo de obtenção do chumbo metálico e identifique o agente oxidante e o redutor no processo.
b) Considerando que o destino do chumbo presente no vidro poderia ser o meio ambiente aqui no Brasil, qual seria, em mols, a quantidade de chumbo a ser recuperada para que isso não ocorresse?
03 - (FATEC SP/2014)
Uma indústria compra soda caustica com teor de pureza de 80%, em NaOH. Antes de mandar o material para o estoque, chama o Técnico em Química para verificar se a informação procede.
No laboratório, ele dissolve 1 g do material em água, obtendo 10 mL de solução. Utilizando um indicador apropriado, realiza uma titulação, gastando 20 mL de HCl, a 0,5 mol/L.
Dados: Massas Molares (g/mol): NaOH = 40 e HCl = 36,5
Sobre o resultado da titulação, é correto afirmar que a informação
a) não procede, pois o grau de pureza é de 40%.
b) não procede, pois o grau de pureza é de 60%.
c) procede, pois o grau de pureza é de 80%.
d) procede, pois o teor de impurezas é de 80%.
e) procede, pois o teor de impurezas é de 40%.
04 - (MACK SP/2014)
A calcita é um mineral encontrado na forma de cristais e em uma grande variedade de formas, como também nas estalactites e estalagmites. É o principal constituinte dos calcários e mármores, ocorrendo também em conchas e rochas sedimentares. Pelo fato de ser composta por CaCO3, a calcita reage facilmente com HCl, formando cloreto de cálcio, gás carbônico e água.
Considerando que uma amostra de 10 g de calcita, extraída de uma caverna, ao reagir com quantidade suficiente de HCl, produziu 1,792 L de gás carbônico, medido nas CNTP, é correto afirmar que, essa amostra apresentava um teor de CaCO3 da ordem de
Dado: massa molar (g/mol) CaCO3 = 100
a) 75%
b) 80%
c) 85%
d) 90%
e) 95%
05 - (FUVEST SP/2014)
Para estudar a variação de temperatura associada à reação entre Zn(s) e Cu2+(aq), foram realizados alguns experimentos independentes, nos quais diferentes quantidades de Zn(s) foram adicionadas a 100 mL de diferentes soluções aquosas de CuSO4. A temperatura máxima (Tf) de cada mistura, obtida após a reação entre as substâncias, foi registrada conforme a tabela:
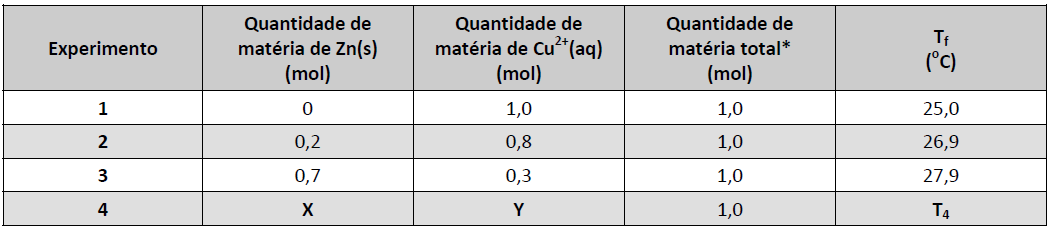
*Quantidade de matéria total = soma das quantidades de matéria iniciais de Zn(s) e Cu2+(aq).
a) Escreva a equação química balanceada que representa a transformação investigada.
b) Qual é o reagente limitante no experimento 3? Explique.
c) No experimento 4, quais deveriam ser os valores de X e Y para que a temperatura T4seja a maior possível? Justifique sua resposta.
06 - (UEL PR/2013)
O ácido acetilsalicílico (AAS), comumente chamado de aspirina, é obtido a partir da reação do ácido salicílico com anidrido acético. Essa reação é esquematizada do seguinte modo: Dados: ( C = 12 H = 1 O = 16 )
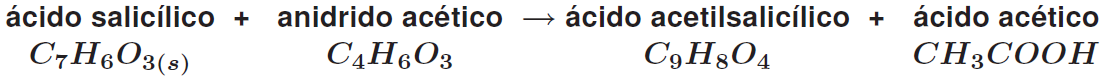
a) Qual é o reagente limitante da reação, partindo-se de 6,90 g de ácido salicílico e 10,20 g de anidrido acético? Justifique sua resposta apresentando os cálculos.
b) Foram obtidos 5,00 g de AAS. Calcule o rendimento da reação.
07 - (Fac. Santa Marcelina SP/2014)
Bicarbonato de sódio, NaHCO3, e hidróxido de alumínio, Al(OH)3, são alguns dos constituintes de medicamentos antiácidos que reagem com o excesso de ácido clorídrico, HCl, contido no suco gástrico, reduzindo a acidez estomacal.
O bicarbonato de sódio pode ser produzido a partir da reação química entre carbonato de sódio, gás carbônico e água, indicada na equação:
Na2CO3 + CO2 + H2O → 2 NaHCO3
Quando são produzidos 126 g do antiácido a partir de 1,0 mol de carbonato de sódio, o rendimento para esta reação em termos de produção de bicarbonato de sódio é igual a . Dados: Na = 23 H = 1 O = 16 C = 12 ).
a) 65%
b) 75%
c) 60%
d) 70%
e) 80%
08 - (MACK SP/2013)
A produção industrial do ácido sulfúrico é realizada a partir do enxofre, extraído de jazidas localizadas normalmente em zonas vulcânicas. O enxofre extraído é queimado ao ar atmosférico produzindo o anidrido sulfuroso (etapa I). Após essa reação, o anidrido sulfuroso é oxidado a anidrido sulfúrico, em alta temperatura e presença de um catalisador adequado (etapa II). Em seguida, o anidrido sulfúrico0 é borbulhado em água, formando o ácido sulfúrico (etapa III). As reações referentes a cada uma das etapas do processo encontram-se abaixo equacionadas:
Etapa I. S(s) + O2(g) → SO2(g)
Etapa II. 2 SO2(g) + O2(g) → 2 SO3(g)
Etapa III. SO3(g) + H2O(l) → H2SO4(l)
Desse modo, ao serem extraídos 200,0 kg de enxofre com 80% de pureza de uma jazida, considerando-se que o rendimento global do processo seja de 90%, a massa máxima de ácido sulfúrico que pode ser produzida será de
Dados: massas molares (g/mol): H = 1, O = 16 e S = 32.
a) 612,5 kg
b) 551,2 kg
c) 490,0 kg
d) 441,0 kg
e) 200,0 kg
9 - (UNIUBE MG/2013)
“Nas últimas décadas, a polêmica sobre um possível aquecimento global do nosso planeta, decorrente de uma exacerbação do efeito estufa, passou a fazer parte das preocupações da humanidade.”
“A retenção de energia pelos gases estufa decorre de um mecanismo, físico-químico, bem diferente daquele que ocorre nas estufas agrícolas. Cabe destacar que grande parte do efeito estufa natural se deve à presença de vapor d’água na atmosfera. Outros gases-estufa são o dióxido de carbono (CO2), o metano (CH4), o óxido nitroso (N2O), os clorofluorcarbonetos (CFCs), os hidroclorofluorcarbonetos (HCFCs) e o hexafluoreto de enxofre (SF6). ”
Fonte: Química nova na escola – Química no Efeito Estufa – N° 8, nov 1998
Um dos grandes problemas enfrentados atualmente pelos cientistas é tentar estudar uma forma de minimizar os efeitos causados pela emissão de gases que provocam, principalmente, o aquecimento global, fenômeno esse conhecido como efeito estufa. O gás carbônico é apontado como o grande vilão no agravamento desse fenômeno, já que sua existência na atmosfera provém, em grande parte, de atividades humanas em decorrência do aumento do uso de combustíveis fósseis derivados do petróleo. O tipo de queima desses combustíveis pode ser representado por:
Combustível + O2 → produtos + energia
A combustão completa do metanol produz dióxido de carbono e água. O volume de CO2 formado a partir da queima de 3,2 kg desse combustível nas condições de 1 atm e 27 ºC é de, aproximadamente: Dados : C = 12 O = 16 H = 1
a) 2460 L
b) 2,46 . 103 mL
c) 2,46 L
d) 221 L
e) 0,22 L
10 - (Fac. de Ciências da Saúde de Barretos SP/2014)
A anilina (C6H5NH2), matéria-prima importante para diversos ramos das indústrias química e farmacêutica, pode ser obtida pela reação entre nitrobenzeno e ferro, representada pela seguinte equação: 4 C6H5NO2 + 9 Fe + 4 H2O → 4 C6H5NH2 + 3 Fe3O4 + 540 kJ
Supondo um rendimento de 100%, é correto afirmar que a massa, em kg, de anilina obtida pela reação completa de 246 kg de nitrobenzeno é igual a
a) 212
b) 322
c) 246
d) 186
e) 392
11 - (IFGO/2014)
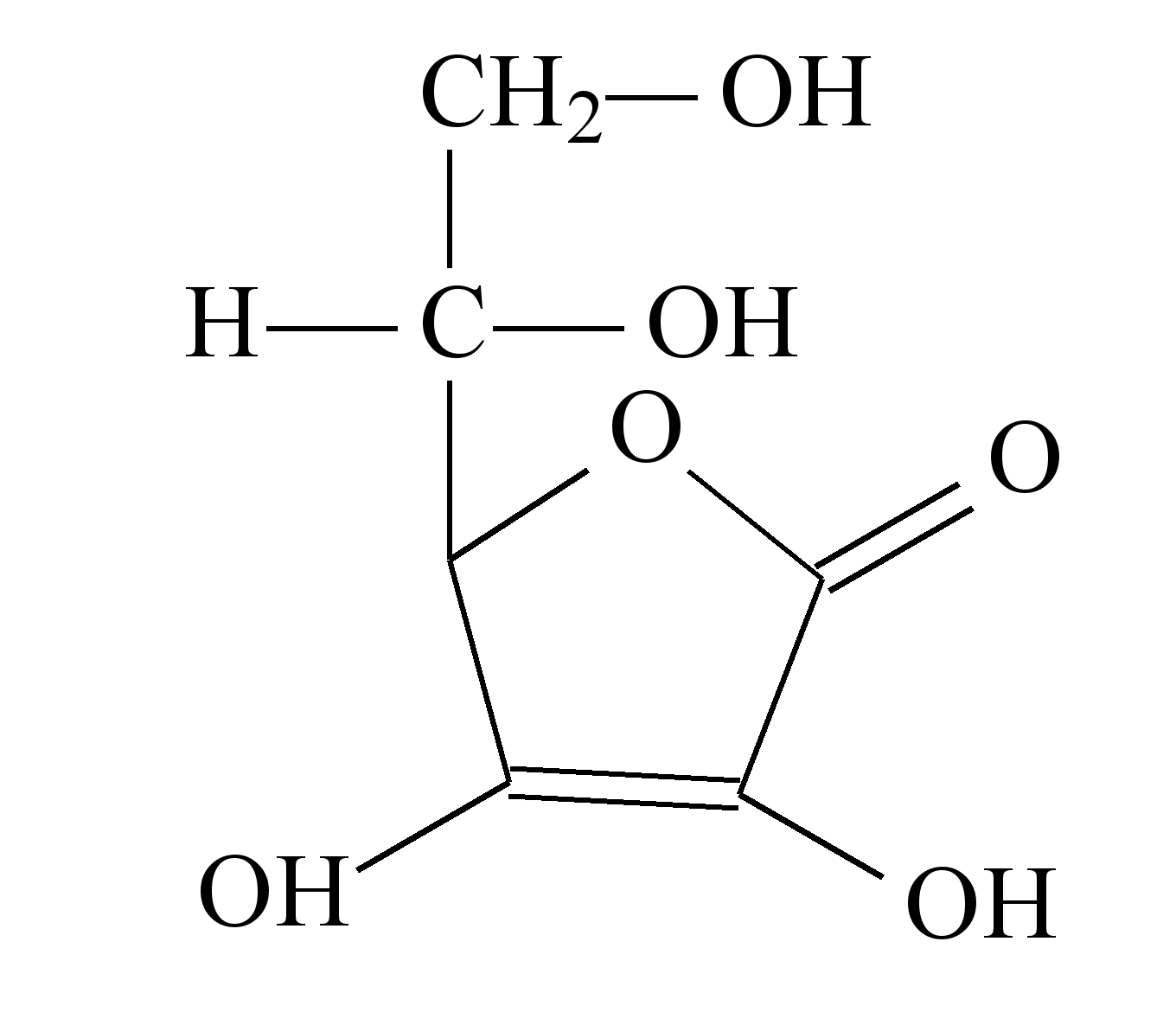
A vitamina C tem sido, há muito tempo, motivo de grandes controvérsias. A recomendação diária é de apenas 60 mg/dia. Muitos cientistas têm discordado desses valores, incluindo Linus Pauling, laureado com dois Prêmios Nobel e que, pessoalmente, recomendava 3g/dia (3000 mg). Sabe-se que os 60 mg são recomendados para a prevenção de escorbuto, mas não se sabe ainda o que seria a dosagem ideal para a potencialização máxima da saúde.
Tem-se discutido muito a utilização da vitamina C, não apenas para a prevenção do resfriado comum, mas, principalmente, para prevenir a incidência de câncer, doenças cardiovasculares e outras patologias.
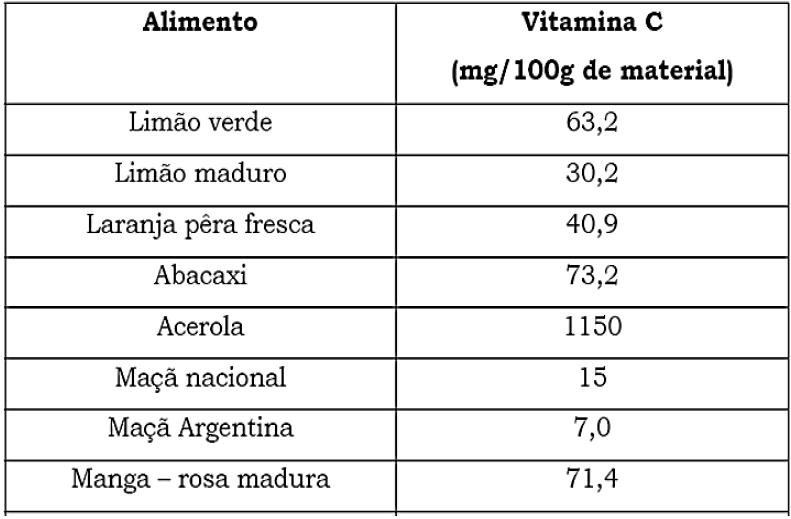
A quantidade de maçã nacional, em massa, que uma pessoa deveria ingerir diariamente, para suprir as necessidades diárias de vitamina C, segundo Linus Pauling, é de:
a) 400 g maçãs
b) 20.000 kg maçãs
c) 20 kg maçãs
d) 20 g maçãs
e) 40 kg maçãs
12 - (UNESP SP/2014)
A hidrazina, substância com fórmula molecular N2H4, é um líquido bastante reativo na forma pura. Na forma de seu monoidrato, N2H4 · H2O, a hidrazina é bem menos reativa que na forma pura e, por isso, de manipulação mais fácil. Devido às suas propriedades físicas e químicas, além de sua utilização em vários processos industriais, a hidrazina também é utilizada como combustível de foguetes e naves espaciais, e em células de combustível.
A atuação da hidrazina como propelente de foguetes envolve a seguinte sequência de reações, iniciada com o emprego de um catalisador adequado, que rapidamente eleva a temperatura do sistema acima de 800 ºC:
3 N2H4 (l) → 4 NH3 (g) + N2 (g)
N2H4(l) + 4 NH3 (g) → 3 N2 (g) + 8 H2 (g)
Dados: Massas molares, em g · mol—1: N = 14,0; H = 1,0
Calcule a massa de H2 e o volume total dos gases formados, medido nas CNTP, gerados pela decomposição estequiométrica de 1,0 g de N2H4 (l).

