Lista de Exercícios 1 - Parte 1
01 - (UFPR/2013)
Em festas e churrascos em família, é costume usar geleiras de isopor para resfriar bebidas enlatadas ou engarrafadas. Para gelar eficientemente, muitas pessoas costumam adicionar sal e/ou álcool à mistura gelo/água. A melhor eficiência mencionada se deve ao fato de que a presença de sal ou álcool:
a) aumenta a taxa de transferência de calor. b) abaixa a temperatura do gelo.
c) aumenta a temperatura de ebulição. d) abaixa a temperatura de fusão.
e) abaixa a dissipação de calor para o exterior.
02 - (UFRN/2012)
Sorvete em cinco minutos.
Uma receita rápida, prática e que parece mágica para o preparo de um sorvete de morango recomenda o seguinte procedimento:
Despeje o leite, o açúcar e a essência de morango num saco de plástico de 0,5 litro e certifique-se de que ele fique bem fechado. Coloque 16 cubos de gelo e 6 colheres de sopa de sal comum (NaCl) num outro saco plástico de 1 litro. Insira o saco de 0,5 litro dentro do saco de 1 litro e feche muito bem. Agite as bolsas de plástico por 5 minutos e, após esse tempo, remova o saco de 0,5 litro de dentro do outro. Em seguida, corte um dos bicos inferiores do saco de 0,5 litro e despeje o sorvete no recipiente de sua preferência.
O que parece mágica, ou seja, o congelamento do sorvete a uma temperatura (-20ºC) mais baixa que 0ºC, pela solução aquosa de NaCl, é explicado pela propriedade coligativa de diminuição da temperatura de início de solidificação.
Outro soluto que pode produzir a mesma diminuição da temperatura que o NaCl é
a)cloreto de potássio b) cloreto de cálcio c)glicose d)sacarose
03 - (UESPI/2011)
Em países frios, é comum a utilização de água e etilenoglicol no radiador de carros para evitar o congelamento do líquido. Esta mistura pode baixar a temperatura de congelamento até –35°C (a água pura congela a 0°C). Esta característica se deve ao fato de que:
a) a temperatura de início de congelamento do solvente de uma solução (água + etilenoglicol) é menor que a temperatura de início de congelamento do solvente puro (água).
b) o etilenoglicol reage com a água liberando energia que irá aquecer o radiador.
c) o etilenoglicol cria uma camada protetora no radiador, impedindo a perda de calor no sistema.
d) quanto menor a concentração da solução, menor será a temperatura de início do congelamento.
e) o composto formado nesta reação, o etilenoglicol hidratado, possui menor ponto de fusão.
04 - (UFU MG/2011)
As contribuições da ciência e tecnologia marcaram os últimos séculos em todos os setores da sociedade. Na indústria, por exemplo, a produção do café solúvel pode ser compreendida a partir da mudança de estado físico da água, descrita pelo diagrama de fases abaixo:
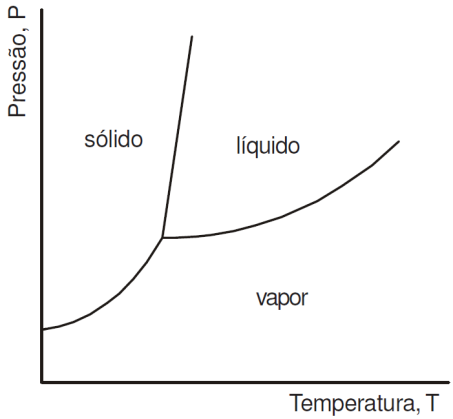
A partir da análise do diagrama de fases, proponha um procedimento, que explique como é possível a obtenção do café solúvel desidratado, sem, contudo, ocorrer a perda de suas propriedades. Considere que, no processo da fabricação desse gênero alimentício, a primeira etapa é a preparação de uma solução contendo água e o café já torrado e moído.
05 - (FGV SP/2011)
Considerando a água pura, uma solução aquosa de glicose de concentração igual a 3,0 mol L–1 e uma solução aquosa de cloreto de cálcio de concentração igual a 1,0 mol L–1, assinale a alternativa que apresenta a ordem correta para as temperaturas de ebulição (Te ) desses líquidos.
a) Te água > Te da solução contendo glicose > Te da solução contendo CaCl2.
b) Te água < Te da solução contendo glicose < Te da solução contendo CaCl2.
c) Te água = Te da solução contendo glicose = Te da solução contendo CaCl2.
d) Te água < Te da solução contendo glicose = Te da solução contendo CaCl2.
e) Te água > Te da solução contendo glicose = Te da solução contendo CaCl2.
06 - (UFU MG)
A respeito das propriedades das soluções, considere as afirmativas abaixo.
I. A água do mar ferve a uma temperatura mais baixa que a água pura, ambas ao nível do mar.
II. A água do mar congela a uma temperatura mais baixa que a água pura, ambas ao nível do mar.
III. Uma solução aquosa de sacarose ferve a uma temperatura mais alta que a água pura, ambas ao nível do mar.
IV. Uma solução aquosa de sacarose congela a uma temperatura mais alta que a água pura, ambas ao nível do mar.
Dentre essas afirmações:
a) Todas são incorretas. b) I e IV são corretas. c) I é correta e III é incorreta. d) II e III são corretas.
07 - (FFFCMPA RS)
Dona Inez é uma dona de casa que está preparando o almoço. Em um determinado procedimento ela coloca 11,7 gramas de sal de cozinha (NaCl = 58,5 g/mol) em 2,0 litros de água e aquece. Seu marido, Benjamim, mede a temperatura do sistema quando este entra em ebulição, e diz para sua esposa que pode atingir esta mesma temperatura de ebulição colocando uma determinada massa de açúcar (sacarose – ![]() ) num mesmo volume de água. No entanto, ela duvida. Para que esse efeito ocorra, a massa de sacarose que ele deverá colocar no sistema será de
) num mesmo volume de água. No entanto, ela duvida. Para que esse efeito ocorra, a massa de sacarose que ele deverá colocar no sistema será de
a) 11,7 gramas b) 23,4 gramas c) 58,5 gramas d) 68,4 gramas e) 136,8 gramas
08 - (UEL PR)
A adição de um soluto não volátil a um solvente dificulta sua ebulição e seu congelamento. Isto pode ser útil na prática quando, por exemplo, se pretende cozinhar um ovo mais rápido ou então quando é necessário evitar o congelamento da água do radiador de carros em países muito frios. Considere as duas soluções aquosas de NaCl, conforme o quadro, e analise as afirmativas a seguir.

I. A solução B tem pressão de vapor menor que a da solução A, na mesma temperatura.
II. As soluções A e B apresentam pontos de ebulição menores que o da água pura.
III. Independentemente da quantidade de soluto, as duas soluções apresentam o mesmo ponto de ebulição.
IV. A solução B entra em ebulição a uma temperatura mais alta que a solução A.
Estão corretas apenas as afirmativas:
a) I e IV. b) II e IV. c) II e III. d) I, II e III. e) I, III e IV.
09 - (PUC PR)
Propriedades coligativas são aquelas que dependem exclusivamente da quantidade de soluto presente na solução e não da natureza do mesmo. Assim, soluções de mesma molaridade podem apresentar pontos de ebulição diferentes, dependendo do tipo de soluto presente.
Dadas as soluções de igual concentração mol/L, a que apresentará maior temperatura de ebulição será:
a) sacarose. b) ácido etanóico. c) ácido cianídrico. d) hidróxido de sódio. e) cloreto de cálcio.
10 - (FAMECA SP/2013)
Soluções isotônicas são aquelas que apresentam a mesma concentração de partículas (moléculas ou íons).
Se uma solução de nitrato de cálcio apresenta concentração igual a 0,2 mol * L–1, ela será isotônica de uma solução de
a) sulfato de sódio de concentração 0,2 mol * L–1.
b)cloreto de cálcio de concentração 0,3 mol * L–1.
c) nitrato de cálcio de concentração 0,3 mol * L–1.
d) nitrato de alumínio de concentração 0,2 mol * L–1.
e) solução de glicose de concentração 0,2 mol * L–1.
11 - (FAMECA SP/2013)
Água é um recurso natural que, apesar de renovável, tem apresentado diminuição de oferta devido a uma crescente demanda. Considerando que 97% da água do mundo é salgada, novas usinas de dessalinização mais baratas poderiam expandir a oferta de água doce para os centros populacionais costeiros. Os esquemas a seguir mostram duas maneiras de se retirar o sal da água.
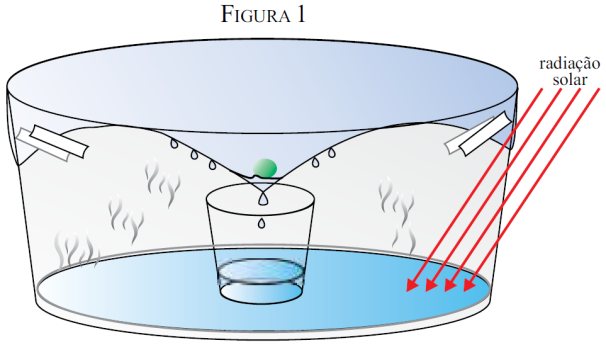
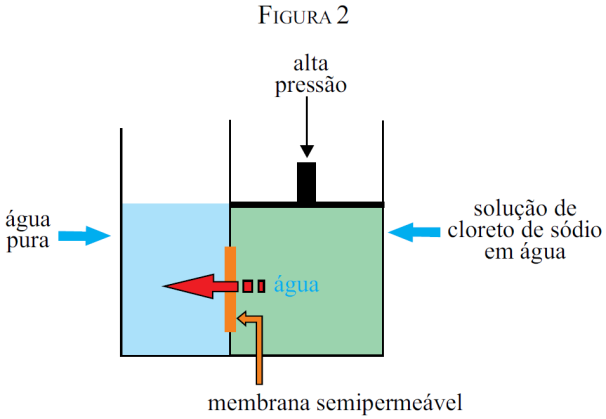
(http://inventomania.wordpress.com)
Os esquemas apresentados nas figuras 1 e 2 representam, respectivamente, processos de dessalinização conhecidos como
a) filtração e osmose reversa. b) destilação e decantação. c) decantação e evaporação.
d) filtração e decantação. e) destilação e osmose reversa.
12 - (Fac. Santa Marcelina SP/2012)
Entre as alternativas, a que exemplifica corretamente um par de soluções aquosas isotônicas é
a) glicose 0,30 mol/L e cloreto de sódio 0,15 mol/L.
b) glicose 0,30 mol/L e cloreto de sódio 0,30 mol/L.
c) glicose 0,15 mol/L e cloreto de sódio 0,30 mol/L.
d) cloreto de sódio 0,15 mol/L e cloreto de cálcio 0,30 mol/L.
e) cloreto de sódio 0,15 mol/L e cloreto de cálcio 0,15 mol/L.
13 - (UFES/2011)
O fenômeno de osmose ocorre quando duas soluções com concentrações diferentes estão separadas por uma membrana permeável somente ao solvente. A pressão osmótica é dada pela equação: p = i c RT, onde i é o fator de van’t Hoff; c é a concentração em mol L-1; R é a constante dos gases (0,082 L atm mol-1 K-1) e T a temperatura em Kelvin. A pressão osmótica no sangue humano a 37ºC é 7,6 atm.
a) Calcule a concentração, em % (m/v), de uma solução de NaCl que exerce a mesma pressão osmótica do sangue (solução isotônica).
b) Calcule a massa de cloreto de sódio que deve ser pesada para preparar 500 mL de soro fisiológico (solução isotônica) a serem injetados no sangue.

