Lista de exercícios–Química – prof. Raimundo. 1º. Trimestre - 2º. Ens. Médio 2017
- REAÇÕES INORGÂNICAS
- CONCENTRAÇÃO COMUM.
- TEORIA ATÔMICA MOLECULAR.
- COEFICIENTE DE SOLUBILIDADE
- CONCENTRAÇÃO MOLAR.
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
01 - (UNIRG TO/2016)
O hidróxido de magnésio pode ser usado para neutralizar excesso de ácido clorídrico presente no suco gástrico. Considerando a equação balanceada com os menores coeficientes inteiros possíveis para essa reação, são feitas as seguintes afirmações:
I. O valor da soma dos coeficientes dos reagentes dessa reação é igual a 3.
II. Um dos produtos formados a partir dessa reação é o sal cloreto de magnésio.
III. Ocorre uma reação de neutralização envolvendo uma base fraca e um ácido fraco.
Assinale a única alternativa que apresenta todos os itens corretos:
a) I apenas.
b) II e III, apenas.
c) I e II, apenas.
d) I e III, apenas.
02 - (PUC Camp SP/2016)
O consumo excessivo de sal pode acarretar o aumento da pressão das artérias, também chamada de hipertensão. Para evitar esse problema, o Ministério da Saúde recomenda o consumo diário máximo de 5 g de sal (1,7 g de sódio). Uma pessoa que consome a quantidade de sal máxima recomendada está ingerindo um número de íons sódio igual a
Dados: Massa molar do Na = 23,0 g/mol.
a) 1,0![]() 1021
1021
b) 2,4![]() 1021
1021
c) 3,8![]() 1022
1022
d) 4,4![]() 1022
1022
e) 6,0![]() 1023
1023
03 - (Centro Universitário de Franca SP/2016)
O quadro apresenta a estrutura da vitamina C e sua solubilidade em água em função da temperatura.
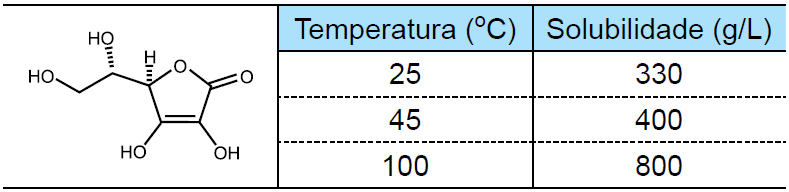
Qual a massa de vitamina C, em gramas, que pode ser cristalizada quando 2 litros de solução saturada dessa vitamina a 100 ºC são resfriados para 45 ºC?
04 - (FEI SP)
Tem-se 180g de uma solução aquosa de sacarose (C12H22O11), saturada a 50°C. Qual a massa de cristais que se separam da solução, quando ela é resfriada até 30°C? Dados: Coeficiente de solubilidade (Cs) da sacarose em água: Cs à 30°C = 220g/100g de água Cs à 50°C = 260g/100g de água
05 - (PUC Camp SP)
A fábrica de pele
As seguintes etapas são utilizadas pela “fábrica de pele” alemã para produzir 100 discos de pele reconstituída a partir de uma amostra, num processo que dura 6 semanas.
1a etapa: Com uma biópsia, extrai-se um pequeno pedaço de pele do voluntário.
2a etapa: Um braço robótico corta a pele em pedacinhos.
3a etapa: Com a ajuda de enzimas, uma máquina separa dois tipos de células: os queratinócitos, da superfície, e os fibroblastos, que compõem a parte interna da pele.
4a etapa: Os dois tipos são cultivados em biorreatores e se replicam. As células produzem colágeno, proteína que ajuda a unir e fortalecer os tecidos.
5a etapa: Os fibroblastos são despejados em frascos onde formam a derme. Nutrientes são adicionados para ajudar no processo.
6a etapa: Por cima da derme são acrescentados os queratinócitos, que ajudam a formar a epiderme.
7a etapa: Fica tudo numa incubadora a 37 ºC até a pele adquirir a forma final. O resultado tem as mesmas camadas que formam o tecido humano: derme, epiderme e subdivisões.
(Adaptado: Revista Galileu, julho de 2011, p. 47)
Nutrientes para a pele, como as vitaminas A e E, ajudam a reduzir os danos causados pelos radicais livres, graças às suas fortes propriedades antioxidantes. A dose diária de vitamina C recomendada para satisfazer as necessidades do corpo é de 100 mg. Assim, ao dissolver essa quantidade de vitamina C em meio copo d’água (cerca de 100 mL), obtém-se uma solução de vitamina C de concentração, em g/L igual a quanto?
06 - (UNESP SP/2015)
Em um laboratório didático, um aluno montou pilhas elétricas usando placas metálicas de zinco e cobre, separadas com pedaços de papel-toalha, como mostra a figura.
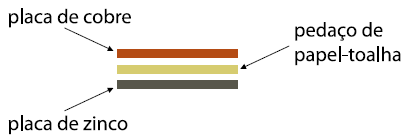
Com o conjunto e os contatos devidamente fixados, o aluno adicionou uma solução de sulfato de cobre II (CuSO4) aos pedaços de papel-toalha de modo a umedecê-los e, instantaneamente, houve o acendimento da lâmpada.
Sabe-se que o aluno utilizou 63,8g de sulfato de cobre II para preparar uma solução de concentração igual a 1,00 mol L–1. Calcule o volume em mL de água necessária para o preparo desta solução.
07 - (Univag MT/2014)
Devido à sua propriedade germicida, o permanganato de potássio (KMnO4) pode ser empregado no tratamento de feridas.
Qual a massa em gramas necessária desse germicida para preparar 2,5 L de solução 0,02 mol/L ?
08 - (UFPEL RS/2015)
Segundo algumas orientações nutricionais, a dose diária recomendada de vitamina C (C6H8O6), a ser ingerida por uma pessoa adulta, é de 2,5 X 10–4 mol. Se uma pessoa consome, diariamente, uma cápsula de 440 mg dessa vitamina, a dose consumida por esse paciente é X vezes maior do que a recomendada. Nesse caso, X equivale a quanto?
09 - (IFPE/2015)
O sulfato ferroso faz parte da composição de remédios indicados para combater a anemia (deficiência de ferro). Esses remédios são usados para combater a deficiência alimentar de ferro, prevenção de anemia e reposição das perdas de ferro por dificuldades na absorção. Considere um vidro de remédio de 200mL que contém 3,04g de sulfato ferroso dissolvido na solução. Assinale a alternativa que indica corretamente a concentração, em quantidade de matéria por litro (mol/L), do ferro (II) no sulfato ferroso, presente neste remédio. Dados: Fe =56 S = 32 O = 16
a) 0,05
b) 0,20
c) 0,60
d) 0,10
e) 0,40
10 - (Unimontes MG/2015)
Os dados abaixo se referem às substâncias, carbono, eteno, dióxido de carbono e glicose. Essas substâncias encontram-se representadas por I, II, III e IV, respectivamente.
I. 12,0 g de C.
II. 8 mols de C2H2.
III. 9,0 x 1023 moléculas de CO2.
IV. 180,0 g de C6H12O6.
Em relação aos dados fornecidos, apresenta maior número de átomos de carbono à substância representada em
a) I.
b) III.
c) IV.
d) II.
11 - (Fac. Santa Marcelina SP/2014)
A cafeína é muito utilizada por atletas, mas existe preocupação com o abuso do seu consumo. Recentemente, alguns estudos mostraram que os efeitos da cafeína na melhora da tolerância ao exercício prolongado devem-se ao aumento da mobilização da gordura durante o exercício, preservando os estoques de glicogênio muscular.
O gráfico representa a curva de solubilidade da cafeína em água.
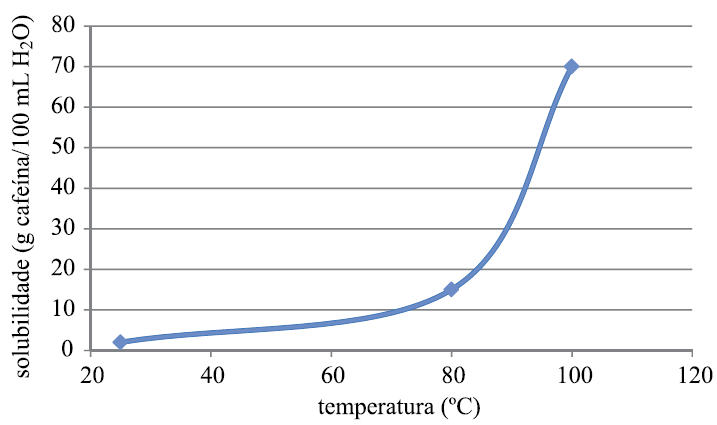
Quando uma solução saturada de cafeína contendo 200 mL de água é resfriada de 100 ºC para 80 ºC, a quantidade máxima de cafeína cristalizada, em gramas, será igual a
a) 110.
b) 70.
c) 35.
d) 55.
e) 15.
12 - (Centro Universitário São Camilo SP/2014)
O selênio (Se) é um micronutriente que tem sido associado à redução de risco de alguns tipos de câncer. No entanto, o excesso desse mineral pode causar selenose. A figura apresenta um dos alimentos mais ricos em selênio e o teor de Se encontrado na análise de uma amostra oriunda da região Amazônica.

(www.agencia.cnptia.embrapa.br. Adaptado.)
Um homem adulto ingeriu 7,2 × 1017 átomos de selênio, ao consumir castanhas do Brasil com as características indicadas na figura. Dado que a constante de Avogadro é 6,0 × 1023 mol–1 e 1g = 10–6g, é correto afirmar que o número de castanhas do Brasil consumidas por esse adulto foi
a) 2.
b) 1.
c) 5.
d) 3.
e) 4.
TEXTO: Comum às questões: 10, 11
As informações destacadas abaixo foram retiradas do rótulo de um refrigerante “zero açúcar”:

A água gaseificada apresenta o seguinte equilíbrio químico:
CO2(aq) + 2 H2O(l) ![]() HCO3–(aq) + H3O+(aq)
HCO3–(aq) + H3O+(aq)
E ainda estão presentes acidulantes utilizados para realçar o sabor e para inibir o desenvolvimento de microrganismos. Os acidulantes, comumente usados pela indústria alimentícia, são os ácidos cítrico (C6H8O7) e fosfórico (H3PO4). Para regular a acidez do meio usa-se o citrato de sódio (C6H7O7Na) e para substituir o açúcar usa-se o aspartame (C14H18N2O5) e o ciclamato de sódio (NaC6H12SNO3).
13 - (UEPA/2015)
Sobre a presença do aspartame em 100 mL do refrigerante, é correto afirmar que a concentração desse adoçante no meio é:
a) 0,0012 g/L
b) 0,012 g/L
c) 0,12 g/L
d) 12,0 g/L
e) 120,0 g/L
14 - (UEPA/2015)
Em 100 mL do refrigerante, exposto no Texto XXV, à concentração em mol/L de ciclamato de sódio (NaC6H12SNO3), conforme o rótulo, é:
Dados: considere a massa molar do ciclamato de sódio=201 g/mol.
a) 5,0 x10–4 mol/L
b) 1,2 x10–3 mol/L
c) 3,5 x10–3 mol/L
d) 4,7 x10–3 mol/L
e) 5,5 x10–3 mol/L
15 - (UNIFICADO RJ/2015)
Aciclovir é um antiviral indicado no tratamento do vírus do herpes humano, incluindo o vírus do herpes simplex, tipos 1 e 2, e o vírus varicella zoster.
Há, no mercado, comprimidos de aciclovir de 200 mg, 400 mg e 800 mg. Há também a forma em xarope, com apresentação de 200 mg/5 mL. Portanto, a concentração em quantidade de matéria do aciclovir no xarope é, em mol.L–1,
Dado: A massa molar do aciclovir é 225 g/mol.
a) 0,18
b) 0,28
c) 0,58
d) 0,88
e) 0,98
16 - (UDESC SC/2013)
A figura abaixo representa a curva de solubilidade de alguns sais.
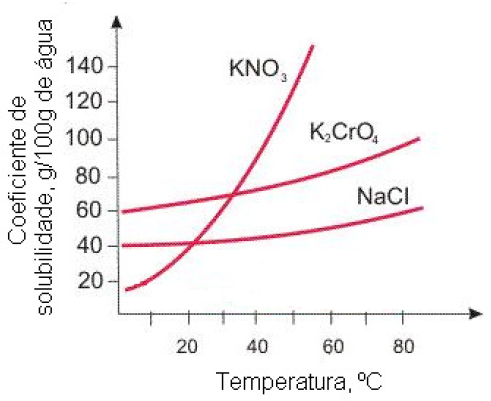
Assinale a alternativa que representa, sequencialmente, a massa (em gramas) de nitrato de potássio que é cristalizada e a massa que permanece na solução, quando uma solução aquosa saturada desse sal a 50ºC é resfriada para 20ºC.
a) 90g e 40g
b) 40g e 90g
c) 90g e 130g
d) 10g e 65g
e) 05g e 40g
17 - (Univag MT/2013)
A solubilidade em água do glutamato monossódico mono-hidratado, sal muito utilizado na culinária oriental para reforçar o sabor dos alimentos, é cerca de 60 g/100 mL a 20 ºC. Sabendo que a fórmula molecular dessa substância é C5H8NNaO4.H2O, conclui-se que a concentração aproximada, em mol/L, de uma solução saturada desse sal a 20 ºC é
a) 4.
b) 5.
c) 2.
d) 1.
e) 3.
18 - (UDESC SC/2011)
A tabela a seguir refere-se à solubilidade de um determinado sal nas respectivas temperaturas:

Para dissolver 40 g desse sal à 50ºC e 30ºC, as massas de água necessárias, respectivamente, são:
a) 58,20 g e 66,67 g
b) 68,40 g e 57,14 g
c) 57,14 g e 66,67 g
d) 66,67 g e 58,20 g
e) 57,14 g e 68,40 g
19 - (UESPI/2011)
Certa substância X pode ser dissolvida em até 53g a cada 100 mL de água (H2O). As soluções formadas por essa substância, descritas a seguir, podem ser classificadas, respectivamente, como:
1. 26,5g de X em 50 mL de H2O
2. 28g de X em 100 mL de H2O
3. 57,3g de X em 150 mL de H2O
4. 55g de X em 100 mL de H2O
a) Insaturada, Insaturada, Saturada com precipitado e Saturada.
b) Saturada, Saturada, Saturada com precipitado e Insaturada.
c) Saturada com precipitado, Insaturada, Saturada e Saturada.
d) Saturada com precipitado, Insaturada, Insaturada e Saturada.
e) Saturada, Insaturada, Insaturada e Saturada com precipitado.
20 - (UNESP SP)
No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em gramas de soluto por 1000 g de água).
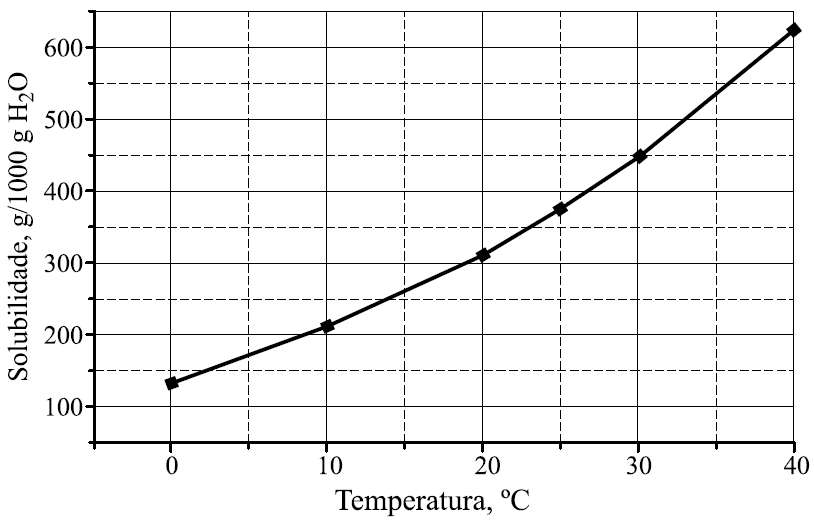
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução deve estar a uma temperatura, aproximadamente, igual a
a) 12 °C.
b) 17 °C.
c) 22 °C.
d) 27 ºC.
e) 32 °C.
21 - (UFV MG)
A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico abaixo:
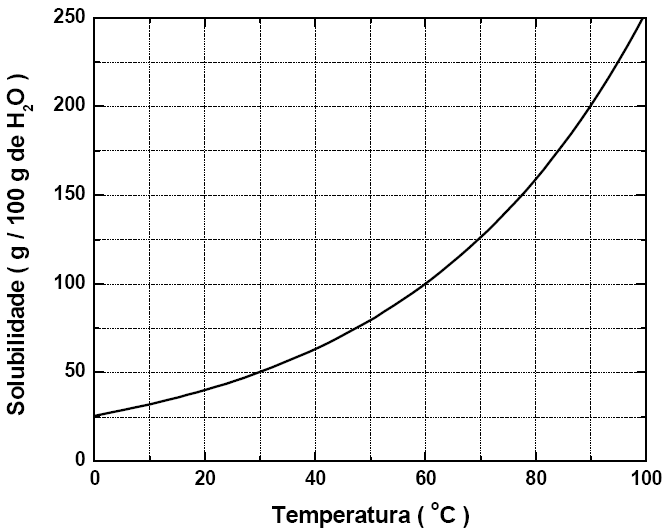
De acordo com o gráfico, assinale a alternativa que indica CORRETAMENTE a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 °C:
a) 250
b) 375
c) 150
d) 100
e) 500
22 - (UFMS)
Preparou-se uma solução saturada de nitrato de potássio (KNO3), adicionando-se o sal a 50 g de água, à temperatura de 80°C. A seguir, a solução foi resfriada a 40°C. Qual a massa, em gramas, do precipitado formado?
Dados:
![]()
23 - (FMJ SP/2014)
Considere as informações sobre o brometo de ipratrópio, fármaco empregado no tratamento de doenças respiratórias como broncodilatador.
Estrutura:
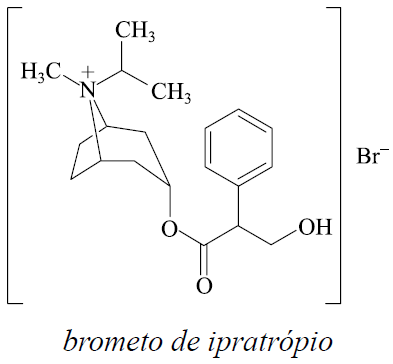
Massa molar aproximada: 4 × 102 g/mol
Informação extraída da bula:
Cada mL (20 gotas) da solução para inalação contém:
brometo de ipratrópio........... 0,25 mg
veículo q.s.p. ........................ 1 mL
(cloreto de benzalcônio, acetato dissódico, cloreto de sódio, ácido clorídrico e água purificada.)
A quantidade de brometo de ipratrópio, em mol, que entra no organismo do paciente a cada mililitro de solução inalada é, aproximadamente,
a) 2 x 10–5.
b) 3 x 10–7.
c) 6 x 10–7.
d) 3 x 104.
e) 6 x 105.
24 - (Unicastelo SP/2014)
Utilize as informações reunidas na tabela, obtidas do rótulo de uma água mineral natural.
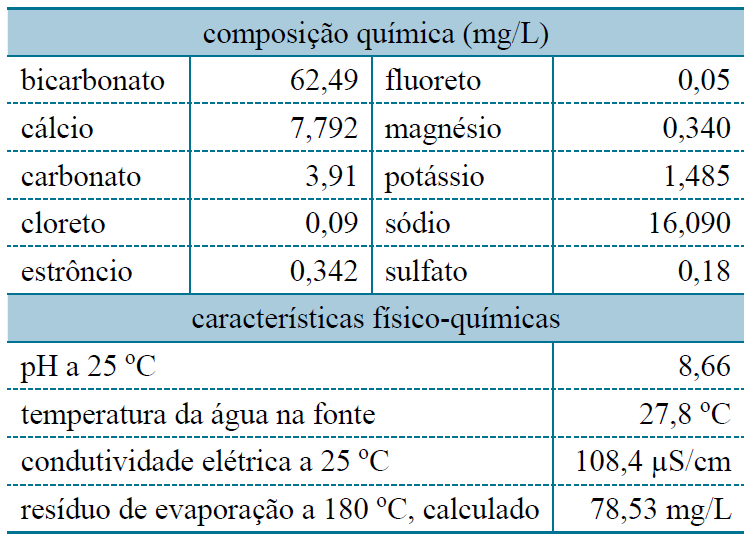
Segundo as informações da tabela, a massa total de íons de metais alcalino-terrosos dissolvidos nessa água, em mg/L, é igual a
a) 4,180.
b) 8,132.
c) 17,575.
d) 8,474.
e) 0,682.
25 - (UFSCAR SP/2013)
Após a conclusão do ensino médio, uma jovem estudante começou a se preparar para a realização das provas de vestibulares de algumas universidades. Em certo dia, durante os estudos, sentiu azia estomacal. Preocupada, sua mãe dissolveu todo o conteúdo de um envelope de medicamento num copo d’água (200 mL) e deu para a filha tomar. Após o alívio estomacal, a estudante pediu para ver o envelope do medicamento e anotou a sua composição:
• bicarbonato de sódio: 2,10 g
• carbonato de sódio: 0,50 g
• ácido cítrico: 2,25 g
A estudante, entusiasmada, recordou das aulas de química e lembrou-se de alguns conceitos, como soluções e reações químicas, especialmente da reação entre o carbonato de sódio e o ácido produzido pelo estômago, o HCl:
xHCl+ yNa2CO3 ![]() NaCl+ wCO2 + uH2O
NaCl+ wCO2 + uH2O
Se o envelope do medicamento contivesse somente bicarbonato de sódio (2,10 g) e se o volume final do conteúdo do copo d’água não se alterasse após a dissolução do medicamento, é correto afirmar que a concentração, em mol/L, de bicarbonato de sódio (massa molar 84 g/mol) nesta solução seria de
a) 0,025.
b) 0,050.
c) 0,075.
d) 0,100.
e) 0,125.
26 - (ESCS DF/2014)
Há muitos séculos, a humanidade aprendeu a utilizar as propriedades biológicas de substâncias presentes nas plantas. Por exemplo, no século V a.C., o médico grego Hipócrates relatou que a casca do salgueiro branco (Salix alba) aliviava dores e diminuía a febre. O responsável por essas atividades terapêuticas é o ácido salicílico, gerado pela metabolização, pelas enzimas do fígado, da salicilina presente no salgueiro. O ácido salicílico, apesar de suas propriedades terapêuticas, provoca lesões nas paredes do estômago. Para solucionar esse problema, a molécula foi modificada pelo laboratório alemão Bayer, em 1897, por meio da inserção de um grupo acetil. Assim surgiu o ácido acetilsalicílico, primeiro fármaco sintético empregado na terapêutica e que é hoje o analgésico mais consumido e vendido no mundo. A seguir, são apresentadas as estruturas moleculares da salicilina, do ácido salicílico e do ácido acetilsalicílico.
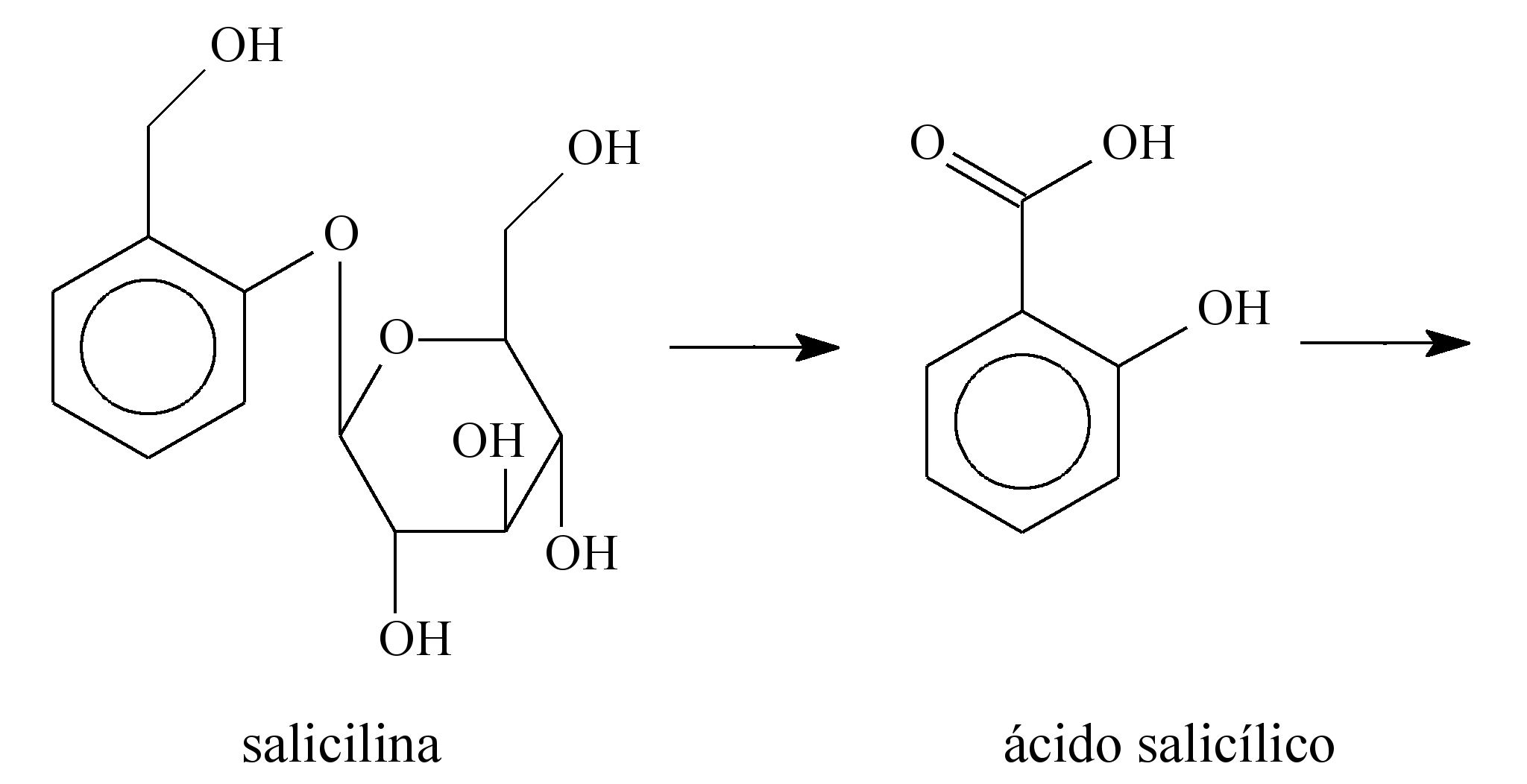
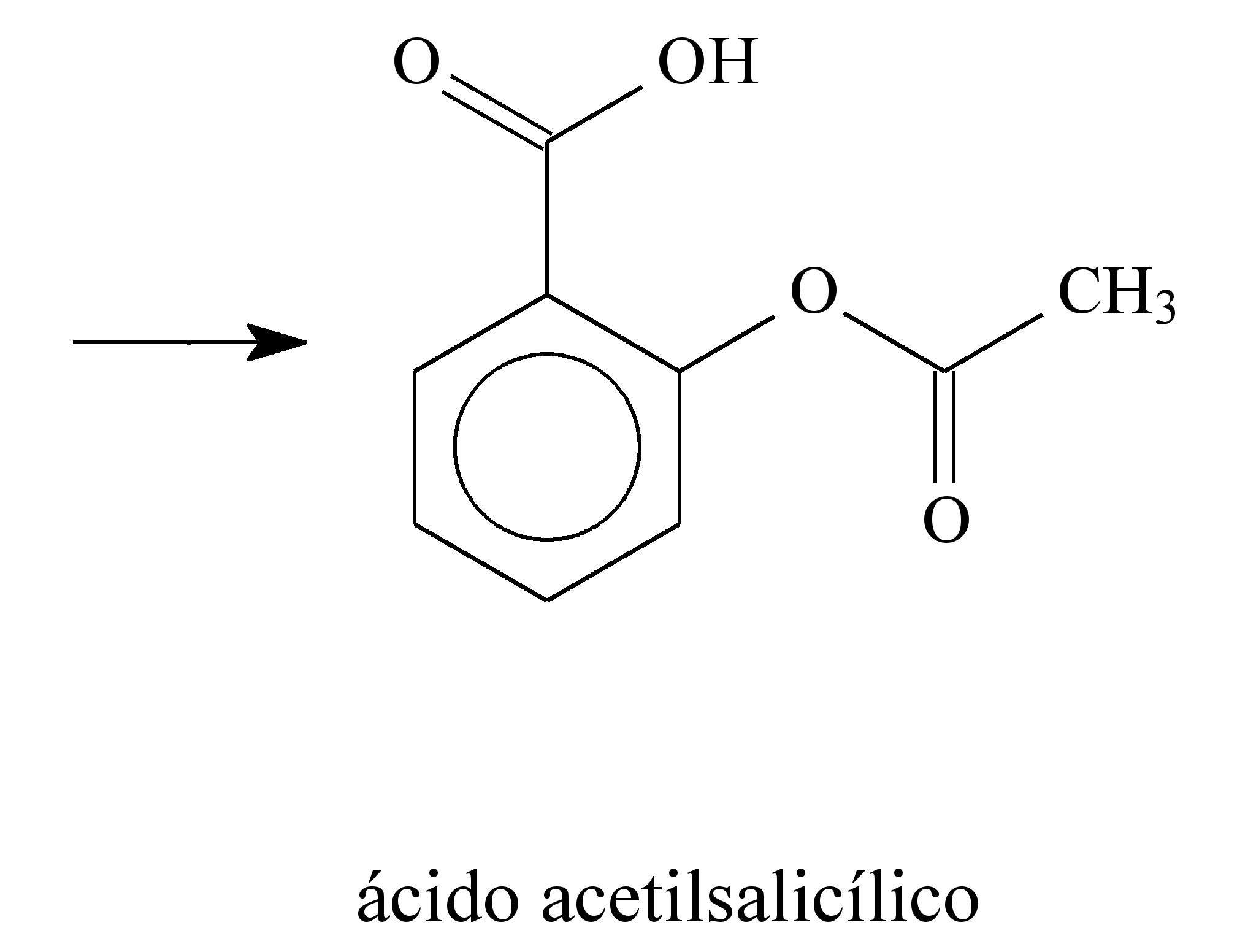
O ácido acetilsalicílico é pouco solúvel em água e, por isso, é comercializado na forma de comprimido. Considere que a massa molar e a solubilidade do ácido acetilsalicílico sejam iguais a 180 g/mol e 0,225 g em 100 mL de água, respectivamente. Desprezando-se a variação de volume decorrente da adição do ácido em água, uma solução aquosa saturada de ácido acetilsalicílico apresenta concentração de ácido dissolvido igual a
a) 1,25 × 10–2 mol/L.
b) 2,25 × 10–2 mol/L.
c) 1,25 g/L.
d) 18,0 g/L.
27 - (Unicastelo SP/2013)
Para economizar água, basta fechar a torneira. Por exemplo, escovar os dentes por cinco minutos com a torneira aberta gasta, em média, 12 litros de água, enquanto que molhar a escova, fechar a torneira e bochechar com um copo d’água, gastam 0,3 L. Considerando que a densidade da água é 1 g.mL–1 e a constante de Avogadro 6,0×1023 mol–1, a economia, em número de moléculas de água, H2O, demonstrada é de, aproximadamente,
a) 1x1026.
b) 2x1026.
c) 4x1026.
d) 8x1026.
e) 1x1027.
28 - (ESCS DF/2011)
Para tentar explicar a presença de clorometano e diclorometano em amostras recolhidas em Marte pela sonda Viking, cientistas aqueceram uma mistura de percloratos com o solo do deserto do Atacama, no Chile, possivelmente similar ao solo marciano. As reações químicas da experiência destruíram os compostos orgânicos do solo, liberando traços de clorometano e diclorometano como os encontrados pela sonda.
Considerando que em uma amostra foram encontradas 6 1015 moléculas de clorometano e 1,2 1017 moléculas de diclorometano, os números de mols aproximados de clorometano e de diclorometano são, respectivamente:
a) 1 x 10–9 e 2 x 10–7;
b) 1 x 10–8 e 2 x 10–7;
c) 1 x 10–6 e 5 x 10–6;
d) 1 x 106 e 2 x 108;
e) 1 x 108 e 5 x 106.
29 - (ACAFE SC/2014)
No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem sobre o ataque com armas químicas na Síria ´´[...] O gás sarin é inodoro e invisível. Além da inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio miligrama. […]”.
Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140g/mol.
a) 1,68x1026 moléculas.
b) 3,00x1023 moléculas.
c) 2,14x1021 moléculas.
d) 2,14x1018 moléculas.
30 - (UFTM MG/2013)
Os “cianokits”, que são utilizados por socorristas em outros países nos casos de envenenamento por cianeto, geralmente contêm 5 g de hidroxocobalamina ( massa molar igual a 1,3 x 103 g/mol ) injetável. Considerando a constante de Avogadro igual a 6 x 1023 mol–1, calcula-se que o número aproximado de moléculas existentes nessa massa de hidroxocobalamina é
a) 2 x 1021.
b) 2 x 1025.
c) 3 x 1025.
d) 3 x 1021.
e) 1 x 1021.

