GABARITO E RESOLUÇÃO COMENTADA
01- RESP: B
Foi dada a reaçãoe o valor de ΔH
C2H4(g) + H2(g) ![]() C2H6(g)
C2H6(g) ![]() = –137 kJ.mol–1
= –137 kJ.mol–1
Dado:
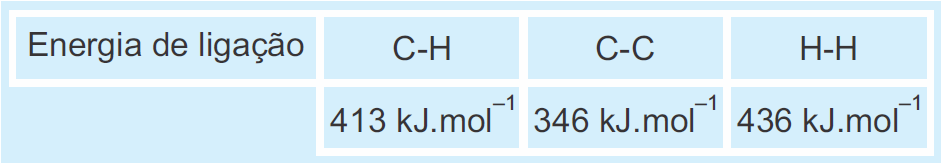
No reagentes temos:
- ligação C – H = 4 , C = C = 1 e H - H = 1
Nos produtos temos:
- ligação C – H = 6 e C - C = 1
RESOLUÇÃO
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
-137 = 4(413) + X + 436 + 6(-413) + (-346) =
-137 = 1652 + X +436 - 2478 -346 =
X = 1652+ 436 – 2478 – 346 + 137
X = - 599 Kj
02- RESP: A
I – MANTER ΔH = - 1368 kJ
II- MANTER ΔH = - - 875 kJ
III-INVERTER ΔH =+ 2231 kJ
ΔH = ΔH1 + ΔH2 + ΔH3 =
ΔH = -1368 + (-875) + 2231
ΔH = - 12 kJ
Obs: detalhes da resolução na questão 17
03- RESP: E
A reação não é elementar, pois foi dado a tabela
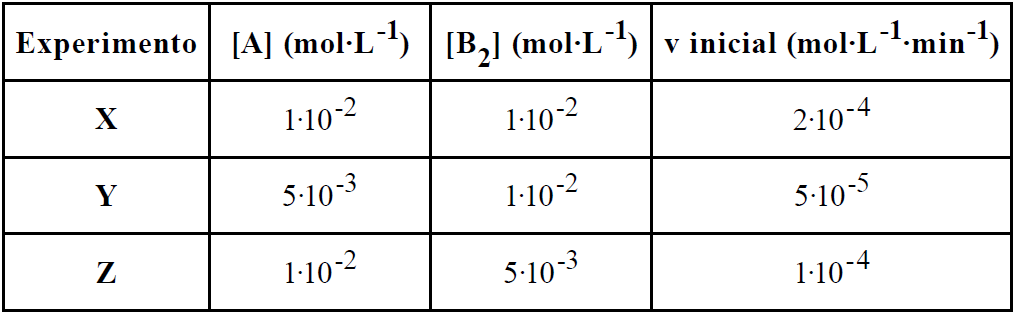
Verificando de y para x
A concentração de A dobra e a velocidade aumenta quatro vezes.
4 = 2a a = 2
Verificando de z para x
A concentração A dobra e a velocidade dobra.
2 = 2b b = 1
OBS: Mais detalhes da resolução na questão 22
04- RESP: A
05- RESP: E
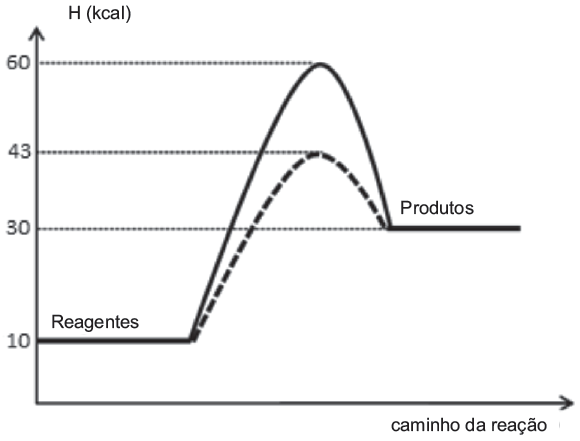
HCA = 60 kcal ( sem catalisador).
HCA = 43 Kj ( com catalisador).
HR = 10 kcal.
HP = 30 kcal
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = 30 – 10 è ΔH = 20 kJ ( ENDOTÉRMICA ).
Ea = HCA - HR è Ea = 60 – 10 è Ea = 50 kcal ( sem catalisador).
Ea = HCA - HR è Ea = 43 – 10 è Ea = 33 kcal ( com catalisador).
Portanto temos uma diminuição de 17 kcal
06- RESP: B
Quanto maior a superfície de contanto, maior será a velocidade da reação.
07- RESP: E
O catalisador acelera uma reação, pois diminui a energia de ativação. O catalisador é regenerado no final da reação.
08- RESP: E
Quanto maior a superfície de contanto, maior será a velocidade da reação.
09- RESOLUÇÃO
10- RESOLUÇÃO

HCA = 60 kcal ( sem catalisador).
HCA = 43 Kj ( com catalisador).
HR = 10 kcal.
HP = 30 kcal
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
a)Ea = HCA - HR → Ea = 43 – 10 → Ea = 33 kcal ( com catalisador).
b)ΔH = 30 – 10 → ΔH = 20 kJ ( ENDOTÉRMICA ).
11- RESOLUÇÃO
A reação não é elementar, pois foi dado a tabela
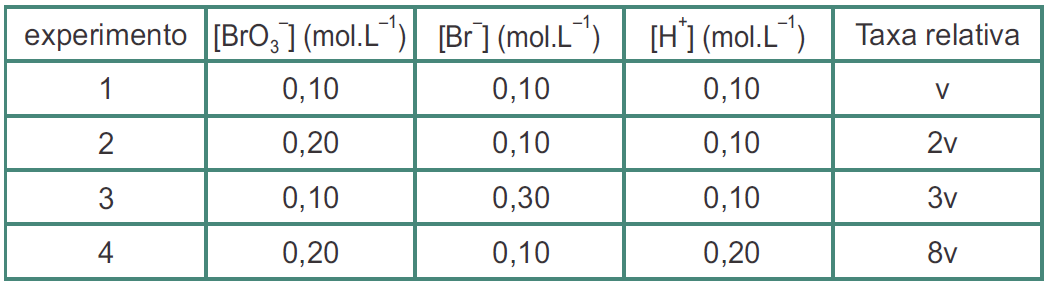
*Taxa relativa = velocidade
Verificando de 1 para 2
A concentração de [BrO3-] dobra e a velocidade dobra tambéma.
2 = 2aa = 1
Verificando de 1 para 3
A concentração de [Br-] triplica e a velocidade também triplica.
3 = 3bb = 1
Verificando de 2 para 4
A concentração de [H+] dobra e a velocidade aumenta quatro vezes
4 = 2zz = 2
Equação da velocidade
V = K.[ BrO3-]1.[ Br-]1.[ H+]2
OBS: Mais detalhes da resolução na questão 22
12- RESOLUÇÃO
Foi dada a reação e os valores de energia de ligação.
N2(g) +3 H2(g) ![]() 2 NH3(g)
2 NH3(g) ![]() = ?
= ?
No reagentes temos:
ligação N Ξ N = 1 , H - H = 3
Nos produtos temos:
ligação N – H = 6
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 944 + 3(436) + 6(-390) =
ΔH = 944 + 1308 -2340 =
ΔH = - 88 kJ
13- RESP: A
A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS. Também foi dada a reação principal, que é a combustão total do metano.
14- RESP: - 75kJ
A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS. Também foi citado que a reação principal, que é a formação do metano.
Equação de formação do metano
15- RESP: A
Equação da velocidade
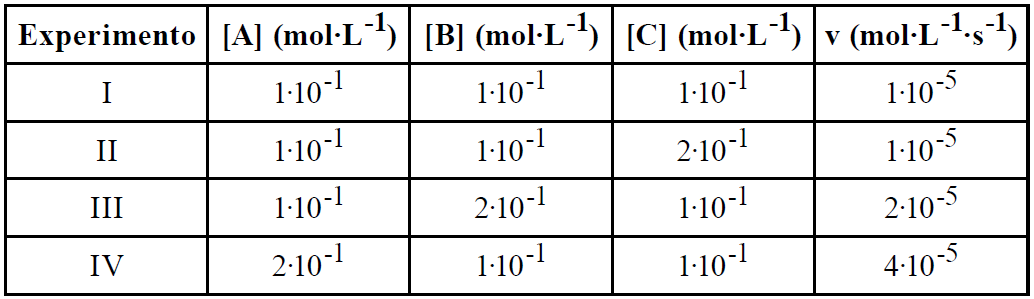
V = K [A]X[B]Y[C]Z
A(g) + B(g) + C(g) ![]() D (g),
D (g),
Em 1 e 2
A concentração da substância C dobra e a velocidade permanece constante.
1 = 2z z = 0
Em 1 e 3
A concentração e a velocidade da substância B dobra.
2 = 2y y = 1
Em 1 e 4
A concentração da substânciaA dobra e a velocidade aumenta 4 vezes.
4 = 2x x = 2
Portanto temos:
16- RESP: E
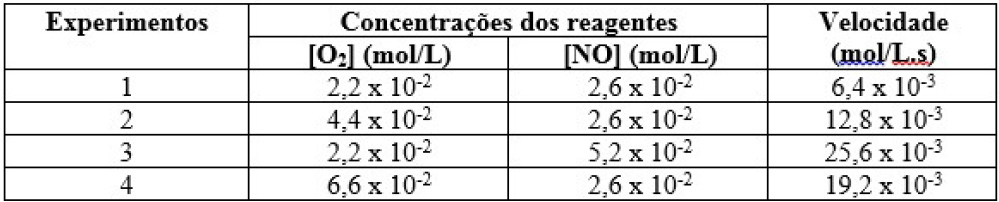
Precisamos determinar os valores de a e b
O2(g) + 2 NO(g) ![]() 2 NO2(g) V = K.[O2]a.[NO]b
2 NO2(g) V = K.[O2]a.[NO]b
Em 1 e 2
A concentração de O2 e a velocidade dobra.
2 = 2a a = 1
Em 1 e 3
A concentração de NO dobra e a velocidade aumenta 4 vezes.
4 = 2b b = 2
Equação da velocidade
V = K.[O2]1.[NO]2
Dica: A ordem é o expoente.
17- RESOLUÇÃO
A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS.
Precisamos montar apenas a reação principal, que de acordo com o texto é de formação do propano.
Lembrando:Na entalpia de formação, sempre vai formar um mol da substância, a partir de suas substâncias simples.
3 C(grafite) + 4 H2(g) → C3H8(g) ΔHº = ?
RESOLUÇÃO
Encontramos o carbono grafite na 2º equação e na mesma posição ( reagente ). Só que na principal temos 3 mols de carbono grafite, isto indica que temos que manter e multiplicar a equação II por três ,incluindo o ΔH.
Encontramos o gás hidrogênio na 3º equação e na mesma posição ( reagente ). Só que na principal temos 4 mols de gás hidrogênio, isto indica que temos que manter e multiplicar a equação III por quatro ,incluindo o ΔH.
Encontramos o gás propano na 1º equação e na posição de reagente e na principal o gás propano é produto. Portanto temos que inverter a reação, incluindo o sinal do ΔH.
18- RESP:D
Dadas as equações termoquímicas com o respectivo valor de ΔH, concluímos que a questão é sobre a LEI DE HESS.
Reação principal:
2 N2 (g ) + 5 O2(g) → 2 N2O5 (g) ΔH = ?
Encontramos o N2 na equação III na posição do reagente. Temos que manter e multiplicar por 4, porque na principal temos 2 mols.
O gás oxigênio aparece em mais que uma reação, portanto não vamos “mexer” com ele.
Encontramos o N2O5 na equação II, só que na posição de reagente. Isso indica que temos que inverter a reação e multiplicar por 2, porque na principal temos 2 mols.
Vamos precisar inverter a reação I , para conseguir “cortar” o H2 e a H2O que não aparecem na reação principal
RESOLUÇÃO:
19- RESP: A
De acordo com os dados, trata-se de energia de ligação, conforme informação do enunciado, temos que balancear a equação.
20 – RESP: C
De acordo com os dados, trata-se de energia de ligação.
Agora vamos abrir a reação para facilitar a visualização das ligações.
21 – RESP: B
De acordo com os dados, trata-se de energia de ligação, conforme informação do enunciado, temos que equacionar a reação de combustão total do butano. A combustão total de hidrocarboneto produz gás carbônico e água
22 – RESOLUÇÃO
A questão é sobre velocidade de reação, onde a mesma pede para determinar a equação da velocidade.
Dica :A equação da velocidade é escrita em função dos reagentes. Quando a reação ocorre em várias etapas (tem uma tabela ou gráfico ), indica que a mesma não é elementar e não temos os expoentes(necessário calcular ). O expoente é a ordem. A ordem da reação será a soma dos expoentes.
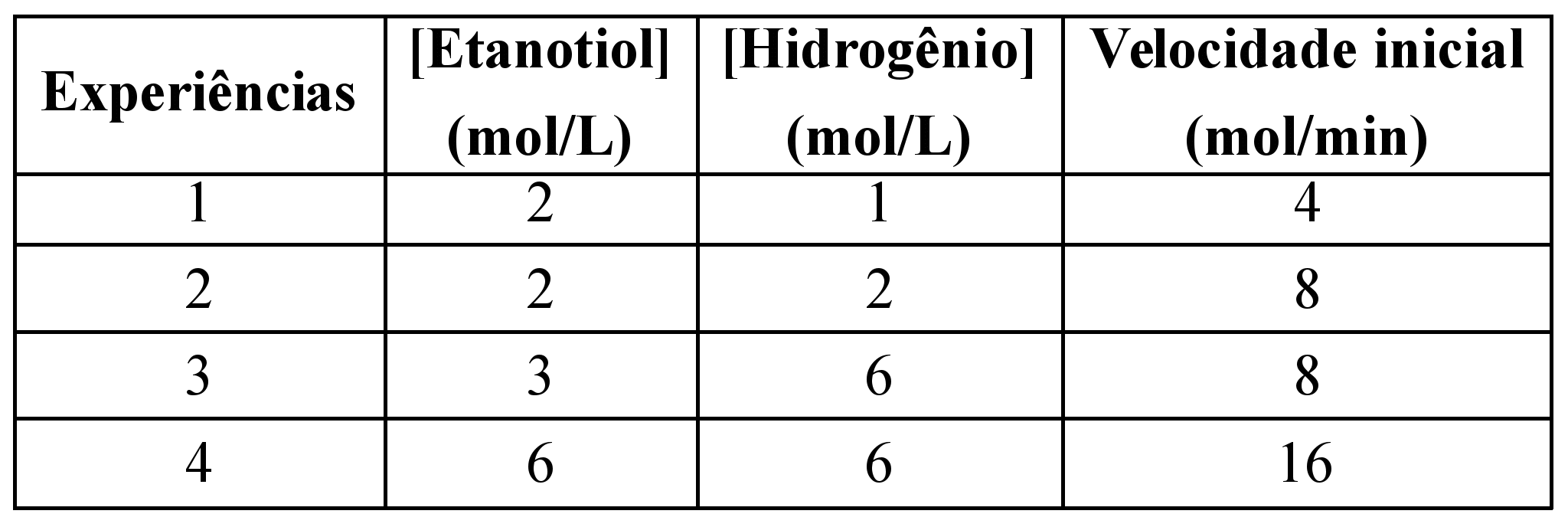
V = k [ etanotiol]x [hidrogênio]y
A reação não é elementar. Temos que encontrar o valor de x e de y que são os expoentes.
Para determinar o y, vamos deixar o x constante. Encontramos esta situação no experimento 1 e 2, onde notamos que a concentração do etanotiol permanece constante e a concentração de hidrogênio dobra, ocorrendo o mesmo com a velocidade
23 – RESP: B
A questão é sobre velocidade de reação, onde a mesma foi dada.
V = k [ A]2 [B]1
A questão (este tipo de questão) não forneceu a concentração molar inicial. Para facilitar os cálculos vamos admitir que a concentração inicial dos reagentes fosse de 1 mol/L ( poderia ser qualquer número. Escolhemos o 1 mol/L para ficar mais fácil de verificar quantas vezes aumentou ou diminuiu ) e calcular a velocidade inicial.
No início temos:
V = k [ 1]2 [1]1è V = 1K
Depois temos:
- concentração de A foi triplicada è [ 3 ].
-concentração de B foi duplicada è [2 ]
V = k [ 3]2 [2]1è V = 18K
O NOVO VALOR DA VELOCIDADE SERÁ 18 VEZES MAIOR.
24 – RESP: C
RESOLUÇÃO
Para determinar o Y, vamos deixar o X constante. Encontramos esta situação no experimento 1 e 3, onde notamos que a concentração do [NO] permanece constante e a concentração de [H2] dobra, e a velocidade aumenta 2 vezes.
V = k [NO]X[H2]Y
25 – RESP: B
Para determinar o Y, vamos deixar o X constante. Encontramos esta situação no experimento 1 e 3, onde notamos que a concentração do [NO] permanece constante e a concentração de [O2] aumenta 4 vezes, e a velocidade também aumenta 4 vezes.
26 – RESP: D
27- RESP: D
28 – RESOLUÇÃO
Através do gráfico temos:
![]()
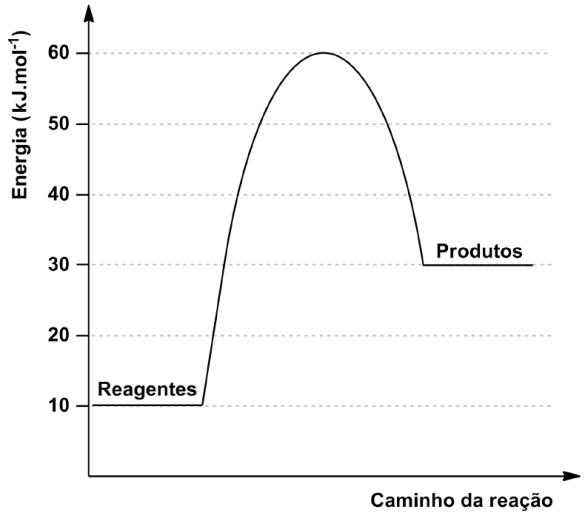
29 – RESOLUÇÃO
Dado o diagrama notamos que:
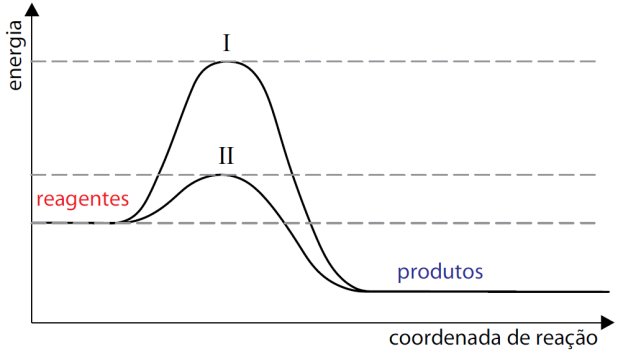
I = HCA sem catalisador
II = HCA com catalisador
HP Entalpia dos produtos
HR Entalpia dos reagentes
A curva II representa a reação na presença de catalisador. Quanto menor a energia de ativaçã ( dada aos reagentes até atingir o complexo ativado), maior a velocidade da reação.
O catalisador não interfere na variação de entalpia, pois a mesma é calculada pela diferença entre a entalpia dos produtos e entalpia dos reagentes, na presença ou não do catalisador.
30 – RESOLUÇÃO
V = K [A]X [ B ]Y [C]Z
V2/V1 X 2 = 2X =1 V3/V1 Y 4 = 2Y = 2 V4/V1 Z 1 = 2Z = 0
PORTANTO : V = K [A]1 [ B ]2
Dica:A velocidade da reação não depende da concentração da substância [C], pois o expoente é igual a zero.
31 – RESOLUÇÃO
seguir.
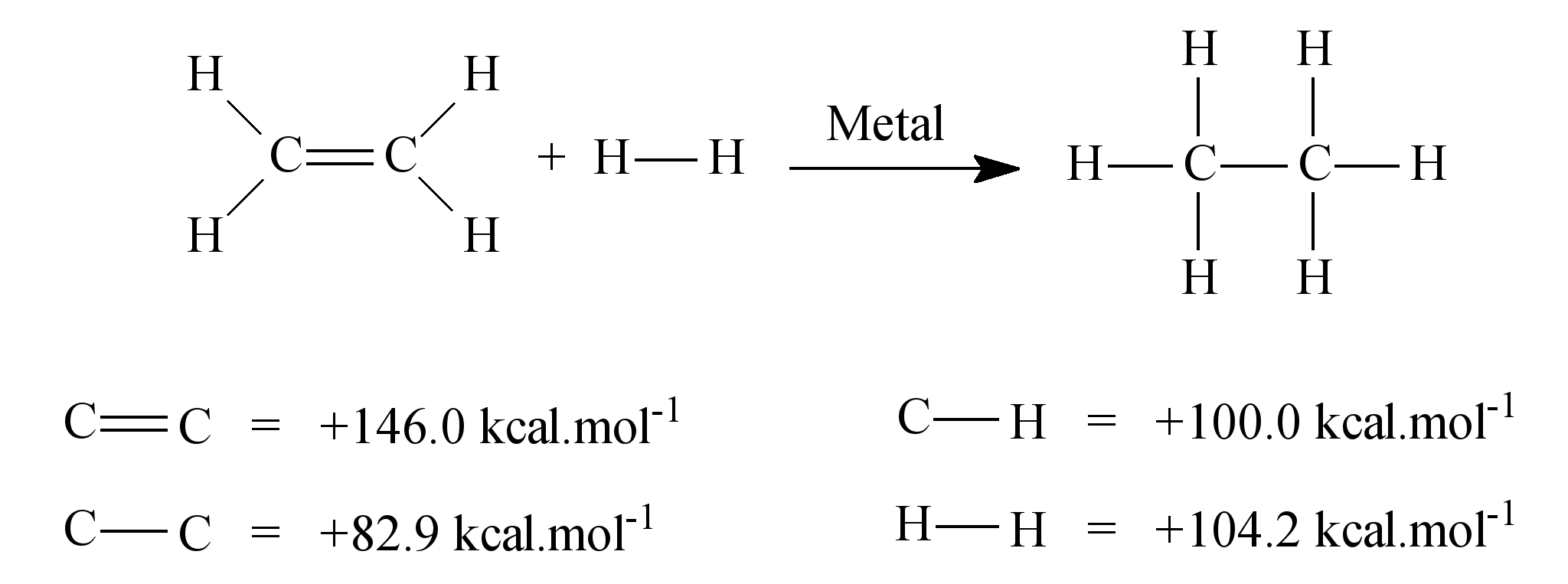
A questão já forneceu as ligações. Portanto temos:
ΔH = 4(100) + 146 + 104,2 + 6(-100) + ( - 82,9 ) =
ΔH = 400 + 146 + 104,2 – 600 – 82,9 = ΔH = - 32,7 kcal
Obs. Dicas no exercício 11
32 – RESOLUÇÃO






















