LISTA TERMOQUÍMICA
01 - (UNICAMP SP/2014)
Explosão e incêndio se combinaram no terminal marítimo de São Francisco do Sul, em Santa Catarina, espalhando muita fumaça pela cidade e pela região. O incidente ocorreu com uma carga de fertilizante em que se estima tenham sido decompostas 10 mil toneladas de nitrato de amônio. A fumaça branca que foi eliminada durante 4 dias era de composição complexa, mas apresentava principalmente os produtos da decomposição térmica do nitrato de amônio: monóxido de dinitrogênio e água. Em abril de 2013, um acidente semelhante ocorreu em West, Estados Unidos da América, envolvendo a mesma substância. Infelizmente, naquele caso, houve uma explosão, ocasionando a morte de muitas pessoas.
a) Com base nessas informações, escreva a equação química da decomposição térmica que ocorreu com o nitrato de amônio.
b) Dado que os valores das energias padrão de formação em kJ mol–1 das substâncias envolvidas são nitrato de amônio (-366), monóxido de dinitrogênio (82) e água (-242), o processo de decomposição ocorrido no incidente é endotérmico ou exotérmico? Justifique sua resposta considerando a decomposição em condições padrão.
02 - (Fac. Direito de Sorocaba SP/2014)
“Polícia espera resultado de perícias sobre a causa da morte de secretária”
(http://zerohora.clicrbs.com.br/rs/)
A frase é o título de uma notícia veiculada na mídia em março de 2013, que denunciava a morte de uma mulher de 35 anos que estava fazendo uma dieta restritiva, em que ingeria, por dia, apenas 500 kcal, além de tomar remédios para emagrecer.
Sabendo que as massas molares do hidrogênio, do carbono e do oxigênio, em g · mol–1, valem, respectivamente, 1, 12 e 16, e considerando que a combustão de 1 mol de glicose, C6H12O6, produz 670 kcal, a massa de glicose, em gramas, que deve ser queimada pelo organismo para produzir a energia ingerida pela mulher citada no texto vale, aproximadamente,
a) 24
b) 135
c) 180
d) 240
e) 360
03 - (UNIUBE MG/2013)
O etanol é um composto orgânico cuja ebulição ocorre a uma temperatura de 78,4 ºC. Pode ser obtido a partir de vários métodos. No Brasil, é produzido através da fermentação da cana-de-açúcar, já que a sua disponibilidade agrícola é bastante ampla no nosso País. A reação química da combustão completa do etanol e o seu valor da entalpia são dados a seguir:
C2H5OH(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) + 327 kcal/mol
Sabendo-se que a entalpia é uma propriedade extensiva, na queima de 115 g desse combustível, a quantidade de calor envolvida na reação é de, aproximadamente:
a)-327 kcal.
b)+817,5 kcal
c)+327 kcal
d)-817,5 kcal
e)-130,8 kcal
04 - (ACAFE SC/2013)
Considere que a reação química abaixo possui um ΔH = -154 kJ/mol.
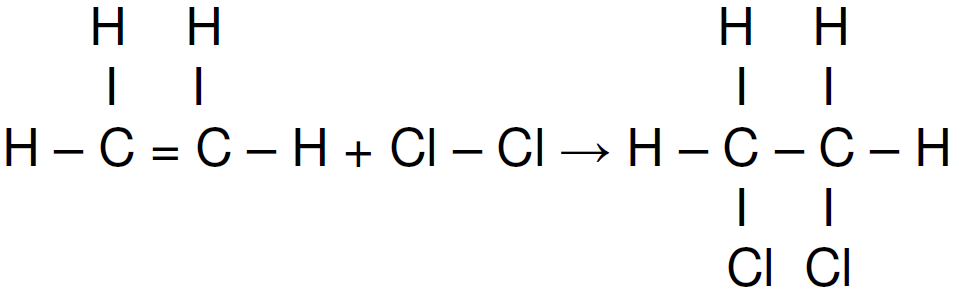
Calcule a energia média em módulo da ligação C = C presente na molécula do etileno e assinale a alternativa correta.
Dados: Para resolução dessa questão considere as seguintes energias de ligação (valores médios): Cl – Cl: 243 kJ/mol, C – C: 347 kJ/mol, C – Cl: 331 kJ/mol.
a) 766 kJ/mol.
b) 265 kj/mol.
c) 694 kj/mol.
d) 612 kJ/mol
05 - (MACK SP/2013)
Observe o gráfico de entalpia abaixo, obtido por meio de experimentos realizados no estado padrão:
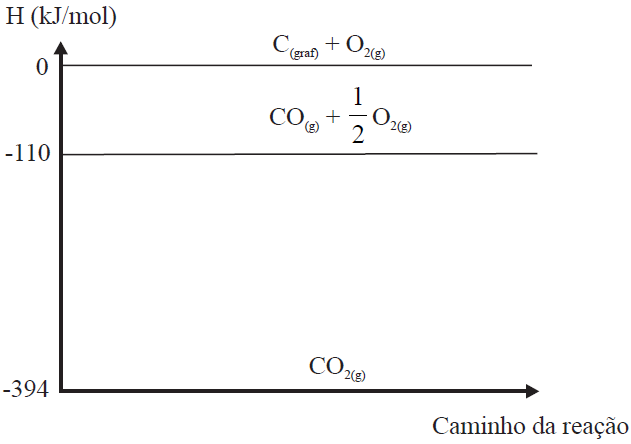
Com base em seus conhecimentos de termoquímica e nas informações do gráfico acima, a equação termoquímica INCORRETAMENTE representada é
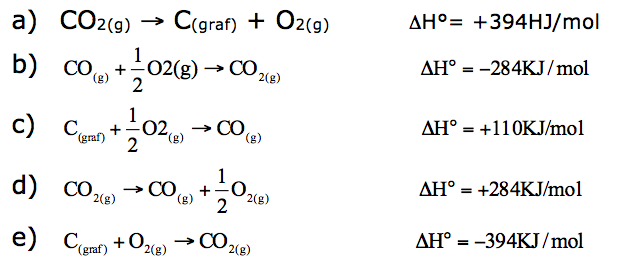
06 - (PUC SP/2013)
O estudo da energia reticular de um retículo cristalino iônico envolve a análise do ciclo de Born-Haber. O diagrama de entalpia a seguir exemplifica o ciclo de Born-Haber do cloreto de potássio (KCl).
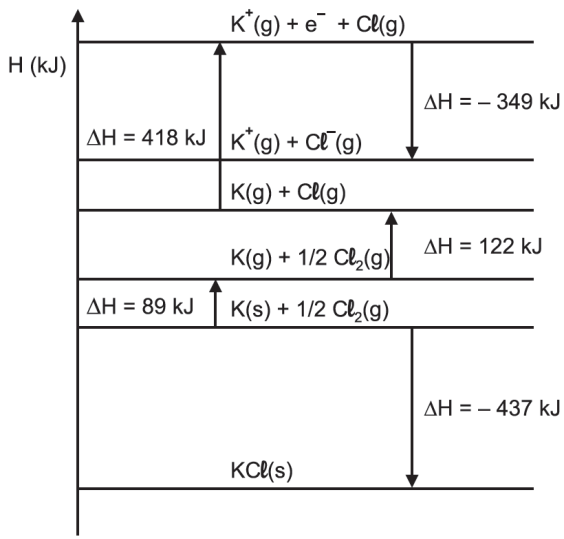
A partir da análise do diagrama é INCORRETO afirmar que
a) a entalpia de sublimação do potássio é de 89 kJ/mol.
b) a entalpia de ligação Cl-Cl é de 244 kJ/mol.
c) a entalpia de formação do KCl(s) é de –717 kJ/mol.
d) o potencial de ionização do K(g) é de 418 kJ/mol.
e) a reação entre o metal potássio e o gás cloro é exotérmica.
07 - (UFG GO/2014)
A variação de entalpia (ΔH) é uma grandeza relacionada à variação de energia que depende apenas dos estados inicial e final de uma reação. Analise as seguintes equações químicas:
I) C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(l) ΔHº = –2.220 kJ
II) C(grafite) + O2(g) → CO2(g) ΔHº = –394 kJ
III) H2(g) + ½ O2(g) → H2O(l) ΔHº = –286 kJ
Ante o exposto, determine a equação global de formação do gás propano e calcule o valor da variação de entalpia do processo.
08 - (MACK SP/2014)
O craqueamento (craking) é a denominação técnica de processos químicos na indústria por meio dos quais moléculas mais complexas são quebradas em moléculas mais simples. O princípio básico desse tipo de processo é o rompimento das ligações carbono-carbono pela adição de calor e/ou catalisador. Um exemplo da aplicação do craqueamento é a transformação do dodecano em dois compostos de menor massa molar, hexano e propeno (propileno), conforme exemplificado, simplificadamente, pela equação química a seguir:
C12H26(l) → C6H14(l) + 2 C3H6(g)
São dadas as equações termoquímicas de combustão completa, no estado-padrão para três hidrocarbonetos:
-
C12H26(l) +
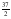 O2(g) → 12 CO2(g) + 13 H2O(l) ΔHºC = –7513,0 kJ/mol
O2(g) → 12 CO2(g) + 13 H2O(l) ΔHºC = –7513,0 kJ/mol -
C6H14(g) +
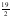 O2(g) → 6 CO2(g) + 7 H2O(l) ΔHºC = –4163,0 kJ/mol
O2(g) → 6 CO2(g) + 7 H2O(l) ΔHºC = –4163,0 kJ/mol -
C3H6(g) +
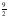 O2(g) → 3 CO2(g) + 3 H2O(l) ΔHºC = –2220,0 kJ/mol
O2(g) → 3 CO2(g) + 3 H2O(l) ΔHºC = –2220,0 kJ/mol
Utilizando a Lei de Hess, pode-se afirmar que o valor da variação de entalpia-padrão para o craqueamento do dodecano em hexano e propeno, será
a)–13896,0kJ/mol. b)–1130,0kJ/mol. c)+1090,0kJ/mol. d)+1130,0kJ/mol. e)+13896,0 kJ/mol.
09 - (UERJ/2013)
A equação química abaixo representa a reação da produção industrial de gás hidrogênio.
H2O (g) + C (s) → CO (g) + H2 (g)
Na determinação da variação de entalpia dessa reação química, são consideradas as seguintes equações termoquímicas, a 25 °C e 1 atm:
-
H2 (g) +
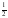 O2 (g) → H2O (g) ΔHº = –242,0 kJ
O2 (g) → H2O (g) ΔHº = –242,0 kJ -
C (s) + O2 (g) → CO2 (g) ΔHº = –393,5 kJ
-
O2 (g) + 2 CO (g) → 2 CO2 (g) ΔHº = –477,0 kJ
Calcule a energia, em quilojoules, necessária para a produção de 1 kg de gás hidrogênio e nomeie o agente redutor desse processo industrial.
10 - (FGV SP/2014)
Deverá entrar em funcionamento em 2017, em Iperó, no interior de São Paulo, o Reator Multipropósito Brasileiro (RMB), que será destinado à produção de radioisótopos para radiofármacos e também para produção de fontes radioativas usadas pelo Brasil em larga escala nas áreas industrial e de pesquisas. Um exemplo da aplicação tecnológica de radioisótopos são sensores contendo fonte de amerício-241, obtido como produto de fissão. Ele decai para o radioisótopo neptúnio-237 e emite um feixe de radiação. Fontes de amerício-241 são usadas como indicadores de nível em tanques e fornos mesmo em ambiente de intenso calor, como ocorre no interior dos alto fornos da Companhia Siderúrgica Paulista (COSIPA).
A produção de combustível para os reatores nucleares de fissão envolve o processo de transformação do composto sólido UO2 ao composto gasoso UF6 por meio das etapas:
I. UO2 (s) + 4 HF (g) → UF4 (s) + 2 H2O (g)
II. UF4 (s) + F2 (g) → UF6 (g)
Considere os dados da tabela:
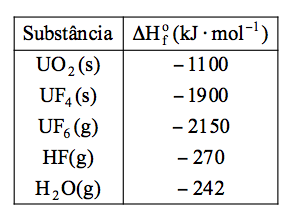
O valor da entalpia padrão da reação global de produção de 1 mol de UF6 por meio das etapas I e II, dada em kJ*mol–1, é igual a
a) – 454.
b) – 764.
c) – 1 264.
d) + 454
e) + 1264
11 - (UNESP SP/2014)
Insumo essencial na indústria de tintas, o dióxido de titânio sólido puro (TiO2) pode ser obtido a partir de minérios com teor aproximado de 70% em TiO2 que, após moagem, é submetido à seguinte sequência de etapas:
I. aquecimento com carvão sólido
TiO2 (s) + C (s) → Ti (s) + CO2 (g) ΔHreação = +550 kJ * mol–1
II. reação do titânio metálico com cloro molecular gasoso
Ti (s) + 2 Cl2 (s) → TiCl4 (l) ΔHreação = –804 kJ * mol–1
III. reação do cloreto de titânio líquido com oxigênio molecular gasoso
TiCl4 (l) + O2 (g ) → TiO2 (s) + 2 Cl2 (g ) ΔHreação = –140 kJ * mol–1
Considerando as etapas I e II do processo, é correto afirmar que a reação para produção de 1 mol de TiCl4 (l) a partir de TiO2 (s) é
a) exotérmica, ocorrendo liberação de 1 354 kJ.
b) exotérmica, ocorrendo liberação de 254 kJ.
c) endotérmica, ocorrendo absorção de 254 kJ.
d) endotérmica, ocorrendo absorção de 1 354 kJ.
e) exotérmica, ocorrendo liberação de 804 kJ.

