GABARITO E RESOLUÇÃO COMENTADA TERMOQUÍMICA
1-RESOLUÇÃO
A questão fala sobre a decomposição térmica ( aquecimento) do nitrato de amônio ( NH4NO3) que decompõe em monóxido de dinitrogênio e
ΔH = HP - HR
ΔH = - 402 – (-366)
ΔH = - 36 Kj
ΔH <0 - exotérmica
2- RESP: B
A questão indica que na combustão de 1 mol de glicose (180 g.mol-1 ) libera 670 kcal. Para determinar a massa em 500 kcal temos:
C6H12O6 + 6 O2 6 CO2 + 6 H20
180 g -------------- 670 kcal
X -------------- 500 kcal
X = 134,32 gramas
3- RESP: D
C2H5OH + 3 O2 2 CO2 + 3 H2O + 327 kcal
46 g C2H5OH ------------- 327 kcal liberados
115 g C2H5OH ----------- x
X = - 817, 5 kcal C2H5OH
Obs: massa molar do C2H5OH é igual a 46 g.mol-1
DICA: a combustão sempre libera calor. O valor de entalpia nos produtos, indica a liberação de energia.
4- RESP: D
Verificando os dados, notamos que temos a energia para cada mol de ligação, indicando que a questão deve ser resolvida utilizando a somatória das entalpias.
A partir do enunciado temos o valor de ΔH= - 154 Kj.
A questão pede para calcular o valor da ligação C = C.
DICA: Os reagentes possuem entalpia positiva(quebra ligações) e os produtos possuem sinal negativo (ligações formadas).
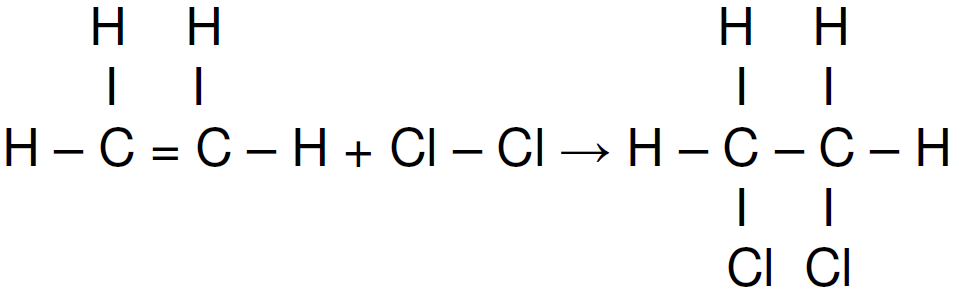
ΔH = H1 + H2 + H3 + H4 + .....
- 154 = X + 243 + (-347 ) + 2(-331) =
- 154 = X + 243 – 347 – 662
- X = 243 – 347 – 662 + 154
- X = -612 X = 612 Kj/mol
5- RESP: C
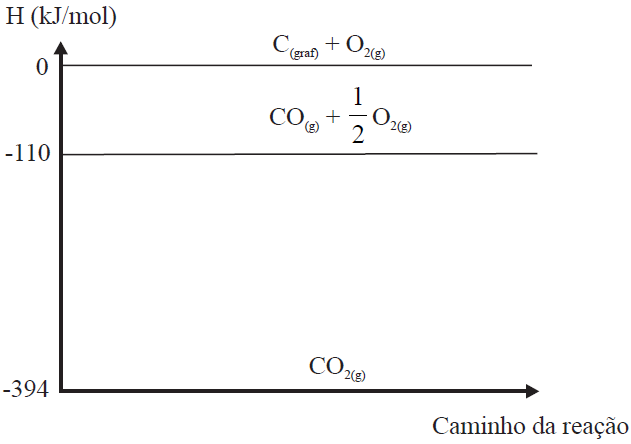
De acordo com o gráfico dado temos:
. Alternativa a é correta, pois a entalpia das substâncias simples C(graf) e O2 é igual à zero, indicando que a entalpia do CO2 é igual a + 394 kJ/mol, pois
ΔH = HP - HR
ΔH = 0 – ( -394 )
ΔH = 0 + 394
ΔH = + 394 kJ
. Alternativa b é correta ΔH = HP - HR
ΔH = - 394 – ( - 110 )
ΔH = - 284 kJ
![]()
. Alternativa c é incorreta, pois se trata de uma reação de combustão, e o ΔH tem que ser negativo e a alternativa indica sinal positivo
![]()
. Alternativa d é correta
ΔH = HP - HR
ΔH = - 110 – ( - 394 )
ΔH = + 284 kJ

. Alternativa e é correta, pois a entalpia das substâncias simples C(graf) e O2 é igual à zero, indicando que a entalpia do CO2 é igual a - 394 kJ/mol, pois
ΔH = HP - HR
ΔH = - 394 – 0
ΔH = -394 kJ
![]()
6- RESP: C
Analisando o diagrama dado, podemos afirmar que:
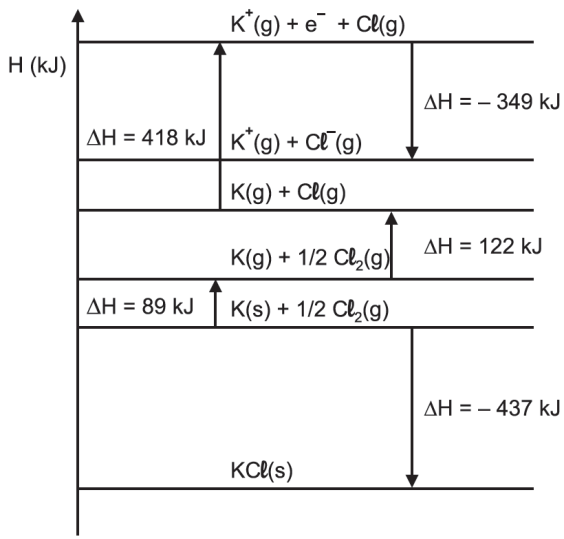
A entalpia de sublimação ( passagem do sólido para o gasoso) é igual a 89 Kj.
A entalpia de ligação Cl – Cl = 244 kJ/mol 9 o valor dado ( 122 Kj) é para 0,5 mol.
O potencial de ionização do potássio no estado gasoso é igual a 418 kJ.
Ao reagir o potássio e o gás cloro, libera 437 kJ, indicando que a reação é exotérmica.
A entalpia de formação do KCl(s) é de – 437 Kj e não -717 Kj como afirma a alternativa, deixando a alternativa C incorreta.
7- RESOLUÇÃO
1- A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS.
Precisamos montar apenas a reação principal, que de acordo com o texto é de formação do propano.
Lembrando: Na entalpia de formação, sempre vai formar um mol da substância, a partir de suas substâncias simples.
3 C(grafite) + 4 H2(g) → C3H8(g) ΔHº = ?
Encontramos o carbono grafite na 2º equação e na mesma posição ( reagente ). Só que na principal temos 3 mols de carbono grafite, isto indica que temos que manter e multiplicar a equação II por três ,incluindo o ΔH.
Encontramos o gás hidrogênio na 3º equação e na mesma posição ( reagente ). Só que na principal temos 4 mols de gás hidrogênio, isto indica que temos que manter e multiplicar a equação III por quatro ,incluindo o ΔH.
Encontramos o gás propano na 1º equação e na posição de reagente e na principal o gás propano é produto. Portanto temos que inverter a reação, incluindo o sinal do ΔH.
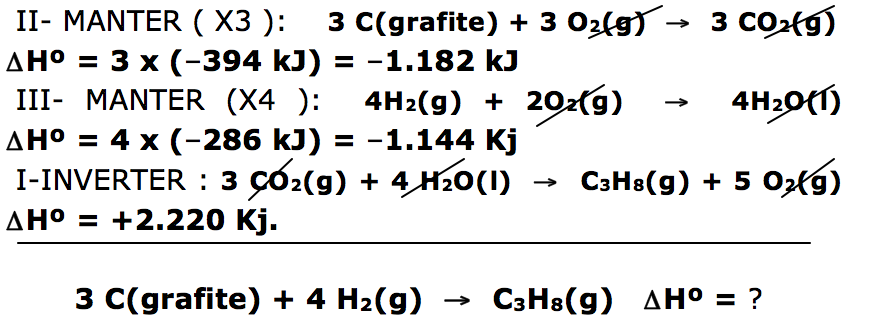
Após cortar as substâncias que entra reagente e sai produto é só somar os respectivos valores de ΔH, vamos encontrar a resposta da questão:
ΔH = ΔH1 + ΔH2 + ΔH3 ΔH = - 1182 + ( - 1144 ) + 2220
ΔHº = –106 kJ
8- RESP: C
Reação principal: C12H26(l) → C6H14(l) + 2 C3H6(g)Hº =?
São dadas as equações termoquímicas de combustão completa, no estado-padrão para três hidrocarbonetos.
Temos que:

ΔHº = +1090 Kj
9- RESOLUÇÃO
Dada à reação principal:H2O (g) + C (s) → CO (g) + H2 (g) ΔHº =?
Na determinação da variação de entalpia dessa reação química, são consideradas as seguintes equações termoquímicas, a 25 °C e 1 atm.
Para calcular a energia, em quilojoules, necessária para a produção de 1 kg ( 1000 g ) de gás hidrogênio ,primeiro vamos determinar o ΔH para a produção do gás hidrogênio.
Agora vamos verificar a posição nas reações dadas de cada uma das substâncias da reação principal
Obs: Quando invertemos a primeira reação, o H2 já vai para os produtos, ficando de acordo com a reação principal.
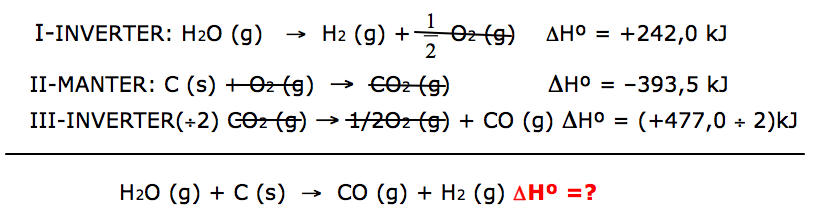
ΔH = ΔH1 + ΔH2 + ΔH3 .
ΔH = 242 + (- 393,5) + 238,5
ΔH = + 87 Kj/mol de H2
1 mol de H2 = 2 g.mol-1
PORTANTO
2g H2 ---------------- 87 Kj
1000 g H2 ----------- X
X = 43500 Kj
Para determinar o agente redutor, vamos lembrar que:
Oxidação --- perda de elétrons --- aumento algébrico --- agente redutor.
Redução --- recebe elétrons --- diminuição algébrico --- agente oxidante
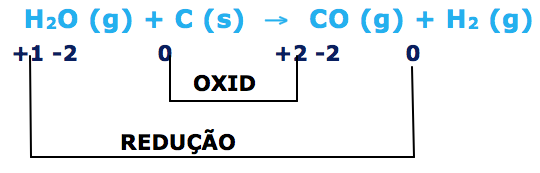
O agente redutor é o carbono
10- RESP: A
A questão fornece a sequencia de reações para a obtenção do UF6.
Primeiro vamos determinar a reação global e calcular o ΔH, pois é dado o valor de entalpia para cada mol de substância.
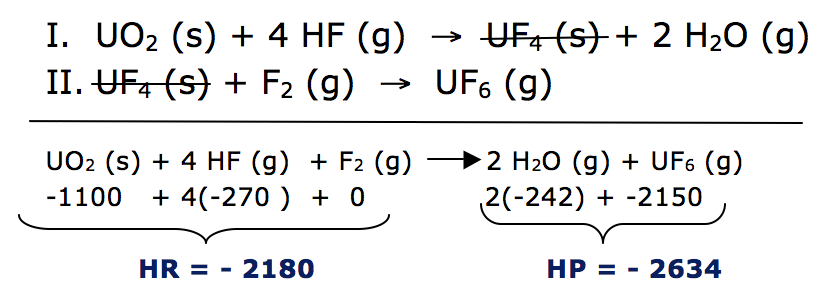
ΔH = HP - HR
ΔH = - 2634 – ( -2180)
ΔH = - 454 Kj
11- RESP: B
I. aquecimento com carvão sólido
TiO2 (s) + C (s) → Ti (s) + CO2 (g ) ΔHreação = +550 kJ * mol–1
II. reação do titânio metálico com cloro molecular gasoso
Ti (s) + 2 Cl2 (s) → TiCl4 (l) ΔHreação = –804 kJ * mol–1
Considerando apenas as etapas I e II do processo, conforme a indicação do texto, vamos calcular a variação de entalpia(ΔH) para produção de 1 mol de TiCl4 (l) a partir de TiO2 (s) .
I. aquecimento com carvão sólido
II. reação do titânio metálico com cloro molecular gasoso
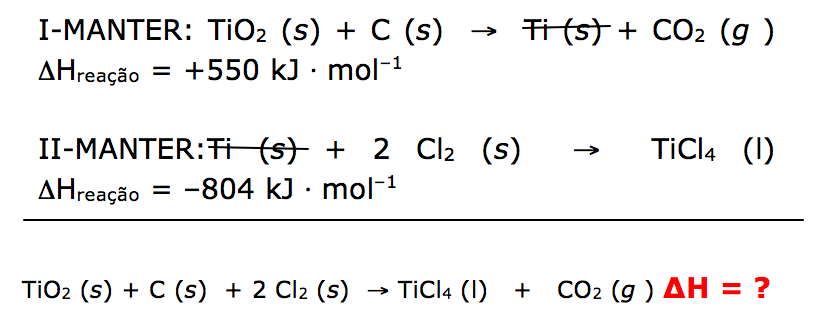
ΔH = ΔH1 + ΔH2
ΔH = 550 + (- 804 )
ΔH = - 254 Kj/mol de H2

