Lista de exercícios–Química – prof. Raimundo. 2º. Trimestre - 2º. Ens. Médio 2016
- Termoquímica.
- Mistura de soluções com reação.
- Diluição de Soluções.
- Relação entre as Concentrações.
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
01 - (UNIFOR CE/2016)
O sabor azedo característico do vinagre deve-se à presença do ácido acético, CH3COOH, um ácido fraco, produzido principalmente pela fermentação do vinho. Para quantificar a presença deste ácido, 10,0 mL de uma amostra de vinagre foi neutralizados com 25,0 mL de uma solução de NaOH 0,1 mol/L. A concentração do ácido acético no vinagre, em gramas por litro, será aproximadamente igual a quanto?
02 - (UDESC SC/2015)
Considere a determinação da capacidade antiácida de um medicamento cujo princípio ativo é carbonato de sódio, que pode ser feita pela reação com ácido clorídrico. Um comprimido de 1,8656 g foi triturado e dissolvido em água, necessitando de 22,00 mL de HCl 0,4000 mol L–1 para ser completamente neutralizado.Qual a porcentagem em massa de carbonato de sódio no comprimido?
03 - (UECE/2015)
O brometo de hidrogênio é um gás tóxico, causador de queimaduras, pneumonia química e edema pulmonar, mas é matéria prima para a fabricação de outros brometos de larga aplicação na indústria farmacêutica. Ele é obtido industrialmente através de uma reação de brometo de sódio com ácido fosfórico. Se em uma reação forem utilizados 1750 g de ácido, cujo grau de pureza é 30% e a massa específica é 1,20 g/ml, qual o volume em litros de ácido fosfórico a ser empregado ?
04 - (FMABC SP/2016)
O ânion permanganato é um excelente oxidante em meio de ácido sulfúrico. Esse ânion apresenta coloração violeta que pode ser descolorida com adição de uma solução de peróxido de hidrogênio em meio ácido. As espécies envolvidas no processo estão representadas na equação não balanceada.
MnO4– (aq) + H+ (aq) + H2O2(aq) ![]() Mn2+ (aq) + O2(g) + H2O(l)
Mn2+ (aq) + O2(g) + H2O(l)
Para descolorir completamente 20 mL de uma solução 0,10 mol.L–1 de permanganato são necessários exatamente
a) 10 mL de uma solução aquosa 0,20 mol.L–1 de H2O2.
b) 20 mL de uma solução aquosa 0,20 mol.L–1 de H2O2.
c) 25 mL de uma solução aquosa 0,20 mol.L–1 de H2O2.
d) 50 mL de uma solução aquosa 0,20 mol.L–1 de H2O2.
05 - (Fac. Direito de Sorocaba SP/2016)
Uma solução de ácido acético encontra-se sem titulação. Sabe-se que para a neutralização total de 150 mL dessa solução são necessários 100 mL de NaOH (1mol/L).
Segue a equação da reação de neutralização.
CH3COOH + NaOH ![]() Na+ + CH3COO– + H2O
Na+ + CH3COO– + H2O
Qual a concentração em g.L-1 para essa solução de ácido acético ?
06 - (PUC SP/2016)
Após determinado processo industrial, obtém-se uma mistura contendo sulfato de sódio (Na2SO4) e carbonato de sódio (Na2CO3). Uma amostra contendo 10,0 g dessa mistura foi completamente neutralizada com 100 mL de uma solução 1,00 mol.L–1 de HCl.
O sulfato de sódio não reage com ácido clorídrico e o carbonato de sódio reage segundo a reação representada a seguir.
Na2CO3(s) + 2 HCl(aq) ![]() 2 NaCl(aq) + CO2(g) + H2O(l)
2 NaCl(aq) + CO2(g) + H2O(l)
O teor(%) de pureza do carbonato de sódio na mistura é de
a) 44%.
b) 53%.
c) 70%.
d) 90%.
07 - (UEMG/2015)
Um desodorante vendido comercialmente nas farmácias traz a seguinte descrição do produto:
“Lysoform Primo Plus - desodorante corporal que previne e reduz os maus odores, deixando uma agradável sensação de limpeza e frescor. Insubstituível na higiene diária, garante o bem-estar e a tranquilidade para o convívio social.
Finalidade: Desodorizar e higienizar o corpo.
Modo de Usar: Usar uma solução contendo 8 tampas (32 mL) de Lysoform Primo Plus para cada 1 litro de água.”
Seguindo as orientações do fabricante, uma pessoa que preparar uma solução do produto com 250mL de água terá que adicionar quantas tampas da solução de Lysoform?
a) 1
b) 2
c) 3
d) 4
08 - (UDESC SC/2014)
Assinale a alternativa que corresponde ao volume de solução aquosa de sulfato de sódio, a 0,35 mol/L, que deve ser diluída por adição de água, para se obter um volume de 650 mL de solução a 0,21 mol/L.
a) 500 mL
b) 136 mL
c) 227 mL
d) 600 mL
e) 390 mL
09 - (IFGO/2016)
O trifluormetano, CHF3, é produzido pela fluoração do gás metano, de acordo com a equação abaixo não balanceada.
CH4(g) + F2(g) ![]() CHF3(g) + HF(g).
CHF3(g) + HF(g).
Dados:
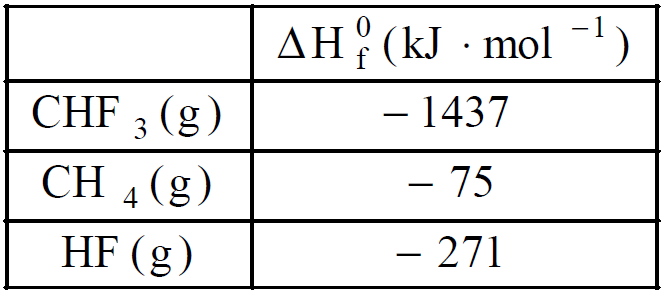
A entalpia-padrão da reação de fluoração do gás metano, em kJ.mol–1, é igual a
a) + 1633
b) + 2175
c) – 1633
d) – 2175
e) – 2325
10 - (UNESP SP/2015)
Chama-se titulação a operação de laboratório realizada com a finalidade de determinar a concentração de uma substância em determinada solução, por meio do uso de outra solução de concentração conhecida. Para tanto, adiciona-se uma solução-padrão, gota a gota, a uma solução-problema (solução contendo uma substância a ser analisada) até o término da reação, evidenciada, por exemplo, com uma substância indicadora. Uma estudante realizou uma titulação ácido-base típica, titulando 25,0 mL de uma solução aquosa de hidróxido de cálcio e gastando 20,0 mL de uma solução padrão de ácido nítrico de concentração igual a 0,10 mol · L–1.
Utilizando os dados do texto,calcule a concentração da solução de Ca(OH)2.
11 – (Unioeste PR/2014)
Atualmente, encontra-se no mercado álcool(C2H5OH) grau 46º INPM. Esta medida baseia-se na porcentagem, em massa, de álcool (46%) presente na mistura. Para a mesma, pode-se afirmar que a concentração de álcool, em mol.L–1, é igual a quanto? Para efeito de cálculos, considere a densidade da solução acima igual a 1,0 g/mL.
12 – (UNICAMP SP/2014)
Explosão e incêndio se combinaram no terminal marítimo de São Francisco do Sul, em Santa Catarina, espalhando muita fumaça pela cidade e pela região. O incidente ocorreu com uma carga de fertilizante em que se estima tenham sido decompostas 10 mil toneladas de nitrato de amônio(NH4NO3). A fumaça branca que foi eliminada durante 4 dias era de composição complexa, mas apresentava principalmente os produtos da decomposição térmica do nitrato de amônio: monóxido de dinitrogênio(N2O) e água. Em abril de 2013, um acidente semelhante ocorreu em West, Estados Unidos da América, envolvendo a mesma substância. Infelizmente, naquele caso, houve uma explosão, ocasionando a morte de muitas pessoas.
Dado que os valores das energias padrão de formação em kJ mol–1 das substâncias envolvidas são nitrato de amônio (-366), monóxido de dinitrogênio (82) e água (-242), o processo de decomposição ocorrido no incidente possui variação de entalpia (ΔH) igual a quanto?
13 –(PUC RJ/2014)
Neutraliza-se 50 mL de solução aquosa de hidróxido de sódio 0,10 mol L–1 com 50 mL de solução aquosa de ácido sulfúrico. Nessa reação, há formação de sal e água.
Admitindo como desprezível a expansão de volume como resultado dessa reação, calcule a concentração em mol.L-1 do ácido utilizado nesta titulação.
14 - (Unievangélica GO/2015)
Leia o rótulo de determinado soro fisiológico no destaque.
De acordo com as especificações do rótulo e considerando condições ambientes, calcule a concentração comum desta solução.
15 - (UDESC SC/2014)
A preparação de soluções diluídas a partir de uma solução de maior concentração é um procedimento extremamente utilizado não só por químicos, mas por qualquer profissional que necessita de trabalho com soluções. O ácido fosfórico é bastante utilizado na indústria alimentícia, como acidulante; na indústria de fertilizantes, como fonte de fósforo, na formulação de detergentes; na diminuição da dureza cálcica na água usada em indústrias têxteis, entre outros. Assinale a alternativa que representa a concentração final de ácido fosfórico, em mol L–1, na solução preparada a partir da diluição de 67,8 mL de uma solução estoque de ácido fosfórico, cuja porcentagem em massa é de 85,5 e a densidade da solução é de 1,69 g cm–3, em um volume final de 250,0 mL.
a) 392
b)4,68
c)4,00
d)3,42
e)2,37
16 - (Unimontes MG/2013)
A densidade é uma propriedade física muito utilizada na caracterização das substâncias, principalmente nas misturas. Nesse caso, a densidade depende da proporção dos constituintes da mistura. Sabe-se que a densidade de uma solução de KCl em água, 5,00% em massa, é 1,053 g/mL. A partir desses dados, podemos afirmar que a concentração mol/L do KCl nessa solução é de, aproximadamente: Dados: M(KCl) = 74,55 g/mol.
a)0,503
b)0,706
c)1,423
d)1,053
e)5,053
17 - (UFTM MG/2013)
Uma solução aquosa de carbonato de sódio, concentração 1,27 molL–1 e densidade 1,124 kgL–1, pode ser empregada como alcalinizante em estações de tratamento de água (ETAs). Dada à massa molar do Na2CO3 = 106 g·mol–1, o valor aproximado do teor percentual em massa de Na2CO3 dessa solução é
a)10.
b)16.
c)14.
d)8.
e)12.
18 –(Unimontes MG/2013)
A densidade é uma propriedade física muito utilizada na caracterização das substâncias, principalmente nas misturas. Nesse caso, a densidade depende da proporção dos constituintes da mistura. Sabe-se que a densidade de uma solução de KCl em água, 5,00 % em massa, é 1,043 g/mL. A partir desses dados, calcule a concentração em mol/L do KCl nessa solução . K = 39 Cl = 35,5
19 – (MACK SP/2014)
Na neutralização de 30 mL de uma solução de soda cáustica (hidróxido de sódio comercial), foram gastos 20 mL de uma solução 0,5 mol/L de ácido sulfúrico, até a mudança de coloração de um indicador ácido-base adequado para a faixa de pH do ponto de viragem desse processo. Determine a concentração em mol/L da soda cáustica.
20 – (UNIFOR CE/2013)
Gás natural veicular (GNV) é um combustível disponibilizado na forma gasosa, a cada dia mais utilizado em automóveis como alternativa à gasolina e ao álcool. O GNV diferencia-se do gás liquefeito de petróleo (GLP) por ser constituído por hidrocarbonetos na faixa do metano e do etano, enquanto o GLP possui em sua formação hidrocarbonetos na faixa do propano e do butano.
Usando os dados fornecidos, e sabendo que é um tanque típico de GNV ( formado exclusivamente por metano ( CH4 )), calcule a variação de entalpia (ΔH ) produzido na queima total de um tanque de GNV (CH4) ? Dados: CH4 = - 75 kJ/mol , CO2 = - 394 kJ/mol , H2O = - 286 Kj/mol
21 - (Mackenzie SP/2014)
Na neutralização de 30 mL de uma solução de soda cáustica (hidróxido de sódio comercial), foram gastos 20 mL de uma solução 0,5 mol/L de ácido sulfúrico, até a mudança de coloração de um indicador ácido-base adequado para a faixa de pH do ponto de viragem desse processo. Desse modo, é correto afirmar que as concentrações molares da amostra de soda cáustica e do sal formado nessa reação de neutralização são, respectivamente,
a) 0,01 mol/L e 0,20 mol/L.
b) 0,01 mol/L e 0,02 mol/L.
c) 0,02 mol/L e 0,02 mol/L.
d) 0,66 mol/L e 0,20 mol/L.
e) 0,66 mol/L e 0,02 mol/L.
22 – (UNESP SP/2013)
Alguns cheiros nos provocam fascínio e atração. Outros trazem recordações agradáveis, até mesmo de momentos da infância. Aromas podem causar sensação de bem-estar ou dar a impressão de que alguém está mais atraente. Os perfumes têm sua composição aromática distribuída em um modelo conhecido como pirâmide olfativa, dividida horizontalmente em três partes e caracterizada pelo termo nota. As notas de saída, constituídas por substâncias bem voláteis, dão a primeira impressão do perfume. As de coração demoram um pouco mais para serem sentidas. São as notas de fundo que permanecem mais tempo na pele.
A professora Andréa, resolveu desenvolver um perfume, para relembrar os momentos agradáveis de sua infância , e resolveu incluir entre os componentes um aroma de frutas com concentração máxima de 1 x 10–4 mol/L. Ela dispõe de um frasco da substância aromatizante, em solução hidroalcoólica, com concentração de 0,01 mol/L. Para a preparação de uma amostra de 0,50 L do novo perfume, contendo o aroma de frutas na concentração desejada, qual o volume em mL da solução hidroalcoólica que a pro Andréa deverá utilizar ?
Obs: Qual será a fruta que ela utilizou? rsrsrsrs
23 - (Unicastelo SP/2014)
No laboratório de um hospital, uma amostra de 10,0 mL de suco gástrico, obtida 8 horas após um paciente ter ingerido caldo de legumes, foi titulada com NaOH 0,1 mol/L, consumindo 7,2 mL da solução básica até a completa neutralização, que ocorre segundo a equação
HCl(aq) + NaCl(aq) → NaCl(aq) + H2O(l)
Afirma-se que a concentração de ácido, em mol/L, na amostra de suco gástrico analisada é de
a)0,1.
b)0,36.
c)0,072.
d)0,036.
e)0,0072.
24 - (FMABC SP/2014)
O ácido cítrico (C6H8O7, M = 192 g.mol–1), cuja fórmula encontra-se representada abaixo, é utilizado em comprimidos efervescentes, sendo o responsável pela reação com o carbonato e bicarbonato de sódio que gera gás carbônico, além de proporcionar um sabor agradável à solução obtida.
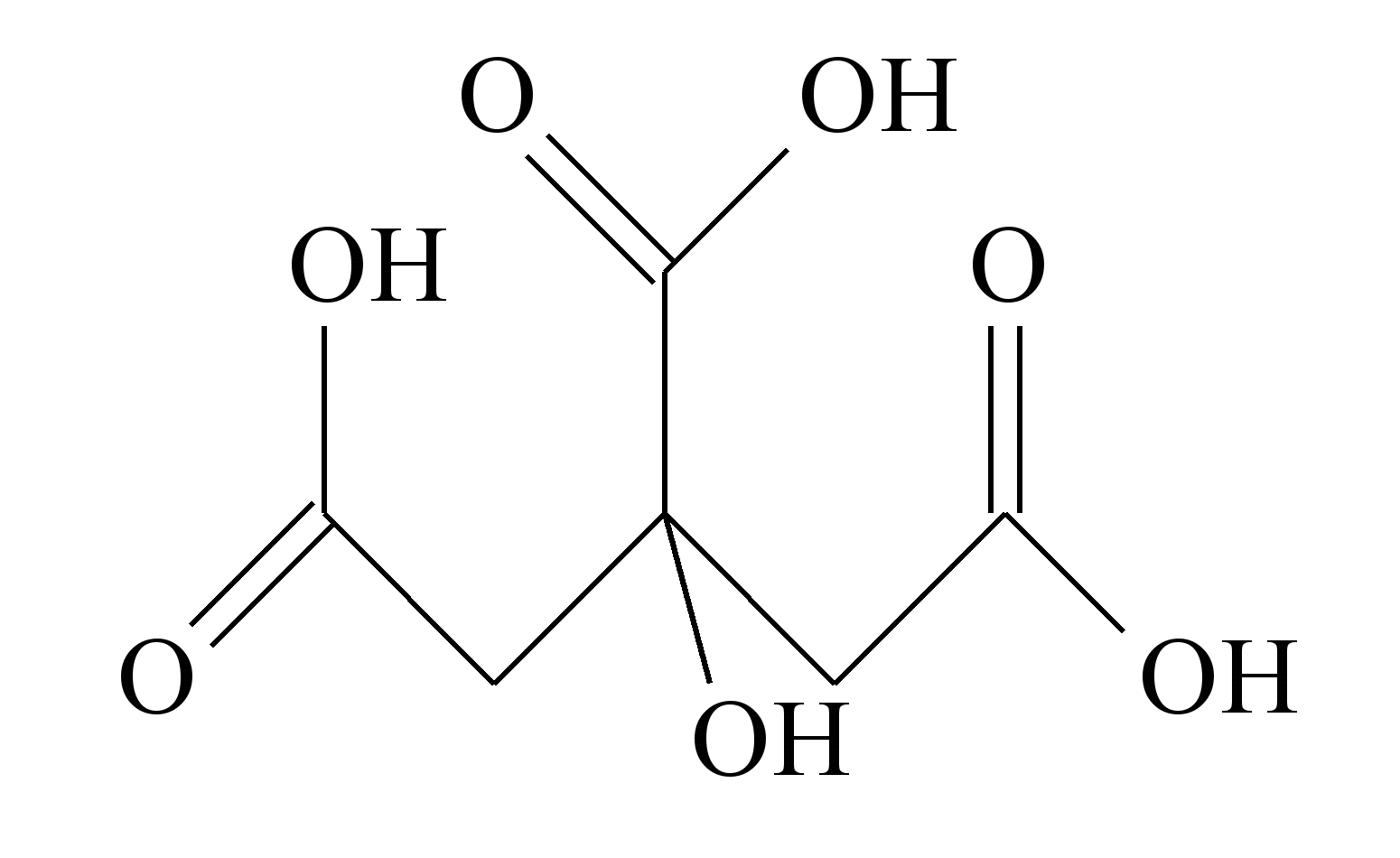
Uma amostra contendo 1,92 g de ácido cítrico neutralizou completamente 50 mL de uma solução aquosa de hidróxido de sódio (NaOH, M = 40 g.mol–1). A concentração da solução alcalina é
a)0,03 mol.L–1.
b)0,2 mol.L–1.
c)0,6 mol.L–1.
d) 0,8 mol.L–1.
e)1,6 mol.L–1.
25 - (PUC MG/2014)
20 mL de HCl 0,5 mol L–1 foram neutralizados por 10 mL de solução aquosa de NaOH. Qual foi a concentração dessa solução?
a)0,1 mol L–1
b)0,5 mol L–1
c)1,0 mol L–1
d)2,0 mol L–1
26 - (IME RJ/2013)
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
a) 3,65 x 10–3 g/cm3
b)7,30 x 10–3 g/cm3
c)4,00 x 10–3 g/cm3
d) 3,20 x 10–3 g/cm3
e)2,00 x 10–3 g/cm3
27 - (PUC Camp SP/2013)
Num laboratório de química foram derrubados na bancada 10 mL de ácido clorídrico 0,1 mol.L–1. A massa, em gramas, de bicarbonato de sódio necessária para que todo o ácido seja neutralizado, sem excesso do sal, é de
Dados: NaHCO3 + HCl → NaCl + H2O + CO2
a) 0,025.
b) 0,048.
c) 0,072.
d) 0,084.
e) 0,120.
28 - (UERN/2015)
Também denominado anidrido sulfúrico ou óxido sulfúrico, o trióxido de enxofre é um composto inorgânico, representado pela fórmula química SO3, é gasoso, incolor, irritante, reage violentamente com a água, é instável e corrosivo. O trióxido de enxofre é obtido por meio da oxidação do dióxido de enxofre, tendo o pentóxido de vanádio como catalisador da reação realizada pelo método de contato. Observe:
![]()
Ressalta-se que as entalpias de formação, em kJ/mol, do SO2 e SO3 são, respectivamente, –297 e –420. A entalpia de combustão de 12,8 gramas, em kJ, do dióxido de enxofre é igual a
a) –123.
b) +123.
c) –24,6.
d) +24,6.
29 - (UDESC SC/2014)
A indústria siderúrgica utiliza-se da redução de minério de ferro para obter o ferro fundido, que é empregado na obtenção de aço. A reação de obtenção do ferro fundido é representada pela reação:
Fe2O3 + 3CO → 2 Fe + 3CO2
Dados: Entalpia de formação (ΔHof) a 25ºC, kJ/mol.
![]()
A entalpia de reação (ΔHor) a 25ºC é:
a)24,8 kJ/mol
b)–24,8 kJ/mol
c)541,2 kJ/mol
d)–541,2 kJ/mol
e) 1328,2 kJ/mol
30 - (Unimontes MG/2014)
O bicarbonato pode ser utilizado para apagar pequenos incêndios, em função da liberação de gás carbônico, conforme a equação:
2NaHCO3 (s) ![]() Na2CO3(s) + H2O(l) + CO2 (g).
Na2CO3(s) + H2O(l) + CO2 (g).
Utilizando os dados de entalpia padrão de formação dessas substâncias,
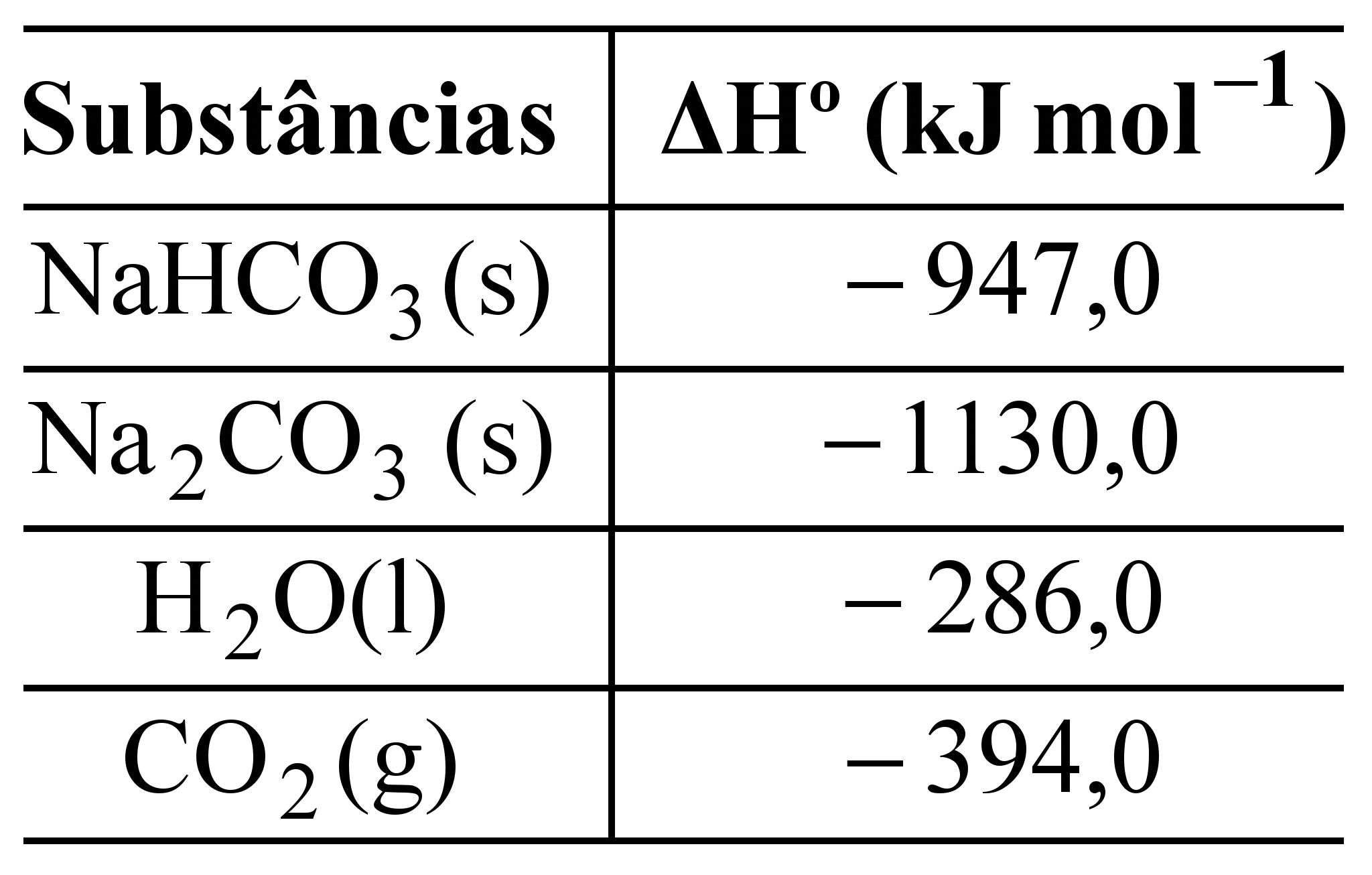
pode-se afirmar que a reação é
a)exotérmica e apresenta valor de ΔHo = – 84 kJ.
b)endotérmica e apresenta valor de ΔHo = 84 kJ.
c)endotérmica e apresenta valor de ΔHo = 680 kJ.
d)exotérmica e apresenta valor de ΔHo = – 680 kJ.
31 - (Fac. Santa Marcelina SP/2013)
Nos laboratórios de anatomia das universidades de medicina, as peças humanas podem ser conservadas em tanques contendo solução de formol.
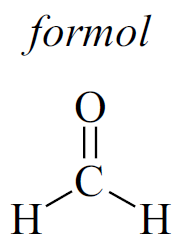

A entalpia de combustão completa do formol, em kJ/mol, é igual a
a)– 571.
b)+ 217.
c)– 789.
d) – 217.
e) + 571.
32 - (UEPB/2013)
O acetileno (etino) é um gás que, ao ser queimado, atinge altas temperaturas e, por isso, tem aplicação em processos de soldas de metais. Esse gás pode ser produzido industrialmente a partir do etano, conforme a equação:
C2H6 (g) → C2H2 (g) + 2H2 (g)
A tabela a seguir apresenta alguns valores de entalpias padrão de formação:
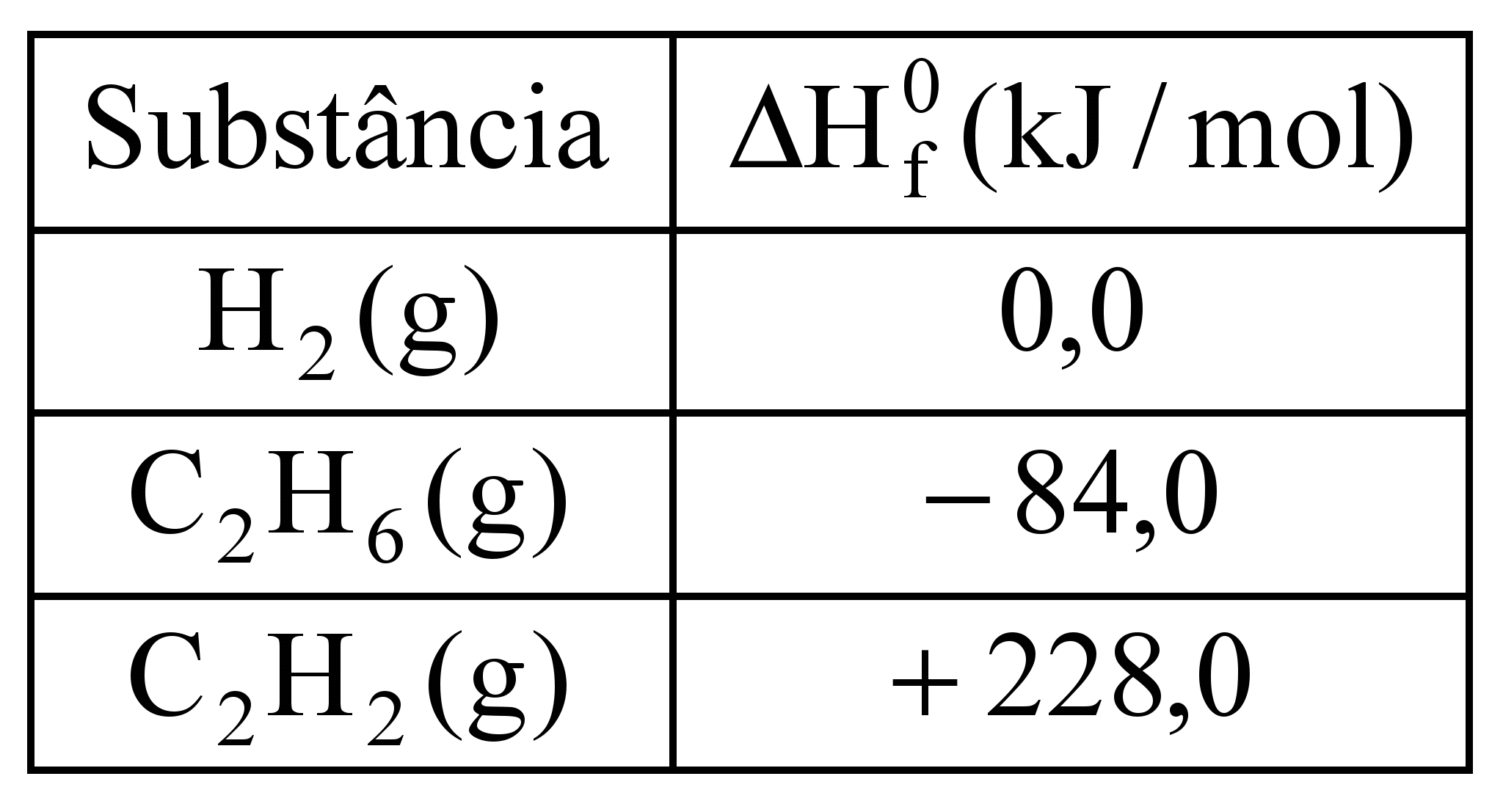
A partir da equação e dos valores apresentados na tabela, é correto afirmar que ΔH dessa reação é:
a)–312,0 kJ/mol
b)+312,0 kJ/mol
c)+144,0 kJ/mol
d) –144,0 kJ/mol
e) +228 kJ/mol
33 - (ESCS DF/2014)
Os carboidratos são a principal fonte de energia para o organismo humano. A reação global de conversão dos açúcares em energia pode ser representada pela equação abaixo.
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l) + energia
As formas abertas dos monossacarídeos podem sofrer ciclização. A depender do lado em que ocorre o ataque nucleofílico da hidroxila sobre o carbono da carbonila, a ciclização resulta em dois isômeros diferentes.
Entalpias padrão de formação (ΔH0f) a 25 ºC
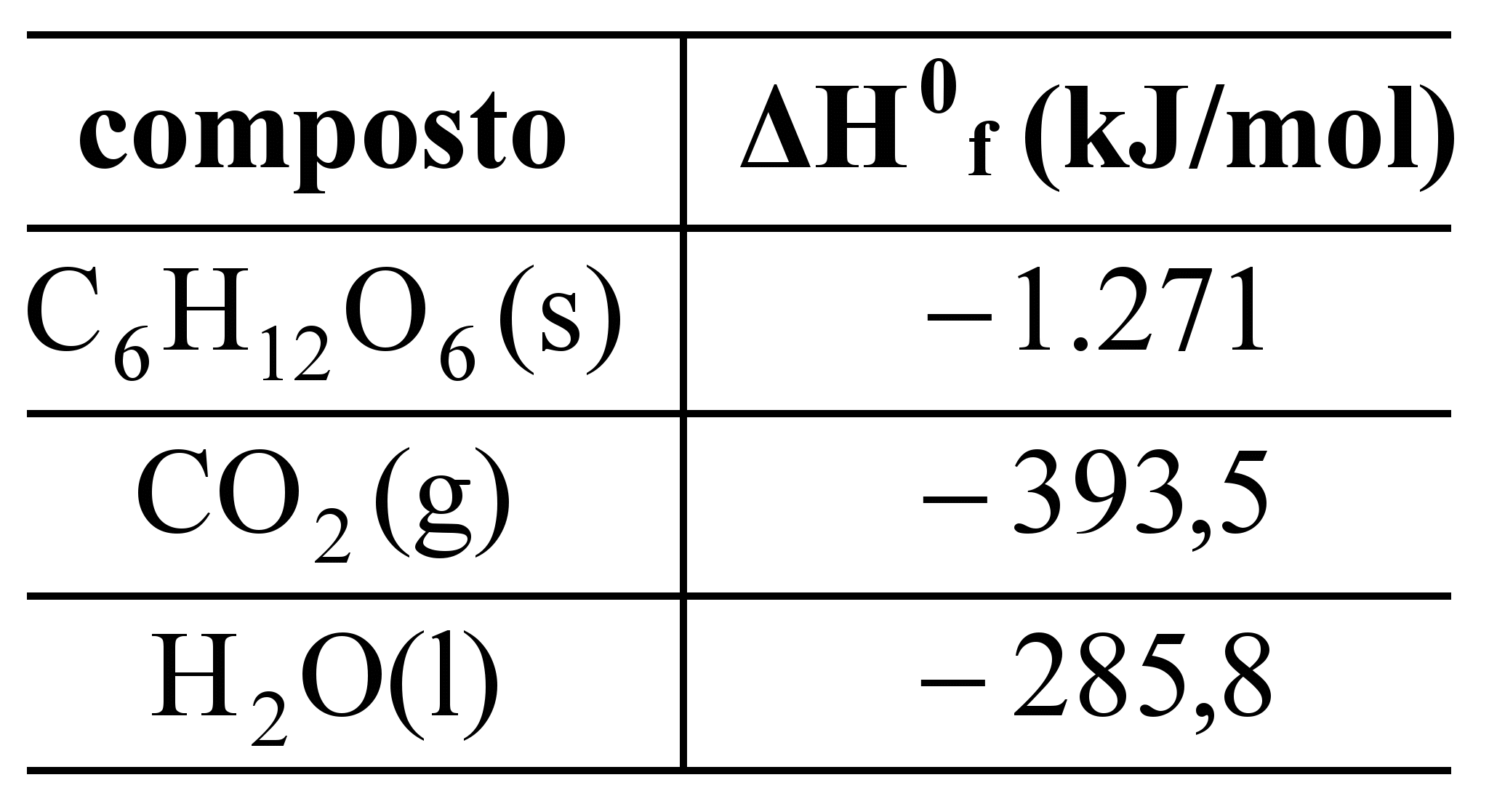
Com base nas entalpias padrão de formação apresentadas na tabela acima, assinale a opção que corresponde ao valor da entalpia padrão de combustão da glicose a 25 ºC.
a)–2.209 kJ/mol
b)–2.604 kJ/mol
c)–2.805 kJ/mol
d)–1.508 kJ/mol
34 - (Fac. Cultura Inglesa SP/2015)
Soluções aquosas de hidróxido de amônio, NH4OH (aq), são empregadas na indústria têxtil e agrícola, no tratamento de efluentes e na limpeza doméstica.
(http://www.infoescola.com. Adaptado.)
Uma solução aquosa de hidróxido de amônio para uso em limpeza doméstica tem concentração de 8% em m/v, e admitindo que esta solução possui densidade igual a 1g/cm3, é correto afirmar que a concentração aproximada, em mol/L, da solução de NH4OH para limpeza doméstica é
a)0,2.
b)0,7.
c)1,2.
d)2,3.
e)3,5.


