QUESTÕES TEORIA ATÔMICO MOLECULAR
01 - (FMJ SP/2014)
Considerando que a constante de Avogadro é igual 6 × 1023 mol–1, calcula-se que o número de átomos de platina presente em cada miligrama desse metal é cerca de Dados: Pt =195
a) 6 × 1020.
b) 1 × 1018.
c) 1 × 1020.
d) 6 × 1018.
e) 3 × 1018.
02 - (PUC RJ/2013)
A massa, em gramas, de 6,02 x 1023 moléculas de uma substância é igual à massa molar dessa substância. Essa relação permite o cálculo da massa de uma molécula de SO2, que é, em gramas, mais próximo do valor: Dados: S = 32 O = 16
a) 1.0 x 10–24
b) 1.0 x 10–23
c) 1.0 x 10–22
d) 1.0 x 1021
e) 1.0 x 1023
03 - (PUC Camp SP/2013)
Na superfície de Marte, o gás predominante é o metano, CH4. Cada metro cúbico desse gás, nas condições ambientais do planeta Marte, contém 0,35 mol de moléculas, o que corresponde a um número de moléculas igual a
Dado: Constante de Avogadro = 6,0 * 1023 mol–1 , C = 12 H = 1
a) 1,2 × 1023
b) 2,1 × 1023
c) 1,2 × 1024.
d) 6,0 × 1024
e) 1,2 × 1025
04 - (FUVEST SP/2013)
Em uma reação de síntese, induzida por luz vermelha de frequência figual a 4,3 x 1014 Hz, ocorreu à formação de 180 g de glicose. Determine
a) o número N de mols de glicose produzido na reação;
b) a energia E de um fóton de luz vermelha;
c) o número mínimo n de fótons de luz vermelha necessário para a produção de 180 g de glicose;
d) o volume V de oxigênio produzido na reação (CNTP).
Note e adote:
6 H2O + 6 CO2 + energia → C6H12O6 + 6 O2
Massas molares: H (1g/mol), C (12g/mol), O (16g/mol).
Energia do fóton: E = h f Constante de Planck h = 6,6 x 10–34 J.s
Nessa reação s.o necessários 2 800 kJ de energia para a formação de um mol de glicose.
1 mol de gás ocupa 22,4 L (CNTP – Condições Normais de Temperatura e Pressão).
05 - (UNICAMP SP/2013)
Entre os vários íons presentes em 200 mililitros de água de coco há aproximadamente 320 mg de potássio, 40 mg de cálcio e 40 mg de sódio. Assim, ao beber água de coco, uma pessoa ingere quantidades diferentes desses íons, que, em termos de massa, obedecem à sequência: potássio>sódio=cálcio. No entanto, se as quantidades ingeridas fossem expressas em mol, a sequência seria: Dados de massas molares em g/mol: cálcio = 40, potássio = 39 e sódio = 23.
a) potássio>cálcio=sódio.
b) cálcio=sódio>potássio.
c) potássio>sódio>cálcio.
d) cálcio>potássio>sódio.
06 - (Unicastelo SP/2013)
Para economizar água, basta fechar a torneira. Por exemplo, escovar os dentes por cinco minutos com a torneira aberta gasta, em média, 12 litros de água, enquanto que molhar a escova, fechar a torneira e bochechar com um copo d’água, gastam 0,3 L. Considerando que a densidade da água é 1 g.mL–1 e a constante de Avogadro 6,0×1023 mol–1, a economia, em número de moléculas de água, H2O, demonstrada é de, aproximadamente,
a) 1 × 1026.
b) 2 × 1026.
c) 4 × 1026.
d) 8 × 1026.
e) 1 × 1027.
07 - (ACAFE SC/2014)
No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem sobre o ataque com armas químicas na Síria ´´[...] O gás sarin é inodoro e invisível. Além da inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio miligrama. […]”.
Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140g/mol.
Constante de Avogadro: 6.1023 entidades.
a) 1,68 × 1026 moléculas.
b) 3,00 × 1023 moléculas.
c) 2,14 × 1021 moléculas.
d) 2,14 × 1018 moléculas.
08 - (UECE/2014)
Futuramente o titânio será mais utilizado na aviação, principalmente na construção de aviões supersônicos, por oferecer grandes vantagens, no que diz respeito a sua elevada temperatura de fusão (1670 ºC), visto que o atrito do ar contra as paredes metálicas tende a elevar a temperatura de todo o corpo das aeronaves. A obtenção do titânio pode ser representada pela equação não balanceada: TiCl4(s) + Mg(s) → Ti(s) + MgCl2(s).
O número aproximado de átomos de magnésio consumidos quando 63,3 g de tetracloreto de titânio reagem totalmente e ( Ti = 47,9 Mg = 24,3 Cl = 35,5 )
a) 8,02 × 1023.
b) 6,02 × 1023.
c) 4,01 × 1023.
d) 2,01 × 1023.
09 - (UEPG PR/2012)
Com relação à massa molecular dos sistemas abaixo, assinale o que for correto.
I. 1 mol de H2SO4.
II. 6,02 × 1023 moléculas de hidrogênio.
III. 22,4 L de gás carbônico (CNTP).
IV. 5 mol de ferro.
V. 0,28 L de água.
Dados: H = 1; O = 16; S = 32; Fe = 56; C = 12.
01. O sistema I contém massa maior do que o sistema III.
02. Considerando a sequência IV, I e III, as massas encontram-se em ordem crescente.
04. A massa do sistema III é maior do que a massa do sistema II.
08. Os sistemas IV e V apresentam a mesma massa.
10 - (UFTM MG/2013)
O incêndio na boate Kiss, em Santa Maria (RS), ocorrido no início do ano de 2013, trouxe à tona uma série de questões sobre a segurança dos estabelecimentos e também sobre o atendimento a vítimas de grandes incêndios. Uma delas é por que foi preciso trazer dos Estados Unidos uma substância tão simples – uma vitamina B injetável – para atender os pacientes que, segundo exames, foram intoxicados com cianeto?
O gás cianídrico liberado na queima da espuma, utilizada para melhorar a acústica da casa noturna, intoxicou a maior parte das vítimas, segundo perícia.
“É descaso e ignorância”, resume o toxicologista Anthony Wong, diretor do Ceatox (Centro de Assistência Toxicológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo). Segundo ele, é inadmissível que o país não tenha a substância e que seu uso não seja difundido entre médicos e socorristas, como acontece em outras partes do mundo.
A hidroxocobalamina, que faz parte do complexo B, é usada em altas concentrações como antídoto para o cianeto. O gás, o mesmo que já foi usado no extermínio de judeus nos campos de concentração nazistas, é subproduto da queima de diversos componentes usados na indústria, como o plástico, o acrílico e a espuma de poliuretano. Segundo os peritos que investigam o incêndio em Santa Maria, essa última foi usada no isolamento acústico da boate.
Capaz de matar em poucos minutos, o cianeto bloqueia a cadeia respiratória das células, impedindo que o oxigênio chegue aos órgãos e tecidos. Quando usada logo após a exposição, a hidroxocobalamina salva vidas. “O efeito é tão rápido que parece até milagroso”, conta Wong. Mas isso não é algo que os médicos aprendem na escola: “São poucas as faculdades que oferecem curso de toxicologia e, nas que tem, a matéria é opcional”.
(noticias.uol.com.br. Adaptado.)
Informações adicionais:
• O gás cianídrico é o cianeto de hidrogênio (HCN) no estado gasoso.
• A fórmula estrutural da hidroxocobalamina é:
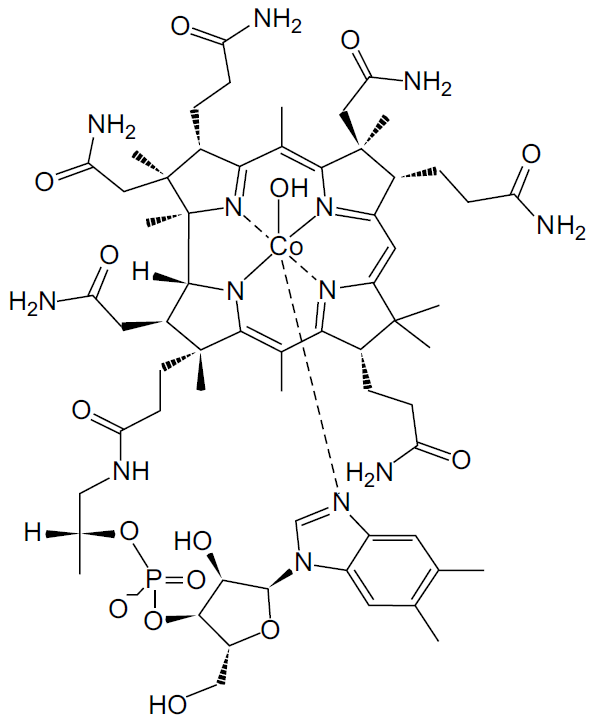
• A massa molar da hidroxocobalamina é aproximadamente igual a 1,3 × 103 g/mol.
Os “cianokits”, que são utilizados por socorristas em outros países nos casos de envenenamento por cianeto, geralmente contêm 5 g de hidroxocobalamina injetável. Considerando a constante de Avogadro igual a 6 × 1023 mol–1, calcula-se que o número aproximado de moléculas existentes nessa massa de hidroxocobalamina é
a) 2 × 1021.
b) 2 × 1025.
c) 3 × 1025.
d) 3 × 1021.
e) 1 × 1021.

