LISTA – TERMOQUÍMICA E CINÉTICA QUÍMICA
Confira o Gabarito e a Resolução Comentada
01 - (UFG GO/2014)
A variação de entalpia (ΔH) é uma grandeza relacionada à variação de energia que depende apenas dos estados inicial e final de uma reação. Analise as seguintes equações químicas:
I-C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(l) ΔHº = –2.220 kJ
II-C(grafite) + O2(g) → CO2(g) ΔHº = –394 kJ
III-H2(g) + ½ O2(g) → H2O(l) ΔHº = –286 kJ
Ante o exposto, determine a equação global de formação do gás propano e calcule o valor da variação de entalpia do processo.
02 - (UDESC SC/2013)
Considere as seguintes reações e suas variações de entalpia, em kJ/mol.
CO(g) + H2(g)→ C (s) + H2O(g) ΔH = –150 kJ/mol
CO(g) + ½ O2(g) → CO2(g) ΔH = –273 kJ/mol
H2(g) + ½ O2(g)→ H2O(g) ΔH = –231 kJ/mol
Pode-se afirmar que a variação de entalpia, para a combustão completa de 1 mol de C(s), formando CO2(g), é:
a) –654 kJ/mol b) –504 kJ/mol c) +504 kJ/mol d) +654 kJ/mol e) –354 kJ/mol
03 - (UNIFOR CE/2013)
Dadas as equações termoquímicas:
I-2 H2(g) + O2(g) → 2H2O (l); ΔH = –571,5 kJ
II-N2O5(g) + H2O (l) → 2 HNO3 (l); ΔH = –76,6 kJ
III- ½ N2(g) + 3/2 O2 (g) + ½ H2 (g) → HNO3(l); ΔH = –174 kJ
Assinale a alternativa com o valor da variação de entalpia, ΔH, para a reação:
2 N2(g) + 5 O2(g) → 2 N2O5(g)
a) –36,7 kJ b) – 28,7 kJ c)+36,7 Kj d) +28,7 kJ e) + 38,3 kJ
04 - (UNISA/2013)
Para evitar infecções, soluções diluídas de água oxigenada (H2O2) são utilizadas no tratamento de ferimentos da pele. Em um dos processos de preparação da água oxigenada utiliza- se a reação entre hidrogênio gasoso e oxigênio gasoso, segundo a equação:
![]()
Considere as equações e suas respectivas entalpias.
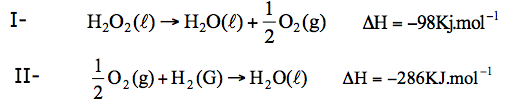
O valor da entalpia de formação, em kJ·mol–1, da água oxigenada no estado líquido é
a) –376. b) –572. c) –188. . . d) –384. e) –474.
05 - (UFJF MG/2012)
A fabricação de diamantes pode ser feita, comprimindo-se grafite a uma temperatura elevada, empregando-se catalisadores metálicos, como o tântalo e o cobalto. As reações de combustão desses dois alótropos do carbono são mostradas a seguir.
C(grafite) + O2 (g) → CO2 (g); ΔH = – 94,06 kcal.mol–1
C(diamante) + O2 (g) → CO2 (g); ΔH = – 94,51 kcal.mol–1
Com base nas reações acima, considere as seguintes afirmações:
I. De acordo com a Lei de Hess, a variação de entalpia da transformação do C(grafite) em C(diamante) é – 0,45 kcal.mol–1.
II. A queima de 1 mol de C(diamante) libera mais energia do que a queima de 1 mol de C(grafite).
III. A formação de CO2(g) é endotérmica em ambos os processos.
Assinale a alternativa CORRETA.
a) Todas as afirmações estão corretas.
b) Somente I e II estão corretas.
c) Somente I e III estão corretas.
d) Somente II e III estão corretas.
e) Somente a afirmação II está correta.
07 - (MACK SP/2012)
A hidrogenação do acetileno é efetuada pela reação desse gás com o gás hidrogênio, originando, nesse processo, o etano gasoso, como mostra a equação química abaixo.
C2H2(g) + 2 H2(g) → C2H6(g)
É possível determinar a variação da entalpia para esse processo, a partir de dados de outras equações termoquímicas, por meio da aplicação da Lei de Hess.
I-C2H2(g) + 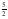 O2(g) → 2 CO2(g) + H2O(l) ΔHºC = –1301 kJ/mol
O2(g) → 2 CO2(g) + H2O(l) ΔHºC = –1301 kJ/mol
II-C2H6(g) + 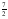 O2(g) → 2 CO2(g) + 3 H2O(l) ΔHºC = –1561 kJ/mol
O2(g) → 2 CO2(g) + 3 H2O(l) ΔHºC = –1561 kJ/mol
III- H2(g) + 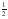 O2(g) → H2O(l) ΔHºC = –286 kJ/mol
O2(g) → H2O(l) ΔHºC = –286 kJ/mol
Assim, usando as equações termoquímicas de combustão no estado-padrão, é correto afirmar que a variação da entalpia para a hidrogenação de 1 mol de acetileno, nessas condições, é de
a)– 256 kJ/mol. b) – 312 kJ/mol. c) – 614 kJ/mol. . d) – 814 kJ/mol. e) – 3148 kJ/mol.
08 - (ACAFE SC/2013)
Considere que a reação química abaixo possui um ΔH = -154 kJ/mol.
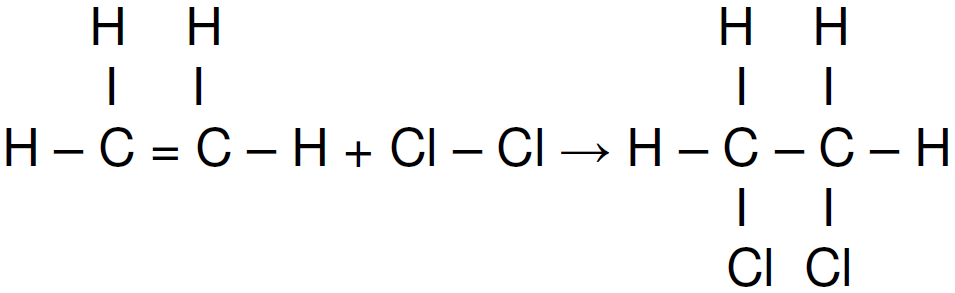
Calcule a energia média em módulo da ligação C = C presente na molécula do etileno e assinale a alternativa correta.
Dados: Para resolução dessa questão considere as seguintes energias de ligação: Cl – Cl: 243 kJ/mol, C – C: 347 kJ/mol, C – Cl: 331 kJ/mol.
a) 766 kJ/mol b)265 kJ/mol c) 694 kJ/mol d) 612 kJ/mol
09 - (FGV SP/2012)
O Teflon é um polímero sintético amplamente empregado. Ele é formado a partir de um monômero que se obtém por pirólise do trifluormetano.
O trifluormetano, CHF3, é produzido pela fluoração do gás metano, de acordo com a reação
CH4(g) + 3F2(g) → CHF3(g) + 3 HF(g).
Dados:
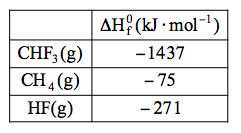
A entalpia-padrão da reação de fluoração do gás metano, em kJ.mol–1, é igual a
a) –1 633. b)–2 175. c)–2 325. d)+1 633. e) +2 175.
10 - (ESCS DF/2012)
A reação do 4-bromo-but-1-eno com o bromo molecular produz a substância 1,2,4-tribromo-butano:
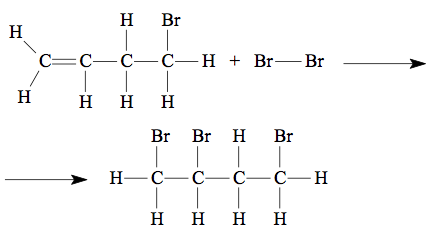
A tabela a seguir apresenta valores médios de algumas energias de ligação em kJ.mol–1.
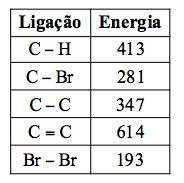
A variação de entalpia envolvida na produção de um mol de 1,2,4-tribromo-butano, em kJ, calculada com os dados da tabela é igual a:
a)+ 295 b)+ 179 c) + 36 d)– 102 e) – 245
11 - (MACK SP)
O gás propano é um dos integrantes do GLP (gás liquefeito de petróleo) e, desta forma, é um gás altamente inflamável.
Abaixo está representada a equação química NÃO BALANCEADA de combustão completa do gás propano.
C3H8(g) + O2(g) → CO2(g) + H2O(v)
Na tabela, são fornecidos os valores das energias de ligação, todos nas mesmas condições de pressão e temperatura da combustão.
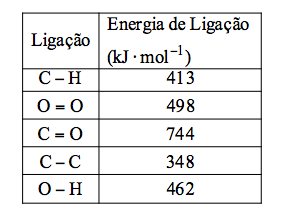
Assim, a variação de entalpia da reação de combustão de um mol de gás propano será igual a
a)– 1670 kJ. b)– 6490 kJ. c)+ 1670 kJ. d)–4160 kJ. e)+4160 kJ.
12 - (UESPI)
Os clorofluorcarbono (CFCs) são usados extensivamente em aerosóis, ar-condicionado, refrigeradores e solventes de limpeza. Os dois principais tipos de CFCs são o triclorofluorcarbono (CFCl3) ou CFC-11 e diclorodifluormetano (CF2Cl2) ou CFC-12. O triclorofluorcarbono é usado em aerosóis, enquanto que o diclorodifluormetano é tipicamente usado em refrigeradores. Determine o ΔH para a reação de formação do CF2Cl2:
CH4(g) + 2Cl2(g) + 2F2(g) → CF2Cl2(g) + 2HF(g) + 2HCl(g)
Dados de energia de ligação em kJ/mol: C-H (413); Cl-Cl (239); F-F (154); C-F (485); C-Cl (339); H-F (565); H-Cl (427).
a)– 234 kJ b)– 597 kJ c)– 1194 Kj d)– 2388 kJ e)– 3582 kJ
13 - (UEG GO)

Baseado na tabela contendo valores de entalpias de ligação acima, o calor liberado em kJ.mol–1, na reação de combustão completa do butano em fase gasosa, seria:
a)1970 b)2264 c)4180 d)5410
14 - (UEL PR/2014)
O processo de remoção de enxofre em refinarias de petróleo é uma prática que vem sendo cada vez mais realizada com o intuito de diminuir as emissões de dióxido de enxofre de veículos automotivos e o grau de envenenamento de catalisadores utilizados. A dessulfurização é um processo catalítico amplamente empregado para a remoção de compostos de enxofre, o qual consiste basicamente na inserção de hidrogênio.
A reação química do composto etanotiol é mostrada a seguir.
C2H5SH(g) + H2(g) → C2H6(g) + H2S(g)
a) Suponha que a reação de dessulfurização seja realizada em laboratório, na presença de concentrações diferentes de etanotiol e hidrogênio, conforme quadro a seguir.
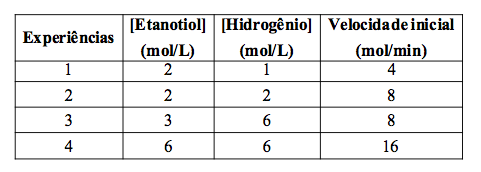
Com base nos dados apresentados nessa tabela, determine a lei da velocidade e a ordem da reação.
b) Considerando que a velocidade média da reação de dessulfurização, em certo intervalo de tempo, é de 10 mol/s em relação ao etanotiol, determine a velocidade da reação em relação ao gás sulfídrico dada em g/s, no mesmo intervalo de tempo.
15 - (Unimontes MG/2013)
A velocidade da reação genérica 2A + B → C é dada por V1 = k [A]2.[B]1. Em uma determinada situação, a concentração de A foi triplicada, e a de B duplicada. O novo valor de velocidade (V2), em função de V1, será:
a) igual a V1. b) 18 vezes maior. c) 2 vezes maior. d) 18 vezes menor.
16 - (UNIFOR CE/2013)
Para a reação entre os gases abaixo, obtiveram-se os seguintes dados sobre a velocidade inicial com respeito à concentração inicial (mol/L) dos reagentes:
2H2 + 2NO → N2 + 2H2O
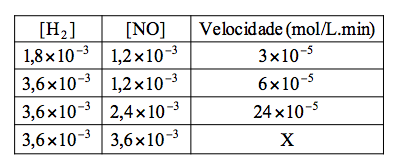
Pode-se dizer que a expressão da velocidade da reação e a velocidade da reação no ponto ‘X’ indicado são:
a) V = k [ NO] [H2], v = 48 * 10–5b)V = k [ NO]2 [H2], v = 54 * 10–5
c) V = k [ NO] [H2]2, v = 72 * 10–5 d)V = k [ NO] [H2]2, v = 96 * 10–5
e) V = k [ NO]2 [H2], v = 72 * 10–5
17 - (UFPA/2012)
Os resultados de três experimentos, feitos para encontrar a lei de velocidade para a reação 2 NO(g) + 2 H2(g) → N2(g) + 2 H2O(g), encontram-se na Tabela 1 abaixo.
Tabela 1 – Velocidade inicial de consumo de NO(g)
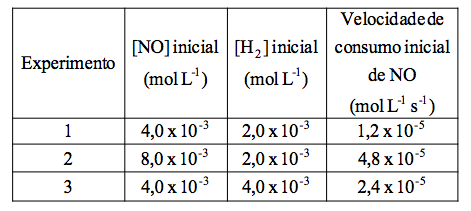
De acordo com esses resultados, é correto concluir que a equação de velocidade é
a)v = k [NO] [H2]2b)v = k [NO]2[H2]2c)v= k [NO]2[H2]
d)v = k [NO]4[H2]2e)v = k [NO]1/2[H2]
18 - (MACK SP/2012)
A tabela mostra a variação da velocidade inicial da reação hipotética representada pela equação A2(g) + 2 B(g) → C(g), em função das concentrações iniciais dos reagentes utilizados no processo.
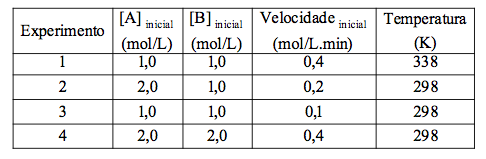
Interpretando-se a tabela, considere as afirmações I, II, III e IV abaixo.
I. O valor da constante de proporcionalidade k é igual para todos os experimentos.
II. A lei cinética da velocidade pode ser expressa pela equação v = k×[A]×[B].
III. Trata-se de uma reação cuja ordem global é 2.
IV. As ordens para os reagentes A e B são, respectivamente, zero e 2.
São verdadeiras, apenas as afirmações
a) I e III. b) I e IV. c)II e III. d) II e IV. e) III e IV.
19 - (UFT TO/2012)
Considere a equação para a reação de obtenção do dióxido de nitrogênio:
2NO(g) + O2(g) → 2NO2(g)
A tabela a seguir apresenta dados obtidos experimentalmente para determinação da cinética de reação do dióxido de nitrogênio à temperatura de 400ºC.
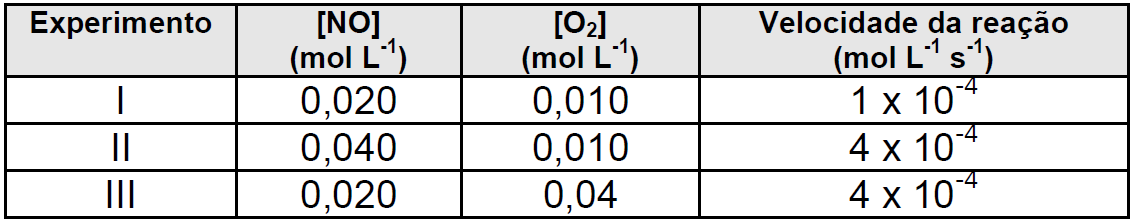
A ordem global da reação é:
-
4 b) 3 c) 2 d) 1 e) 0
20 - (FATEC SP/2014)
Uma indústria necessita conhecer a mecânica das reações para poder otimizar sua produção.
O gráfico representa o mecanismo de uma reação hipotética:
A2 + B2 → 2 AB
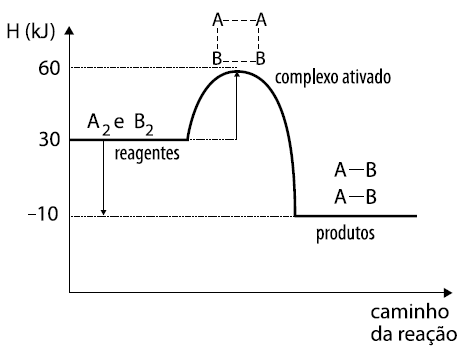
A análise do gráfico permite concluir corretamente que
a) temos uma reação endotérmica, pois apresenta ΔH = –10 kJ.
b) temos uma reação exotérmica, pois apresenta ΔH = +10 kJ.
c) a energia do complexo ativado é 30 kJ.
d) a energia de ativação para a reação direta é 30 kJ.
e) a energia de ativação para a reação inversa é 40 kJ.
21 - (UEG GO/2013)
Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos que serão formados.
O gráfico abaixo representa um diagrama de variação de energia de uma reação química hipotética em que a mistura dos reagentes A e B levam à formação dos produtos C e D.
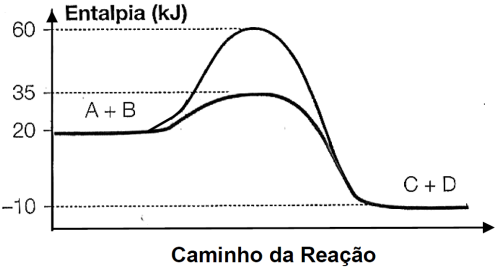
Com base no diagrama, no sentido direto da reação, conclui-se que a
a) energia de ativação da reação sem o catalisador é igual a 15kJ.
b) energia de ativação da reação com o catalisador é igual a 40kJ.
c) reação é endotérmica.
d) variação de entalpia da reação é igual a -30kJ.
22 - (MACK SP/2012)
O diagrama abaixo se refere a um processo químico representado pela equação química X2(g) + Y2(g) → 2 XY(g), realizado por meio de dois caminhos reacionais diferentes, ambos nas mesmas condições de temperatura e de pressão.
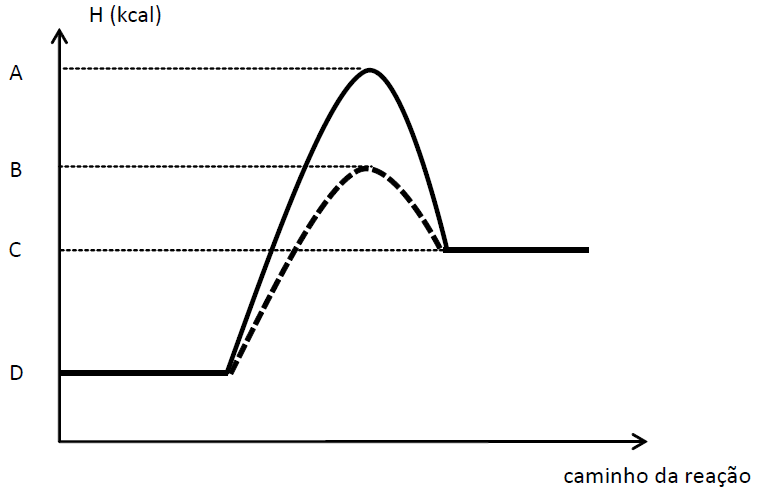
A respeito desse diagrama, é INCORRETO afirmar que
a) a diferença entre os valores de energia, representados pelas letras A e B, corresponde à diminuição da energia de ativação do processo, provocada pelo uso de um catalisador.
b) o valor de energia representado pela letra C identifica a entalpia do produto.
c) o valor de energia representado pela letra D se refere à entalpia dos reagentes.
d) a diferença entre os valores de energia, representados pelas letras A e D, corresponde à energia de ativação do processo catalisado.
e) a diferença entre os valores de energia, representados pelas letras C e D, corresponde à variação da entalpia do processo.
23 - (UFG GO)
A reação química descreve a transformação do composto A em um complexo ativado intermediário que, por sua vez, forma o composto B.
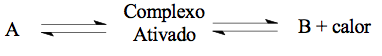
O gráfico a seguir apresenta a relação entre a energia e o caminho da reação.
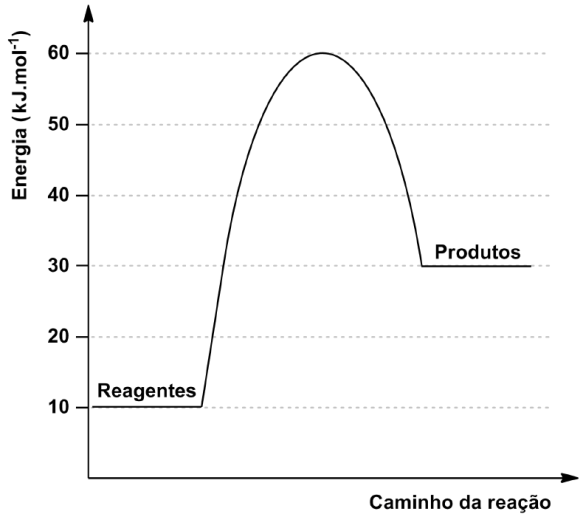
Considerando o exposto,
calcule a energia de ativação e a variação de entalpia (ΔH) da reação.
24 - (MACK SP/2013)
Um aluno, querendo verificar os conceitos de cinética-química discutidos na escola, dirigiu-se a uma drogaria e comprou alguns comprimidos efervescentes, os quais continham, de acordo com o rótulo do produto, massas iguais de bicarbonato de sódio. Ao chegar a sua casa realizou a mistura desses comprimidos com água usando diferentes métodos. Após a observação do fenômeno de liberação gasosa, até que toda a massa de cada comprimido tivesse sido dissolvida em água, o aluno elaborou a seguinte tabela:
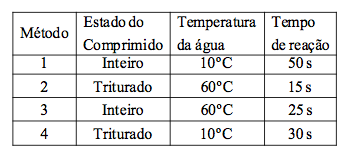
De acordo com os resultados obtidos e mostrados na tabela acima, o aluno fez as seguintes afirmações:
I. Ao comparar somente os métodos 1 e 2 fica impossível determinar qual dos dois fatores variados (estado do comprimido e temperatura da água), aumentou mais a velocidade da reação.
II. A mudança da condição da água, de fria para quente, faz com que, qualquer que seja o estado do comprimido, a velocidade da reação caia pela metade.
III. A influência da temperatura da água é maior do que a influência do estado do comprimido, no aumento da velocidade da reação.
Das afirmações acima, é correto dizer que o aluno errou
a)apenas na afirmação I. b)apenas na afirmação II.
c)apenas na afirmação III. d)apenas nas afirmações II e III.
e)em todas as afirmações.
25 - (UNESP SP/2013)
O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador.
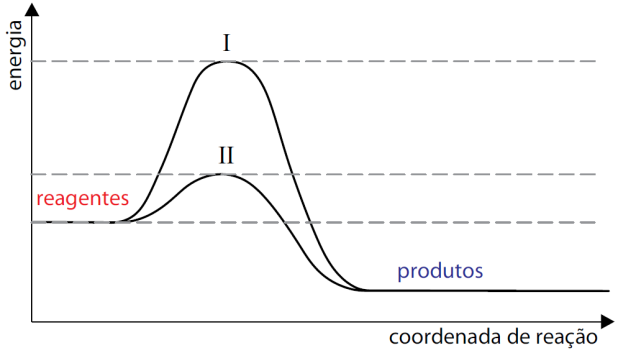
Com base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador.

