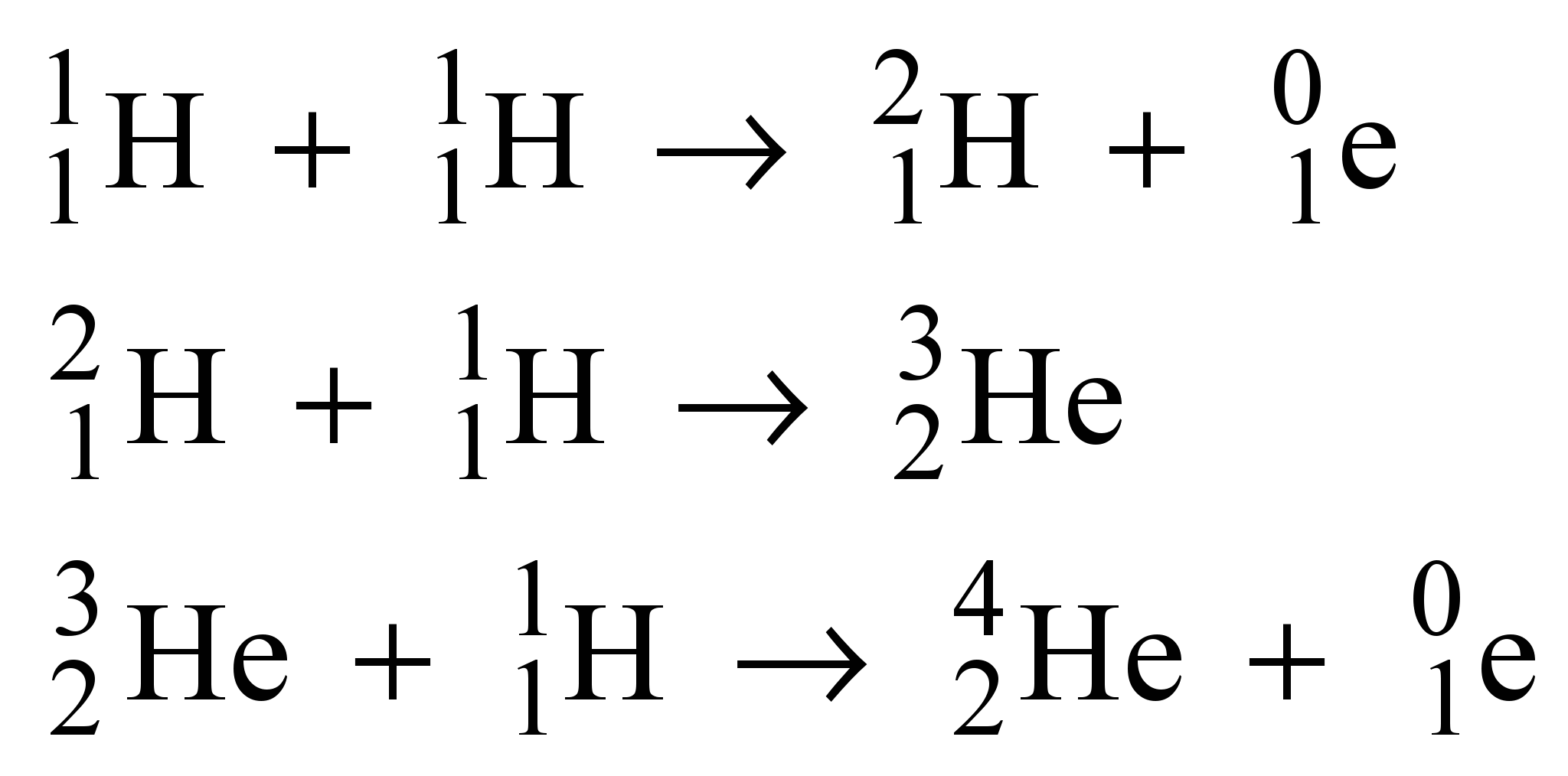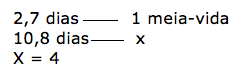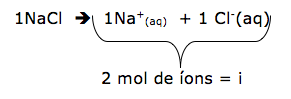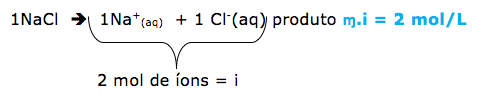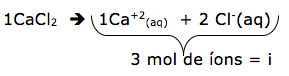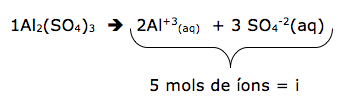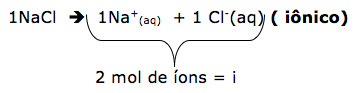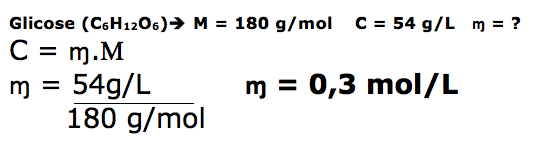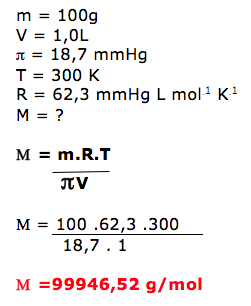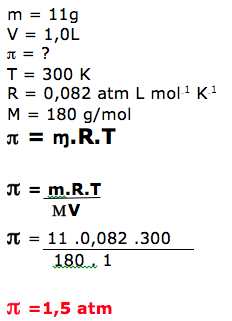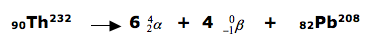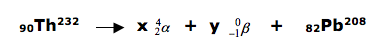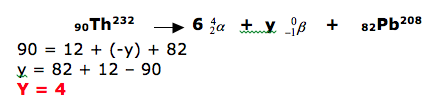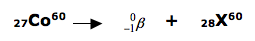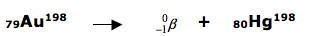Lista de exercícios–Química – prof. Raimundo. 2º. Trimestre - 3º. Ens. Médio 2016
3º. Ens. Médio 2016
- Propriedades coligativas.
- Radioatividade ( reações de desintegração nuclear, meia-vida).
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Ba = 137
01 - (UniCESUMAR SP/2016)
As curvas da pressão de vapor de três soluções aquosas em função da temperatura estão representadas, esquematicamente, no gráfico a seguir.
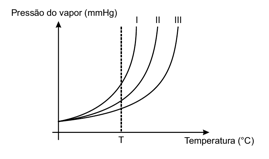
Assinale a alternativa que corresponde adequadamente às curvas com as respectivas soluções.
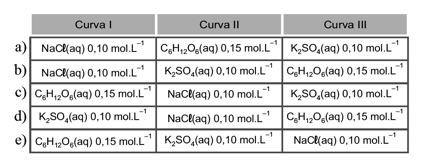
02 - (ACAFE SC/2015)
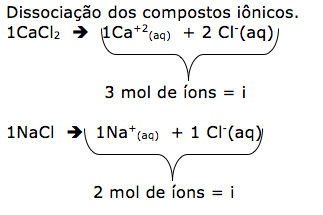
Em um laboratório de química existem 4 frascos:
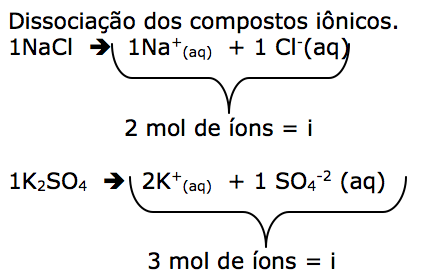
- frasco 1: água
- frasco 2: solução aquosa de CaCl2 0,3 mol/L
- frasco 3: solução aquosa de NaCl 0,3 mol/L
- frasco 4: solução aquosa de glicose 0,3 mol/L
Assinale a alternativa correta que contem a ordem crescente da pressão de vapor do solvente.
a) frasco 2 > frasco 3 > frasco 4 > frasco 1
b) frasco 1 > frasco 4 > frasco 3 > frasco 2
c) frasco 1 < frasco 4 < frasco 3 < frasco 2
d) frasco 2 < frasco 3 < frasco 4 < frasco 1
03 - (IFGO/2016)
Considerando que uma espécie radioativa tem meia-vida média de 30 anos, o tempo, em anos, necessário para que uma determinada massa desse material radioativo seja reduzida a menos de 5% da massa inicial é.
a) 30.
b) 90.
c) 150.
d) 180.
e) 210.
04 - (UCS RS/2015)
Em cinco anos, se não faltarem recursos orçamentários, o Brasil poderá se tornar autossuficiente na produção de radioisótopos, substâncias radioativas que podem ser usadas no diagnóstico e no tratamento de várias doenças, além de ter aplicações na indústria, na agricultura e no meio ambiente. O ouro-198, por exemplo, é um radioisótopo que tem sido frequentemente empregado pela chamada “Medicina Nuclear” no diagnóstico de problemas no fígado.
Supondo que um paciente tenha ingerido uma substância contendo 5,6 mg de 198Au, a massa (em miligramas) remanescente no organismo do mesmo depois de 10,8 dias será igual a.
Dado: t1/2 do 198Au = 2,7 dias
a) 0,175.
b) 0,35.
c) 0,7.
d) 1,4.
e) 2,8.
Observação: Admita que não tenha ocorrido excreção do radioisótopo pelo paciente durante o período de tempo descrito no texto.
05 - (UNCISAL/2015)
Um dos maiores acidentes com o isótopo 137Cs aconteceu em setembro de 1987, na cidade de Goiânia, Goiás, quando um aparelho de radioterapia desativado foi desmontado em um ferro velho. O desastre fez centenas de vítimas, todas contaminadas através de radiações emitidas por uma cápsula que continha 137Cs, sendo o maior acidente radioativo do Brasil e o maior ocorrido fora das usinas nucleares. O lixo radioativo encontra-se confinado em contêineres (revestidos com concreto e aço) em um depósito que foi construído para este fim. Se no lixo radioativo encontra-se 20 g de 137Cs e o seu tempo de meia vida é 30 anos, depois de quantos anos teremos aproximadamente 0,15 g de 137Cs?
a) 90
b) 120
c) 150
d) 180
e) 210
06 - (PUC Camp SP/2016)
O isótopo do elemento césio de número de massa 137 sofre decaimento segundo a equação:
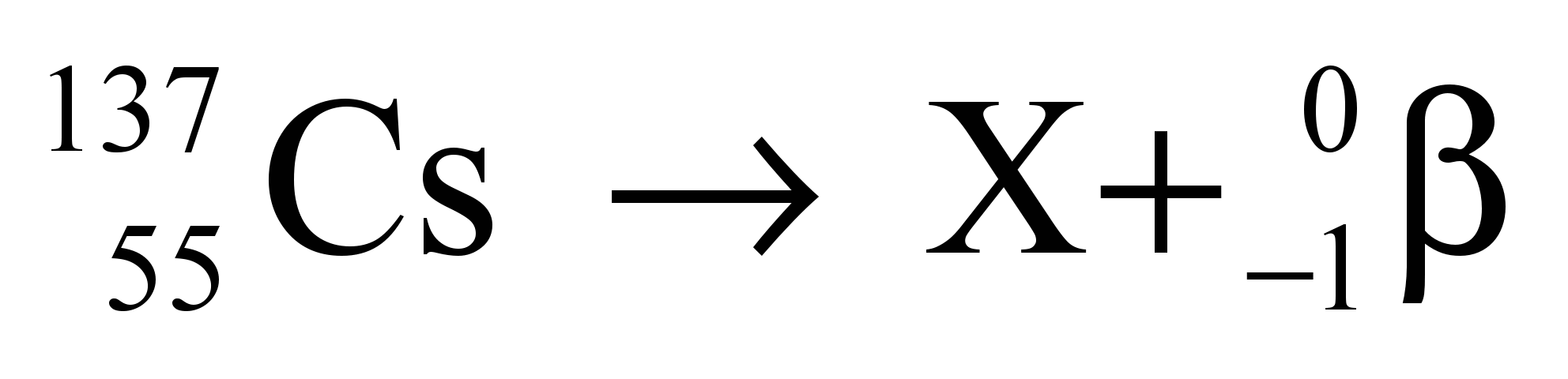
O número atômico do isótopo que X representa é igual a
a) 54.
b) 56.
c) 57.
d) 136.
e) 138.
07 - (UNESP SP/2015)
A energia liberada pelo Sol é fundamental para a manutenção da vida no planeta Terra. Grande parte da energia produzida pelo Sol decorre do processo de fusão nuclear em que são formados átomos de hélio a partir de isótopos de hidrogênio, conforme representado no esquema:
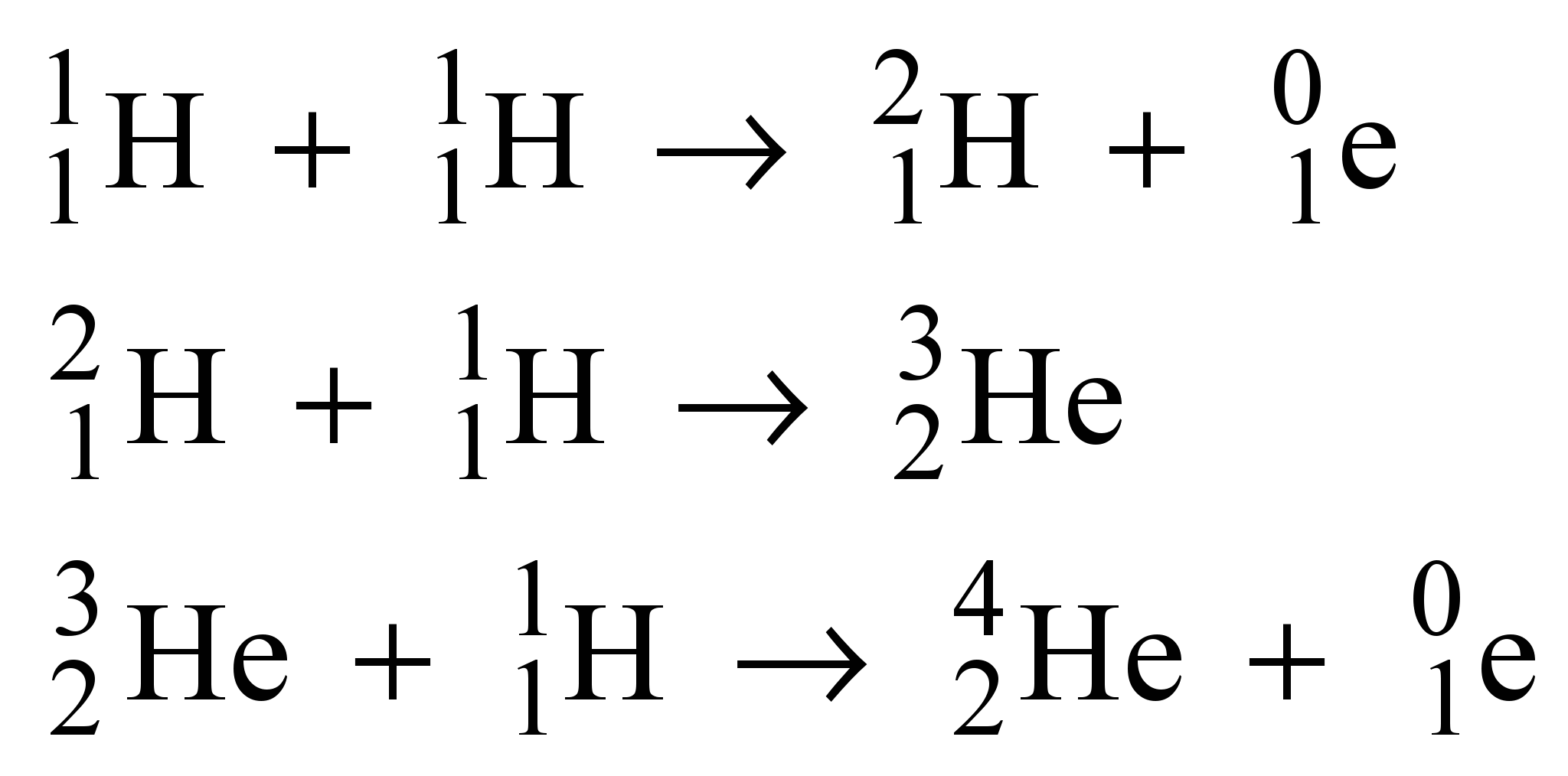
(John B. Russell. Química geral, 1994.).
A partir das etapas consecutivas de fusão nuclear representadas no esquema, é correto afirmar que ocorre.
a) formação de uma molécula de hidrogênio.
b) emissão de nêutron.
c) formação de uma molécula de hidrogênio e de dois átomos de hélio.
d) emissão de pósitron.
e) emissão de próton.
08 - (UFPR/2013)
Em festas e churrascos em família, é costume usar geleiras de isopor para resfriar bebidas enlatadas ou engarrafadas. Para gelar eficientemente, muitas pessoas costumam adicionar sal e/ou álcool à mistura gelo/água. A melhor eficiência mencionada se deve ao fato de que a presença de sal ou álcool:
a) aumenta a taxa de transferência de calor.
b) abaixa a temperatura do gelo.
c) aumenta a temperatura de ebulição.
d) abaixa a temperatura de fusão.
e) abaixa a dissipação de calor para o exterior.
09 - (PUC MG/2013)
Nas mesmas condições de pressão e temperatura foram preparada uma solução aquosa 0,1 mol L–1 de cloreto de sódio, uma solução aquosa 0,1 mol L–1 de sacarose e uma solução aquosa 0,1 mol L–1 de sulfato de potássio.
Sobre essas soluções, é INCORRETO afirmar que:
a) as soluções de cloreto de sódio e sulfato de potássio se vaporizam na mesma temperatura.
b) a solução de sulfato de potássio entra em ebulição a uma temperatura mais alta que a solução de NaCl.
c) a solução de sacarose se congela a uma temperatura mais baixa que a água pura.
d) a solução de NaCl tem menor pressão de vapor que a solução de sacarose.
10 - (UFRN/2012)
Sorvete em cinco minutos.
Uma receita rápida, prática e que parece mágica para o preparo de um sorvete de morango recomenda o seguinte procedimento:
Despeje o leite, o açúcar e a essência de morango num saco de plástico de 0,5 litro e certifique-se de que ele fique bem fechado. Coloque 16 cubos de gelo e 6 colheres de sopa de sal comum (NaCl) num outro saco plástico de 1 litro. Insira o saco de 0,5 litro dentro do saco de 1 litro e feche muito bem. Agite as bolsas de plástico por 5 minutos e, após esse tempo, remova o saco de 0,5 litro de dentro do outro. Em seguida, corte um dos bicos inferiores do saco de 0,5 litro e despeje o sorvete no recipiente de sua preferência.
O que parece mágica, ou seja, o congelamento do sorvete a uma temperatura (-20ºC) mais baixa que 0ºC, pela solução aquosa de cloreto de sódio, é explicado pela propriedade coligativa de diminuição da temperatura de início de solidificação.
Outro soluto que pode produzir a mesma diminuição da temperatura que o NaCl é
a) cloreto de potássio
b) cloreto de cálcio
c) glicose
d) glicerina (C3H8O3)
11 - (UFAL)
A água do mar pode ser considerada como uma solução contendo vários sais dissolvidos. Entre as afirmações a seguir, assinale a que não é correta em relação à água do mar.
a) Um dos sais dissolvidos na água do mar é o cloreto de sódio.
b) A pressão de vapor da água do mar é menor que a da água pura à mesma temperatura.
c) A temperatura normal de ebulição da água do mar é maior do que a da água pura.
d) A temperatura normal de ebulição da água do mar será sempre maior do que a temperatura normal de ebulição de uma solução de sacarose de concentração, emmol/L, igual à do cloreto de sódio existente na água do mar.
e) A temperatura de solidificação da água do mar permanece constante à medida que o solvente se solidifica.
12 - (Mackenzie SP/2015)
Em um experimento de laboratório, realizado sob pressão constante e ao nível do mar, foram utilizadas duas soluções, A e B, ambas apresentando a água como solvente e mesmo sal como soluto não volátil, as quais, estando inicialmente na fase líquida, foram aquecidas até ebulição. Desse experimento, foram coletados os dados que constam da tabela abaixo:

Um analista, baseando-se nos resultados obtidos, fez as seguintes afirmações:
I. A pressão de vapor de ambas as soluções é menor do que a pressão de vapor da água pura.
II. A solução A apresenta menor concentração de sal em relação à concentração salina da solução B.
III. As forças de interação intermoleculares na solução B apresentam maior intensidade do que as forças de interação existentes, tanto na solução A como na água.
É correto dizer que
a) nenhuma afirmação é verdadeira.
b) as afirmações I e II são verdadeiras.
c) as afirmações I e III são verdadeiras.
d) as afirmações II e III são verdadeiras.
e) todas as afirmações são verdadeiras.
13 - (Unievangélica GO/2015)
Em determinadas condições, as soluções possuem comportamentos coligativos diferentes em relação aos solventes puros, pois o número de partículas de soluto dissolvidas em solventes pode alterar significativamente as suas propriedades coligativas. Ao se dissolver em diferentes tipos de solutos em água, formar-se-ão soluções com diferentes comportamentos.
Nessas condições, a temperatura de ebulição será maior ao dissolver 1,0 mol de.
a) cloreto de sódio em 100 mL de água.
b) sacarose em 100 mL de água.
c) etanol em 100 mL de água.
d) glicose em 200 mL de água.
14 - (UFU MG/2013)
Nas águas dos oceanos, encontram-se diversos íons dissolvidos, como cloretos, sódio, sulfatos, bicarbonatos, magnésio, potássio entre outros, que contribuem para a sua constante salinidade. Um estudante extraiu uma amostra de aproximadamente 200 mL de água do mar, acrescentou 10 g de açúcar (sacarose) e fez algumas verificações quanto às propriedades desta nova solução.
Com base em seus conhecimentos químicos, marque, para as afirmativas abaixo, (V) Verdadeira, (F) Falsa ou (SO) Sem Opção.
1. A pressão de vapor do sistema diminui a partir da adição do açúcar.
2. O ponto de fusão da solução final é maior que o da inicial.
3. A condutibilidade elétrica da solução resultante aumentou.
4. A concentração dos íons presentes na solução final permanece a mesma da solução inicial.
15 - (UFTM MG/2013)
Na figura estão representadas as curvas pressão de vapor x temperatura para três solventes puros: benzeno (curva vermelha), água (curva azul) e ácido acético (curva verde).
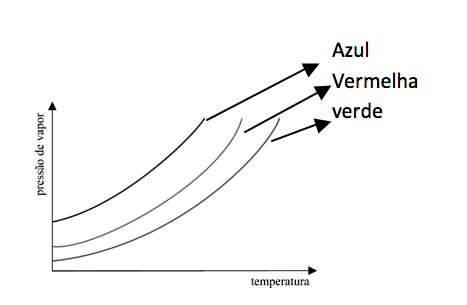
Sobre esses três solventes, é correto afirmar que.
a) o ácido acético apresenta a menor temperatura de ebulição a 1 atm.
b) o benzeno apresenta a maior temperatura de ebulição a 1 atm.
c) a água apresenta a maior temperatura de ebulição a 1 atm.
d) na água ocorrem as interações intermoleculares mais intensas.
e) no ácido acético ocorrem as interações intermoleculares mais intensas.
16 - (FGV SP)
Considerando a água pura, uma solução aquosa de glicose de concentração igual a 3,0 mol L–1 e uma solução aquosa de cloreto de cálcio de concentração igual a 1,0 mol L–1, assinale a alternativa que apresenta a ordem correta para as temperaturas de ebulição (Te ) desses líquidos.
a) Te água > Te da solução contendo glicose > Te da solução contendo cloreto de cálcio.
b) Te água < Te da solução contendo glicose < Te da solução contendo cloreto de cálcio.
c) Te água = Te da solução contendo glicose = Te da solução contendo cloreto de cálcio.
d) Te água < Te da solução contendo glicose = Te da solução contendo cloreto de cálcio.
e) Te água > Te da solução contendo glicose = Te da solução contendo cloreto de cálcio.
17 - (UEG GO)
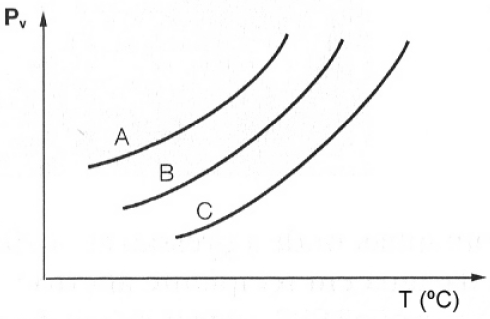
A análise da figura acima, que representa o gráfico da pressão de vapor versus a temperatura para três líquidos puros hipotéticos, permite concluir que.
a) a adição de NaCl aos líquidos diminui as suas temperaturas de ebulição.
b) na mesma temperatura o líquido B apresenta maior pressão de vapor.
c) o líquido C apresenta a menor temperatura de ebulição.
d) o líquido A é o mais volátil.
18 - (UECE/2015)
A purificação da água através do processo de osmose é citada, em 1624, na obra Nova Atlântida, de Francis Bacon (1561-1626). A dessalinização de uma solução de sulfato de alumínio pelo processo citado acima ocorre utilizando-se uma membrana semipermeável. Considerando a concentração em quantidade de matéria da solução 0,4 mol/L, admitindo-se o sal totalmente dissociado e a temperatura de 27 ºC, a diferença da pressão osmótica que se estabelece entre os lados da membrana no equilíbrio, medida em atmosferas, é.
a)39,36.
b)49,20.
c)19,68.
d)29,52.
19 - (UECE/2014)
A descoberta do fenômeno da osmose foi atribuída a René Joachim Henri Dutrochet (1776 – 1847), físico e botânico francês, autor do termo "osmose". Sua pesquisa teve fundamental importância para explicar o processo da respiração celular. A pressão osmótica utilizada para interromper a osmose de uma determinada solução de glicose (C6H12O6) contendo 10 g/L a 15 ºC é
a)2,62 atm.
b)1,83 atm.
c)2,92 atm.
d)1,31 atm.
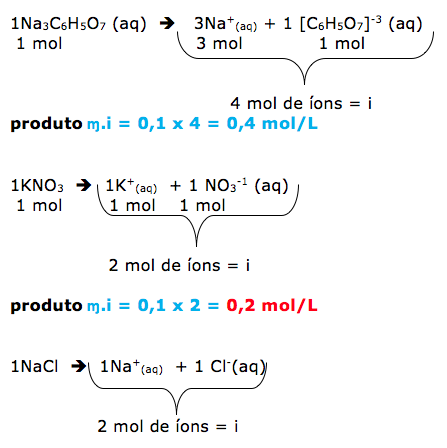
20 - (Fac. Anhembi Morumbi SP/2014)
Considere as seguintes soluções aquosas:
- citrato de sódio, Na3C6H5O7 0,1 mol/L.
- nitrato de potássio, 0,1 mol/L.
- glicerina, C3H8O3 0,2 mol/L.
- cloreto de sódio, 0,15 mol/L.
- ureia, (NH2)2CO 1,2 g/L.
Dentre as soluções relacionadas, são isotônicas as soluções de
a) citrato de sódio, glicerina e ureia.
b) citrato de sódio e nitrato de potássio.
c) ureia, glicerina e nitrato de potássio.
d) glicerina e nitrato de potássio.
e) ureia e cloreto de sódio.
21 - (FAMECA SP/2013)
Soluções isotônicas são aquelas que apresentam a mesma concentração de partículas (moléculas ou íons).
Se uma solução de Ca(NO3)2 apresenta concentração igual a 0,2 mol L–1, ela será isotônica de uma solução de

22 - (Fac. Santa Marcelina SP/2012)
Entre as alternativas, a que exemplifica corretamente um par de soluções aquosas isotônicas é
a) glicose 0,30 mol/L e cloreto de sódio 0,15 mol/L.
b) glicose 0,30 mol/L e cloreto de sódio 0,30 mol/L.
c) glicose 0,15 mol/L e cloreto de sódio 0,30 mol/L.
d) cloreto de sódio 0,15 mol/L e cloreto de cálcio 0,30 mol/L.
e) cloreto de sódio 0,15 mol/L e cloreto de cálcio 0,15 mol/L.
23 - (UFES)
O fenômeno de osmose ocorre quando duas soluções com concentrações diferentes estão separadas por uma membrana permeável somente ao solvente. A pressão osmótica é dada pela equação: p = i c RT, onde i é o fator de van’t Hoff; c é a concentração em mol L-1; R é a constante dos gases (0,082 L atm mol-1 K-1) e T a temperatura em Kelvin. A pressão osmótica no sangue humano a 37ºC é 7,6 atm.
a) Calcule a concentração, em % (m/v), de uma solução de NaCl que exerce a mesma pressão osmótica do sangue (solução isotônica),admitindo que a densidade da solução seja igual a 1g/mL.
b) Calcule a massa de NaCl que deve ser pesada para preparar 500 mL de soro fisiológico (solução isotônica) a serem injetados no sangue.
24 - (UFCG PB)
Uma proteína de uma amostra de soro sanguíneo foi isolada e uma dispersão coloidal, contendo 684 mg desta proteína, foi preparada com água suficiente para formar 10 mL de solução. Essa solução apresenta uma pressão osmótica de 0,31 atm a 37oC. Considerando a proteína como sendo um composto covalente , sua massa molecular aproximada é:
a) 6´1023g/mol.
b) 684 g/mol.
c) 5,7´103 g/mol.
d) 12´103 g/mol.
e) 12´10–3 g/mol.
25 - (PUC SP)
Um técnico de laboratório preparou uma solução aquosa de cloreto de cálcio isotônica a uma solução aquosa de glicose. Considerando que a concentração da solução de glicose (M = 180g.mol–1) é de 54g.L-1 e que o cloreto de cálcio encontra-se completamente dissociado nestas condições, as concentrações de cátions Ca2+ e a de ânions Cl– na solução aquosa em questão são, respectivamente,
a) 27g. L–1 e 27 g. L–1.
b)18 g. L–1 e 36 g. L–1.
c)0,30mol. L–1 e 0,60mol. L–1.
d) 0,15mol. L–1 e 0,15mol. L–1.
e)0,10mol. L–1e 0,20 mol. L–1.
26 - (UFSCAR SP)
Um tipo de sapo do Sudeste da Ásia, Rana cancrivora, nasce e cresce em locais de água doce, tais como rios e lagos. Depois de atingir seu desenvolvimento pleno neste ambiente, o sapo adulto possui duas características marcantes. A primeira delas é ser dotado de uma pele com alta permeabilidade, que lhe permite trocar eficientemente O2 e CO2 gasosos, água e íons, entre seus tecidos e o meio aquático externo. A segunda característica é que na procura por alimentos ele se move para manguezais, onde o teor salino é muito mais elevado que o do seu meio aquático original. Para evitar os danos que poderiam resultar da mudança de ambientes, o sapo dispõe de recursos metabólicos, que podem envolver a diminuição da excreção de NaCl ou da ureia (H2N – CO – NH2) contidos em seu corpo, sendo que neste caso a ureia não sofre hidrólise.
a) Supondo que o controle dos efeitos da mudança de ambiente fosse feito exclusivamente pela retenção de NaCl pelo organismo deste sapo, seria necessária a retenção de 2,63 g de NaCl por 100 mililitros de líquido corporal. Se o controle fosse feito exclusivamente pela retenção de ureia pelo organismo deste sapo, calcule a quantidade, em gramas, de ureia por 100 mililitros de líquido corporal para obter o mesmo efeito de proteção que no caso do NaCl.
b) Considerando outra espécie de sapo, cuja pele fosse permeável apenas ao solvente água, escreva o que ocorreria a este sapo ao se mover da água doce para a água salgada. Justifique sua resposta.
Dados: massas molares: NaCl = 58,4 g mol–1; ureia = 60,0 g mol–1.
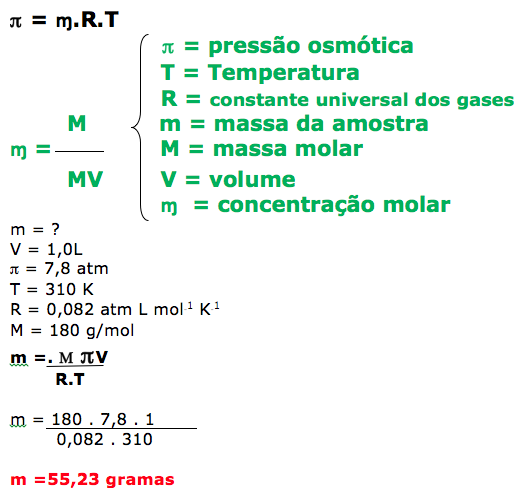
27 - (UEM PR)
Sabendo-se que o sangue humano possui uma pressão osmótica de 7,8 atm a 37ºC, a massa de glicose (C6H12O6) usada para preparar um litro de uma solução isotônica a essa temperatura é, aproximadamente,
a)5,5 gramas.
b)110 gramas.
c)55 gramas.
d)220 gramas.
e)11 gramas.
28 - (Unimontes MG)
A migração de solventes através da membrana semipermeável é estudada pela osmometria. A grande aplicação desse método é a determinação da massa molar de macromoléculas como as proteínas. Considerando que 100,0 g de uma proteína são dissolvidos em 1,0 L de solução aquosa, de pressão osmótica 18,7 mmHg, a 27ºC, e que o valor da constante universal dos gases (R) é 62,3 mmHg L/K mol, pode-se afirmar que a massa molar dessa proteína é, aproximadamente,
a)1,0 x 104g/mol.
b)1,9 x 103g/mol.
c)1,0 x 105g/mol.
d)1,9 x 105g/mol.
29 – (PO 2014)(PUC SP)
Um técnico de laboratório preparou uma solução aquosa de cloreto de cálcio isotônica a uma solução aquosa de glicose. Considerando que a concentração da solução de glicose é de 54 g.L-1 e que o cloreto de cálcio encontra-se completamente dissociado nestas condições, determine a concentração de ânions cloreto em mol.L-1 na solução aquosa em questão .
30 - (UEPB)
A pressão osmótica é um efeito coligativo verificado em vários fenômenos biológicos: no sangue humano; na desidratação infantil; na ascensão da água do solo até as partes mais altas dos vegetais; e até na conservação dos alimentos. Qual é a pressão osmótica, a 27ºC, de uma solução aquosa que contém 11g de glicose em 1l de solução?
a)0,01 atm
b)0,82 atm
c)0,15 atm
d)0,08 atm
e)1,50 atm
31 - (UNISC RS/2014)
As soluções coligativas de solventes puros são modificadas quando se adiciona um soluto não volátil a eles. Essas propriedades, portanto, não são explicadas pela natureza da substância, mas pela quantidade de moléculas, partículas ou átomos adicionados. Atuam mais especificamente sobre as propriedades físicas, pressão de vapor (tonoscopia), ponto de ebulição, PE (ebulioscopia), ponto de congelamento (crioscopia) e pressão osmótica (osmoscopia). Pode se afirmar que a adição de cloreto de sódio (sal de cozinha) em água provoca
a) a diminuição da pressão de vapor, aumento do PE e diminuição da temperatura de congelamento.
b) a diminuição da pressão de vapor, diminuição do PE e diminuição da temperatura de congelamento.
c) a diminuição da pressão de vapor, aumento do PE e aumento da temperatura de congelamento.
d) o aumento da pressão de vapor, aumento do PE e diminuição da temperatura de congelamento.
e) o aumento da pressão de vapor, aumento do PE e aumento da temperatura de congelamento.
32 –(PO 2014) (UFU MG/2013)
A tecnologia nuclear possui diversas aplicações, das quais se destacam a esterilização de alimentos, a determinação da idade das rochas, entre outras. O tório ( Th ) é um dos elementos utilizados na tecnologia nuclear cuja transmutação natural, a partir do radioisótopo 90Th232, emite partículas alfa e beta e termina com o isótopo82Pb208. Escreva a reação nuclear citada no enunciado, devidamente balanceada.
33 - (Mackenzie SP/2013)
Em um laboratório, são preparadas três soluções A, B e C, contendo todas elas a mesma quantidade de um único solvente e cada uma delas, diferentes quantidades de um único soluto não volátil.
Considerando que as quantidades de soluto, totalmente dissolvidas no solvente, em A, B e C, sejam crescentes, a partir do gráfico abaixo, que mostra a variação da pressão de vapor para cada uma das soluções em função da temperatura, é correto afirmar que, a uma dada temperatura “T”,
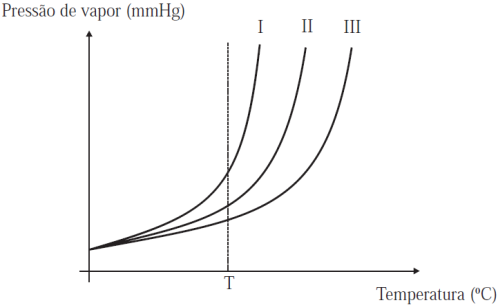
a) a solução C corresponde à curva I, pois quanto maior a quantidade de soluto não volátil dissolvido em um solvente, menor é a pressão de vapor dessa solução.
b) solução A corresponde à curva III, pois quanto menor a quantidade de soluto não volátil dissolvido em um solvente, maior é a pressão de vapor dessa solução.
c) as soluções A, B e C correspondem respectivamente às curvas III, II e I, pois quanto maior a quantidade de um soluto não volátil dissolvido em um solvente, maior a pressão de vapor da solução.
d) as soluções A, B e C correspondem respectivamente às curvas I, II e III, pois quanto menor a quantidade de um soluto não volátil dissolvido em um solvente, maior a pressão de vapor da solução.
e) a solução B é a mais volátil, que é representada pela curva II.
34 - (UFU MG/2013)
Os habitantes das regiões áridas percebem que os lagos de água salgada têm menor tendência para secar que os lagos de água doce. Esse fato deve-se à
a) menor dissolução de gases atmosféricos nos lagos de água salgada, devido à elevada concentração salina que acentua o efeito tonoscópico.
b) alta evaporação da água dos lagos salgados, em função do efeito ebulioscópico causado pelos sais dissolvidos.
c) maior concentração de solutos eletrólitos não voláteis dissolvidos nos lagos de água salgada, acentuando o efeito tonoscópico.
d) elevada presença de não eletrólitos dissolvidos na água salgada, produzindo menor efeito tonoscópico.
35 –(PO 2014) (PUC MG/2013)
Nas mesmas condições de pressão e temperatura foram preparadas diversas soluções, tais como: solução aquosa 0,1 mol L–1 de cloreto de sódio, uma solução aquosa 34,2 g/L de sacarose e uma solução aquosa 0,1 mol L–1 de sulfato de potássio. Qual delas apresenta a maior temperatura de ebulição? Justifique a sua resposta
36 –(PO 2014) (ESCS DF/2014)
As emissões radioativas são empregadas na radioterapia para destruir células doentes ou impedi-las de se reproduzirem. Em 1987, uma cápsula contendo cloreto de césio-137 foi abandonada junto a um equipamento nas antigas instalações do Instituto Goiano de Radioterapia, em Goiânia. A cápsula foi encontrada e aberta pelo dono de um ferro-velho, o que causou o maior acidente radioativo da história do Brasil. Considere que o tempo de meia-vida do césio-137 é de trinta anos Quanto tempo levará para a atividade do radioisótopo 137Cs cair para 3,125% de seu valor inicial?
37 - (UNIFOR CE/2015)
Evitar a poluição do ar de interiores é tão difícil quanto evitar a poluição do exterior de edifícios. A qualidade do ar nas casas e nos locais de trabalho é afetada por atividades humanas, materiais de construção e outros fatores no nosso ambiente. Os poluentes de interiores mais comuns são o dióxido de carbono, o monóxido de carbono, o formaldeído e o radônio. O radônio apresenta quatro isótopos, todos radioativos, dos quais o isótopo de massa atômica 222 é o mais estável, com uma meia-vida de 3,8 dias. A respeito deste isótopo do radônio, é correto afirmar que ( consultar uma tabela periódica).
a) possui mais prótons que os demais isótopos deste elemento.
b) por ter uma meia-vida mais longa que os demais isótopos apresenta menor risco para a saúde.
c) após 7,6 dias, a massa de uma amostra de radônio-222 se reduz à metade de seu valor inicial.
d) a soma de prótons e nêutrons do radônio-222 é a mesma apresentada pelos demais isótopos.
e) possui apenas 136 nêutrons.
38 - (Unimontes MG/2015)
O amerício-241, isótopo emissor de partícula alfa, é usado em detectores de fumaça e tem meia-vida de 432 anos. O produto de decaimento do amerício-241 e a porcentagem aproximada desse isótopo original que ainda restará depois de 1000 (mil) anos são, respectivamente, iguais a ( consultar a tabela periódica).
a) Urânio-237 e 25%.
b) Netúnio-237 e 50%.
c) Urânio- 239 e 12,5%.
d)Netúnio-237 e 25%.
39 - (UniCESUMAR SP/2015)
O radioisótopo 241Am é um emissor alfa utilizado em alguns dispositivos detectores de fumaça. A radiação β ioniza as moléculas de ar presentes na câmara de detecção e uma corrente elétrica é gerada e medida. A presença de fumaça altera a corrente medida, devido ao material particulado, e o alarme é acionado.
Uma das maneiras de produzir o 241Am em reatores nucleares consiste em duas transformações radioativas a partir de um determinado nuclídeo: a incorporação de uma partícula com a emissão de um nêutron e, posteriormente, a emissão de uma partícula β.
Um dos problemas desses detectores é o seu descarte, pois a atividade radioativa do dispositivo permanece por um longo período. A projeção indica que após 1296 anos a atividade radioativa de uma amostra de 241Am é de 12,5 % da original.
Com base nas informações do texto, o nuclídeo utilizado na produção de 241Am e a meia vida do radioisótopo do 241Am são, respectivamente,
a) 237U e 162 anos.
b) 246Bk e 324 anos.
c) 238U e 162 anos.
d) 246Bk e 432 anos.
e) 238U e 432 anos.
40 - (ACAFE SC/2014)
Quanto tempo levará para a atividade do radioisótopo 137Cs cair para 3,125% de seu valor inicial?
Dado: Considere que o tempo de meia vida do radioisótopo 137Cs seja de 30 anos.
a)150 anos
b) 0,93 anos
c) 180 anos
d) 29 anos
41 - (Fac. Santa Marcelina SP/2014)
O ítrio-90 é um radioisótopo que tem sido cada vez mais utilizado no tratamento de tumores, especialmente do fígado, e apresenta meia-vida de 64 horas. No gráfico, sem escala definida, a curva mostra a atividade de certa amostra de 90Y ao longo do tempo.
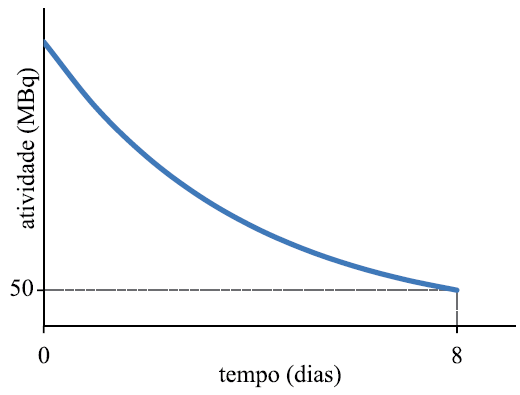
De acordo com os valores indicados no gráfico, o valor da atividade, em MBq, no tempo zero era igual a
a)200.
b)300.
c)400.
d)500.
e)100.
42 - (FATEC SP/2015)
Em 2014, na Alemanha, um elemento pesado foi confirmado por experimentos com um colisor de partículas e ocupará sua justa posição como Elemento 117 na Tabela Periódica.
Bombardeando amostras de berquélio radioativo com átomos de cálcio, pesquisadores criaram átomos com 117 prótons, originando um elemento químico, aproximadamente, 42% mais pesado que o chumbo e com meia-vida relativamente longa. Os físicos apelidaram, temporariamente, o novo integrante da Tabela Periódica como “ununséptio” (Uus), alusão direta ao numeral 117, que é a soma dos 20 prótons do cálcio com os 97 do berquélio.
(http://tinyurl.com/m8nlkq2 Acesso em: 13.06.2014. Adaptado)
De acordo com o texto, a massa atômica aproximada do ununséptio é
Dado: 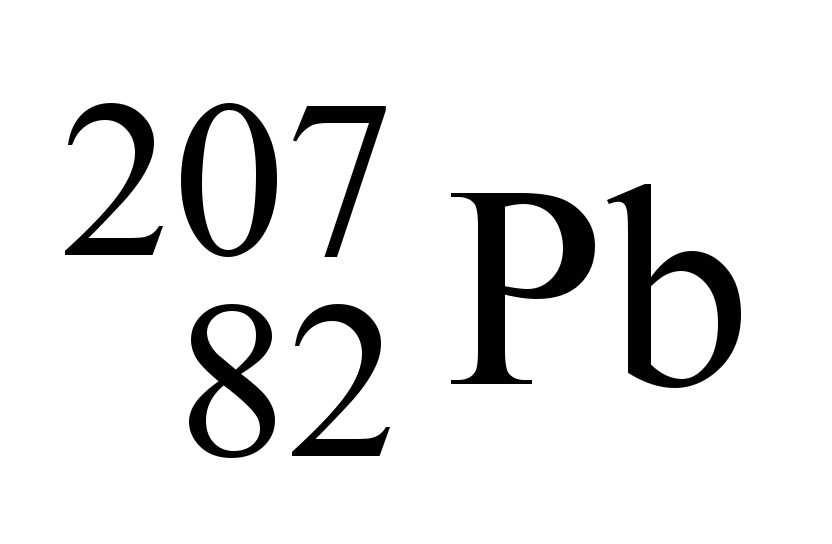
a) 294.
b)207.
c)166.
d)117.
e)42.
43 - (FM Petrópolis RJ/2013)
O iodo é um elemento importante da dieta humana, uma vez que é necessário para a produção dos hormônios tireoidianos. A falta de iodo na alimentação é uma das principais causas de hipotireoidismo. A atividade exacerbada da glândula tireoide causa o hipertireoidismo, que é tratado com a administração de iodo radioativo 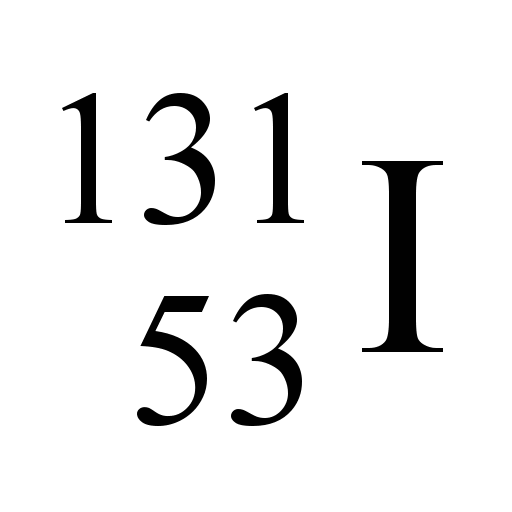 . Após a ingestão, o
. Após a ingestão, o 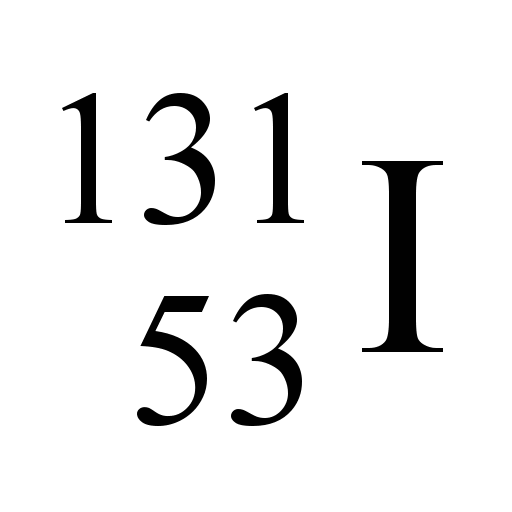 tende a se depositar na glândula tireoide, diminuindo a sua atividade excessiva e regularizando a sua função. Esse efeito é produzido pela capacidade de o iodo radioativo emitir partículas beta.
tende a se depositar na glândula tireoide, diminuindo a sua atividade excessiva e regularizando a sua função. Esse efeito é produzido pela capacidade de o iodo radioativo emitir partículas beta.
Sobre o iodo, o iodo radioativo e a função tireoidiana, considere as seguintes assertivas:
I. A suplementação do sal de cozinha com iodo reduziu os casos de bócio no Brasil.
II. A equação de emissão de uma partícula beta do 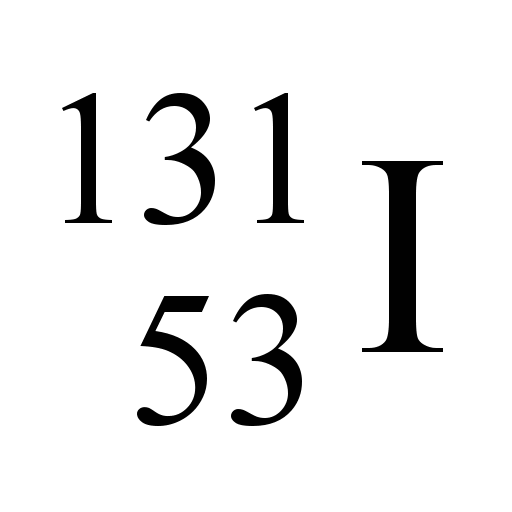 é
é 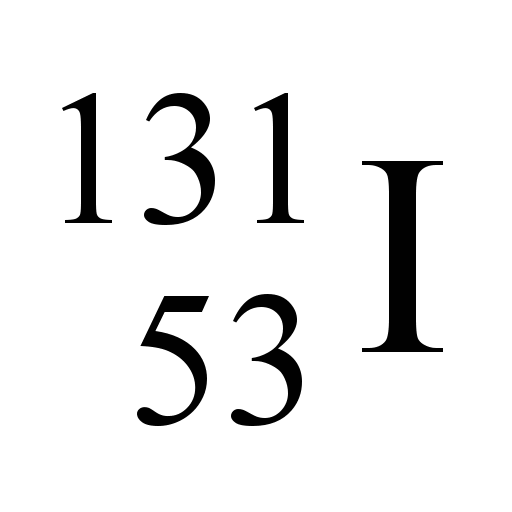 →
→ 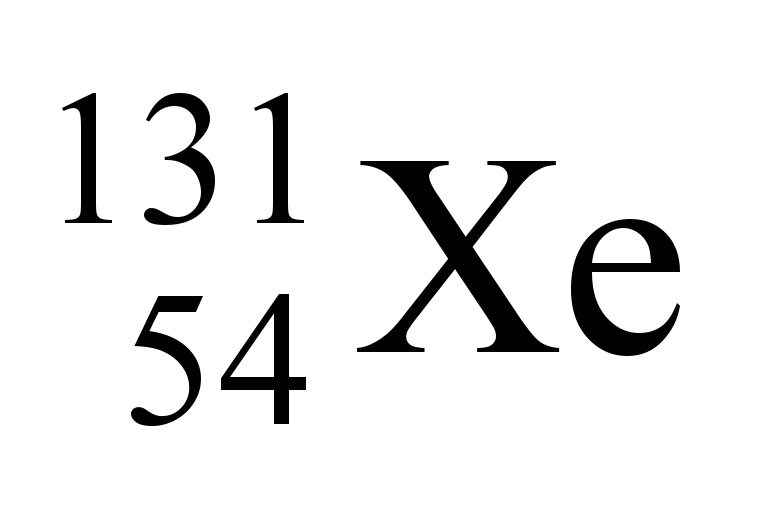 +
+ 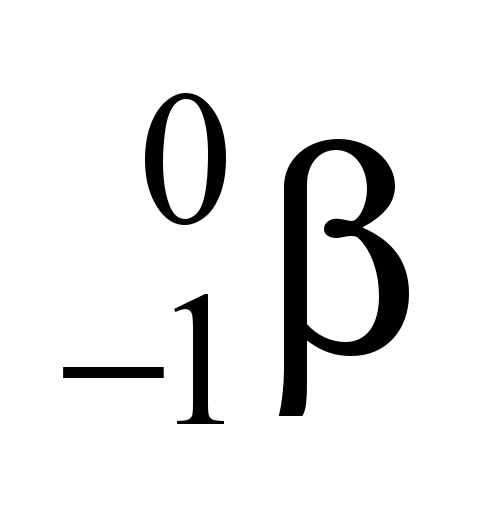 .
.
III. Em crianças, a falta de iodo causa retardo mental em uma síndrome conhecida como cretinismo.
IV. O iodo é um halogênio que é bastante encontrado na natureza sob a forma de íon iodeto (I–).
Está correto o que se afirma em
a)I e II, apenas. b)III e IV, apenas. c)I, II e III, apenas.
d)II, III e IV, apenas. e)I, II, III e IV.
44 - (UFSCAR SP/2013)
A radioterapia é um método capaz de destruir células tumorais, empregando feixe de radiações ionizantes. Os isótopos radioativos dos elementos cobalto, césio, irídio e outros são utilizados sob a forma de tubos, agulhas, fios, sementes ou placas e geram radiações, habitualmente do tipo gama, de diferentes energias, dependendo do elemento radioativo empregado. A reação nuclear envolvendo isótopos de cobalto é representada na equação:
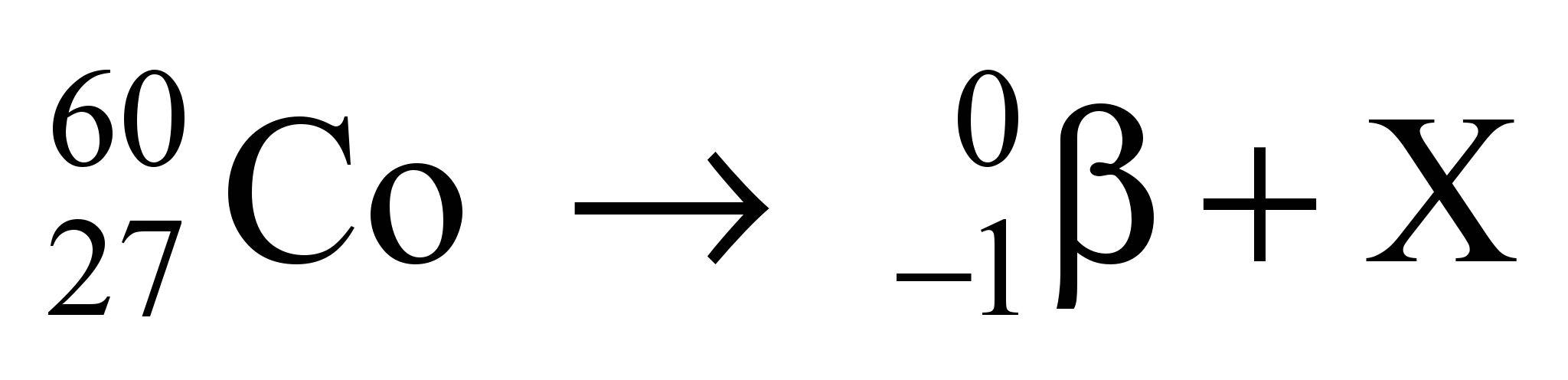
(www.inca.gov.br. Adaptado.)
Na equação, o número atômico do elemento X é
a)26.
b)27.
c)28.
d)59.
e)60.
45 - (FGV SP/2012)
A braquiterapia é uma modalidade de radioterapia, na qual pequenas cápsulas ou fios contendo as fontes radioativas são colocados em contato com o tecido tumoral a ser tratado. Cápsulas contendo ouro-198 são empregadas para essa finalidade, e cada átomo decai com a emissão de radiação gama e uma partícula beta, 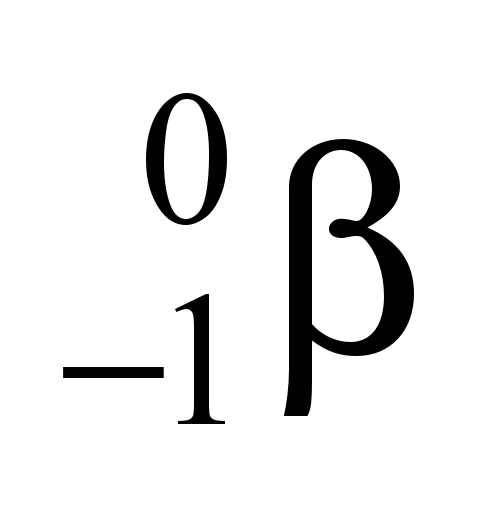 , que inibem o crescimento das células cancerígenas.( consultar uma tabela periódica).
, que inibem o crescimento das células cancerígenas.( consultar uma tabela periódica).
O produto do decaimento do ouro-198 é
a)ouro-197.
b)ouro-199.
c)platina-198.
d)mercúrio-197.
e)mercúrio-198.
46 - (UESPI)
O nuclídeo 131 do iodo (Z = 53), utilizado no diagnóstico de doenças da tireoide, pode ser obtido pelo bombardeio do nuclídeo 130 do telúrio (Z = 52), como representado a seguir:

Nessa reação, X corresponde a:
a)partícula alfa (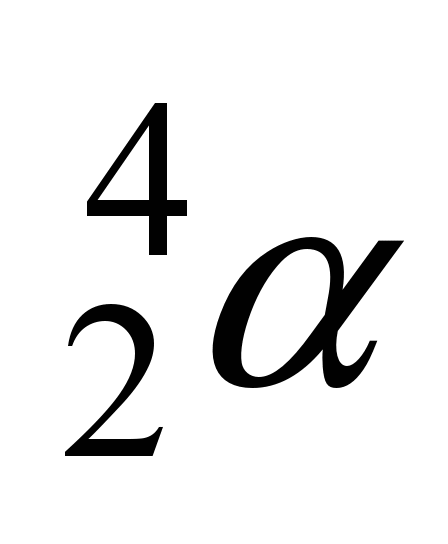 )
)
b)partícula beta (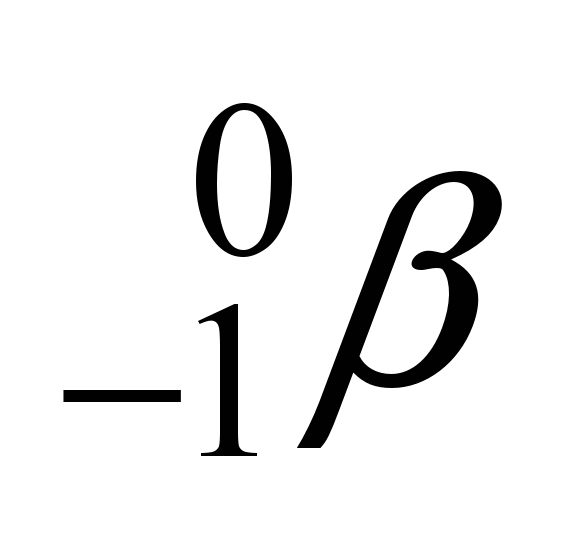 )
)
c)próton (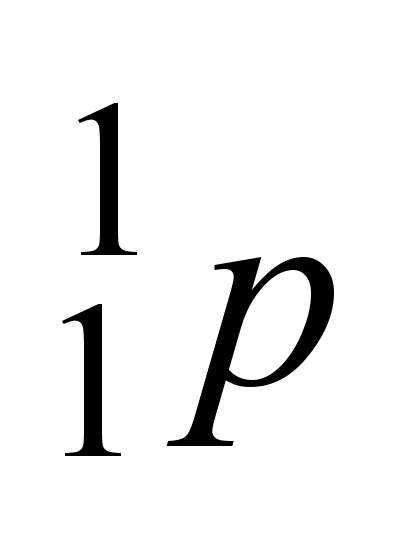 )
)
d)nêutron (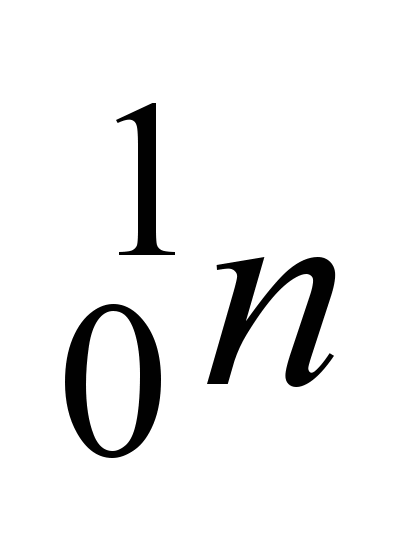 ) e) pósitron (
) e) pósitron ( )
)
47 - (PUC Camp SP)
A Era Atômica foi marcada por várias descobertas. Entre elas, a cisão do núcleo de urânio realizada pelos físicos alemães Otto Hahn e Fritz Strassman, em 22 de dezembro de 1922. A equação que representa esse processo é
U +  n →
n →  Ba +
Ba +  Kr + 3
Kr + 3 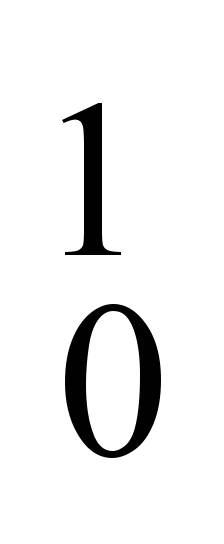 n
n
O número de nêutrons para o elemento urânio, nessa equação é
a)235
b)143
c)92
d)90
e)20
48 - (UNICAMP SP)
Eles estão de volta! Omar Mitta, vulgo Rango, e sua esposa Dina Mitta, vulgo Estrondosa, a dupla explosiva que já resolveu muitos mistérios utilizando o conhecimento químico (vestibular UNICAMP 2002). Hoje estão se preparando para celebrar uma data muito especial. Faça uma boa prova e tenha uma boa festa depois dela. Embora esta prova se apresente como uma narrativa ficcional, os itens a e b em cada questão de 1 a 12 devem, necessariamente, ser respondidos.
Para a sobremesa, os Mitta prepararam o “Arroz-doce à moda do Joaquim”. Dina explicava aos convidados: “Um dos segredos da receita é não deitar o açúcar logo no início porque ele é muito hidrofílico e compete com o amido do arroz pela água, e também porque a elevada pressão osmótica dificulta a entrada de água para o interior dos grãos, não deixando que eles cozinhem de forma uniforme e completa.” Como Dina estava a usar uma linguagem muito científica, um dos convidados logo fez duas perguntas:
a) “Ô Dina, o que significa hidrofílico e como se explica isso no caso do açúcar?”
b) “Ao fazer o arroz salgado, a gente põe o sal no início, e o arroz cozinha de maneira uniforme. Então, essa tal de pressão osmótica não existe no caso do sal? Por quê?”
49 - (UNESP SP/2013)
Alguns cheiros nos provocam fascínio e atração. Outros trazem recordações agradáveis, até mesmo de momentos da infância. Aromas podem causar sensação de bem-estar ou dar a impressão de que alguém está mais atraente. Os perfumes têm sua composição aromática distribuída em um modelo conhecido como pirâmide olfativa, dividida horizontalmente em três partes e caracterizada pelo termo nota. As notas de saída, constituídas por substâncias bem voláteis, dão a primeira impressão do perfume. As de coração demoram um pouco mais para serem sentidas. São as notas de fundo que permanecem mais tempo na pele.
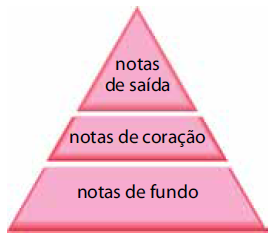
À temperatura e pressão ambientes, os constituintes químicos das notas de saída
a) são líquidos oleosos que aderem à pele por meio de ligações de hidrogênio.
b) evaporam mais rapidamente que os constituintes químicos das notas de coração e de fundo.
c) apresentam densidade mais elevada que os constituintes químicos das notas de coração e de fundo.
d) são gases cujas moléculas possuem elevada polaridade.
e) são pouco solúveis no ar atmosférico.
50 - (FGV SP/2014)
Deverá entrar em funcionamento em 2017, em Iperó, no interior de São Paulo, o Reator Multipropósito Brasileiro (RMB), que será destinado à produção de radioisótopos para radiofármacos e também para produção de fontes radioativas usadas pelo Brasil em larga escala nas áreas industrial e de pesquisas. Um exemplo da aplicação tecnológica de radioisótopos são sensores contendo fonte de amerício-241, obtido como produto de fissão. Ele decai para o radioisótopo neptúnio-237 e emite um feixe de radiação. Fontes de amerício-241 são usadas como indicadores de nível em tanques e fornos mesmo em ambiente de intenso calor, como ocorre no interior dos alto fornos da Companhia Siderúrgica Paulista (COSIPA).
A produção de combustível para os reatores nucleares de fissão envolve o processo de transformação do composto sólido UO2 ao composto gasoso UF6 por meio das etapas:
I. UO2 (s) + 4 HF (g) → UF4 (s) + 2 H2O (g) II. UF4 (s) + F2 (g) → UF6 (g)
No decaimento do amerício-241 a neptúnio-237, há emissão de
a)nêutron.
b)próton.
c)partícula alfa.
d)radiação beta.
e)pósitron.
51 - (FAMECA SP/2014)
A figura mostra um gerador de 99mTc (tecnécio-99 metaestável) produzido no Brasil pelo IPEN. Este radionuclídeo, utilizado na medicina nuclear, é produzido continuamente pelo decaimento do radionuclídeo “pai”, que é o 99Mo (molibdênio-99). O gráfico mostra uma atividade típica de 99Mo desses geradores, em função do tempo em dias.
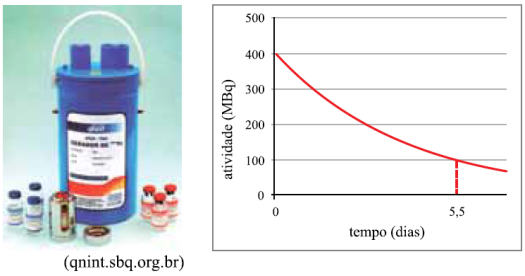
A partir do gráfico, pode-se concluir corretamente que a meia-vida do 99Mo, em horas, é
a)11.
b)5,5.
c)66.
d)44.
e)88.
52 - (FAMECA SP/2014)
Na equação nuclear referente ao decaimento do 99Mo, nuclídeo “pai”, para o 99mTc, nuclídeo “filho”, há liberação de
a)partículas alfa.
b)partículas beta negativas.
c)partículas beta positivas.
d)nêutrons.
e)prótons.
53 - (ESCS DF/2014)
As emissões radioativas são empregadas na radioterapia para destruir células doentes ou impedi-las de se reproduzirem. Em 1987, uma cápsula contendo cloreto de césio-137 foi abandonada junto a um equipamento nas antigas instalações do Instituto Goiano de Radioterapia, em Goiânia. A cápsula foi encontrada e aberta pelo dono de um ferro-velho, o que causou o maior acidente radioativo da história do Brasil.
Considere que o tempo de meia-vida do césio-137 seja igual a trinta anos e que, em 1987, havia 12,0 g do isótopo na cápsula aberta pelo dono do ferro-velho. Com base nessa situação, assinale a opção correta.
a) Após 90 anos da ocorrência do acidente, existirão ainda mais que 2,0 g de césio-137 remanescentes do material que havia na cápsula.
b) Para que mais de 99% do césio-137 que havia na cápsula em 1987 já tenha sofrido desintegração, será necessário o decurso de um período de tempo superior a 180 anos.
c) Atualmente, mais de 50% do césio-137 que havia na cápsula em 1987 já sofreu desintegração.
d) Desde a ocorrência do acidente, a cada ano que se passou, 0,40 g do césio-137 sofreu desintegração.
54 - (UNESP SP/2014)
Água coletada em Fukushima em 2013 revela radioatividade recorde
A empresa responsável pela operação da usina nuclear de Fukushima, Tokyo Electric Power (Tepco), informou que as amostras de água coletadas na central em julho de 2013 continham um nível recorde de radioatividade, cinco vezes maior que o detectado originalmente. A Tepco explicou que uma nova medição revelou que o líquido, coletado de um poço de observação entre os reatores 1 e 2 da fábrica, continha nível recorde do isótopo radioativo estrôncio-90.
O isótopo radioativo Sr-90 não existe na natureza, sua formação ocorre principalmente em virtude da desintegração do Br-90 resultante do processo de fissão do urânio e do plutônio em reatores nucleares ou em explosões de bombas atômicas. Observe a série radioativa, a partir do Br-90, até a formação do Sr-90:

A análise dos dados exibidos nessa série permite concluir que, nesse processo de desintegração, são emitidas
a)partículas alfa.
b)partículas alfa e partículas beta.
c)apenas radiações gama.
d)partículas alfa e nêutrons.
e)partículas beta.
GABARITO:
1) C 2) D 3) C 4) B 5) E 6) B 7) D
8) D 9) A 10) A 11) E 12) E 13) A 14) VFFV 15) E 16) D 17) D 18) B 19) D
20) D 21) A 22) A 23) a)»0,9% b)»4,4 gramas 24) C 25) E
26) a) x = 5,4g de ureia b)Como a concentração no meio salino é maior, o sapo irá perder água.
27) C 28) C 29) 0,2 mol/L 30) E 31) A 32) 90Th232 è 6 � � + 4 �
� + 4 �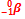 � + 82Pb208 33) D 34) C 35) A concentração das soluções são todas iguais. Portanto as soluções iônicas possuem o fator de correção e o produto µ.i será maior na solução de K2SO4 – 3 mols íons = i. Portanto 0,1 . 3 = 0,3 mol/L. Portanto a resposta correta é o K2SO4. 36) 150 anos
� + 82Pb208 33) D 34) C 35) A concentração das soluções são todas iguais. Portanto as soluções iônicas possuem o fator de correção e o produto µ.i será maior na solução de K2SO4 – 3 mols íons = i. Portanto 0,1 . 3 = 0,3 mol/L. Portanto a resposta correta é o K2SO4. 36) 150 anos
37) E 38) D 39) E 40) A 41) C 42) A 43) E 44) C 45) E
46) B 47) B
48) a)Hidrofílico significa o que tem afinidade com água. O açúcar é composto basicamente por sacarose, cujas moléculas possuem vários grupos hidroxila (–OH) que, através de ligações (pontes) de hidrogênio, se ligam às moléculas de água.
b)A pressão osmótica também existe quando o soluto é o sal, mas no caso do arroz salgado, pode-se colocar o sal no início e, mesmo assim, consegue-se uma cocção uniforme, porque a quantidade de NaCl adicionado é pequena quando comparada à quantidade de sacarose acrescentada ao arroz-doce.
49) B 50) C 51) C 52) B 53) B 54) E
RESOLUÇÃO COMENTADA
1-RESP:C
1º passo
Dica: Os efeitos coligativos, dependem apenas do número de partículas do soluto iônico ou molecular não volátil. Os compostos iônicos sofrem correção( fator de Vant’Hoff)= i
O número de partículas é dado por ɱ.i
ɱ = concentração molar.
I = fator de correção.
Obs. Os compostos moleculares não possuem o fator de correção, pois não dissociam ou ionizam.
2º passo
Agora vamos determinar o número de partículas para cada uma das soluções citadas utilizando o produto ɱ.i .
- NaCl ( cloreto de sódio) 0,1 mol/L = 0,2 mol/L
-C6H1O6 ( glicose) 0,15 mol/L = 0,15 mol/L
-k2SO4 ( sulfato de potássio) 0,1 mol/L = 0,3 mol/L
Concluímos que a curva I – glicose, curva II – cloreto de sódio e curva III – sulfato de potássio
2-RESP:D
1º passo
Composto molecular
C6H12O6 (s) C6H12O6 (aq)
1 mol 1 mol
Dica: Os efeitos coligativos, dependem apenas do número de partículas do soluto iônico ou molecular não volátil. Os compostos iônicos sofrem correção( fator de Vant’Hoff)= i
O número de partículas é dado por ɱ.i
ɱ = concentração molar.
I = fator de correção.
Obs. Os compostos moleculares não possuem o fator de correção, pois não dissociam ou ionizam.
2º passo
Agora vamos determinar o número de partículas para cada uma das soluções citadas utilizando o produto ɱ.i .
- CaCl2 ( cloreto de cálcio) 0,3 mol/L = 0,9 mol/L
-C6H12O6 ( glicose) 0,3 mol/L = 0,30 mol/L
-NaCl ( cloreto de sódio) 0,3 mol/L = 0,6 mol/L
Concluímos que a cloreto de cálcio é < que cloreto de sódio < glicose < água
3-RESP:C
A questão informa a meia-vida ( 30 anos) de uma espécie radioativa.
DICA : meia-vida é o tempo necessário para que a massa radioativa inicial se reduza a metade.
Temos:
A questão deseja determinar o tempo necessário para a massa radioativa cair para menos de 5% .
Portanto a massa inicial é igual a 100%.

4-RESP:B
A questão informa a meia-vida ( 2,7 dias) do ouro e deseja saber a massa após 10,8 dias.
Isto indica que são necessárias 4 meia-vida.
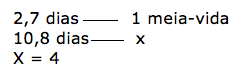
DICA : meia-vida é o tempo necessário para que a massa radioativa inicial se reduza a metade.
Temos:
Portanto a massa inicial é igual a 5,6 mg.

5-RESP:E
A questão informa a meia-vida ( 30 anos) do césio e deseja o tempo em anos para a massa cair para 0,15g de césio.
DICA : meia-vida é o tempo necessário para que a massa radioativa inicial se reduza a metade.
Temos:

6-RESP:B
DICA: quando um núcleo emite uma partícula beta, forma-se um novo núcleo com o mesmo número de massa e número atômico uma unidade maior.
Portanto:
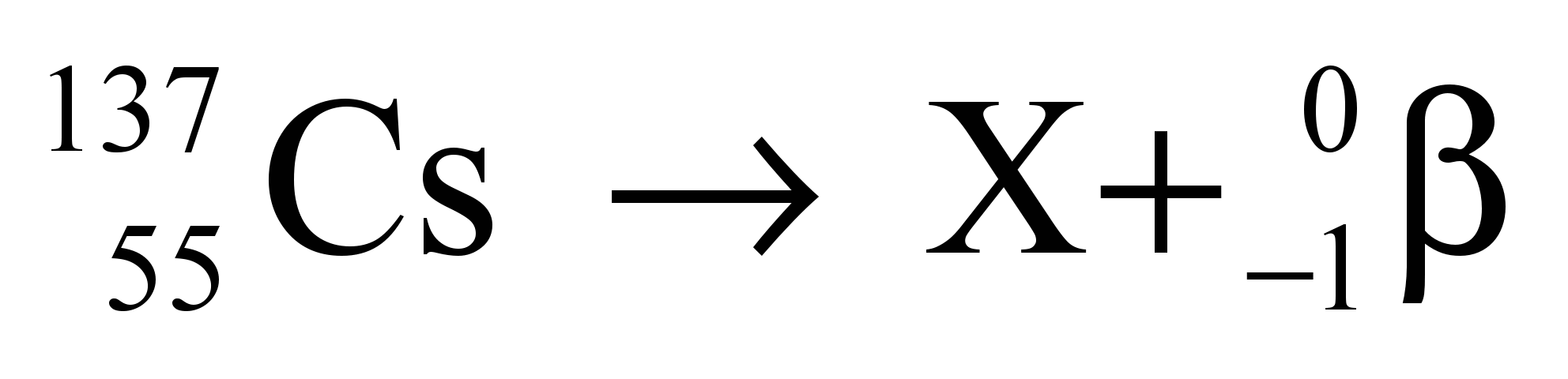 ⇒ �
⇒ � �
�
7-RESP:D
Emissão de pósitron = � �
�
8-RESP:D
Quando se adiciona um soluto não volátil em um líquido, aumenta o número de partículas, diminuindo a temperatura de congelamento. Este efeito coligativo denomina-se criometria.
9-RESP:A
Foram dadas as soluções de:
-cloreto de sódio ( NaCl) 0,1 mol/L.
-sacarose ( C12H22O11) 0,1 mol/L
-sulfato de potássio ( K2SO4) 0,1 mol/L
As soluções apresentam a mesma concentração.Porém temos que lembrar que as soluções iônicas possuem um comportamento diferente das soluções moleculares, pois as mesmas dissociam.
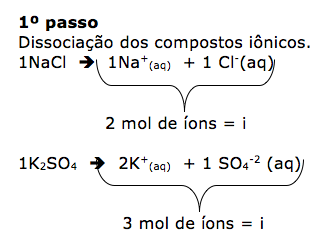
Dica: Os efeitos coligativos, dependem apenas do número de partículas do soluto iônico ou molecular não volátil. Os compostos iônicos sofrem correção( fator de Vant’Hoff)= i
O número de partículas é dado por ɱ.i
ɱ = concentração molar.
I = fator de correção.
Obs. Os compostos moleculares não possuem o fator de correção, pois não dissociam ou ionizam.
2º passo
Agora vamos determinar o número de partículas para cada uma das soluções citadas utilizando o produto ɱ.i .
- NaCl 0,1 mol/L = 0,2 mol/L
-C12H22O11 0,1 mol/L = 0,1 mol/L
-k2SO4 0,1 mol/L = 0,3 mol/L
3º passo
Concluímos que a solução com maior número de partículas é a de K2SO4 e a de menor número de partículas é a de C12H22O11

Portanto está incorreto o que se afirma na alternativa A, pois o número de partículas são diferentes, indicando que a temperatura de vaporização será diferente.
10-RESP:A
O que parece mágica é explicado pela presença de cloreto de sódio( NaCl) que é um composto iônico que dissocia fornecendo 2 mols de íons .
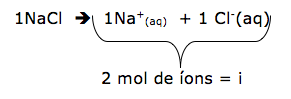
Para provocar o mesmo efeito, temos que utilizar um soluto que provoque o mesmo efeito, ou seja, tem o mesmo número de mols de íons.
Temos:
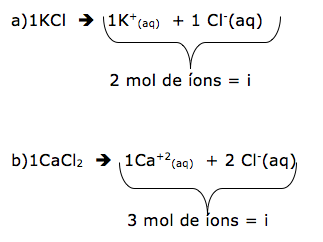
c)C6H12O6 não dissocia, pois é um composto molecular.
d)C3H8O3 não dissocia, pois é um composto molecular.
Encontramos o mesmo número de mols de íons no cloreto de potássio.
11-RESP:E
A medida que o solvente vai solidificando, vai aumentando a quantidade de soluto, fazendo com que a temperatura de congelamento diminui.
12-RESP:E
De acordo com o enunciado temos duas soluções A e B de mesmo soluto. Analisando a tabela notamos que a solução B possui o maior número de partículas, pois apresenta a maior temperatura de ebulição.
I – VERDADEIRA
As soluções apresentam menor pressão de vapor que á água pura, pois apresentam partículas.
II – VERDADEIRA
A solução A possui menor número de partículas em relação a B.
III – VERDADEIRA
As forças de interação molecular são mais “fortes” em B, ou seja, mais difícil de ser rompidas.
13-RESP:A
Quanto maior o número de partículas, maior será a temperatura de ebulição.
Notamos que o volume e o número de mols é igual para todas as soluções, exceto o volume da solução de glicose(C6H12O6).
Podemos eliminar as alternativas com sacarose ( C12H22O11), etanol (C2H5OH) e a glicose, pois os mesmos são moleculares e não dissocia e os efeitos coligativos dependem apenas do número de partículas.
Já a solução de cloreto de sódio ( NaCl) é iônica e dissocia.
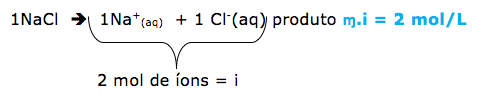
14-RESP:VFFV
I – verdadeiro
Adicionando soluto (sacarose) vai aumentar o número de partículas na água do mar, diminuindo a sua pressão de vapor.
II- Falso
Com adição de soluto, o ponto de congelamento diminui.
III- Falso
A condutividade elétrica é devido a presença de íons livres. Portanto adição de sacarose que é um composto molecular, não haverá aumento na concentração de íons.
IV- Verdadeiro
A concentração de íons permanece a mesma, pois a sacarose é molecular.
15-RESP:E
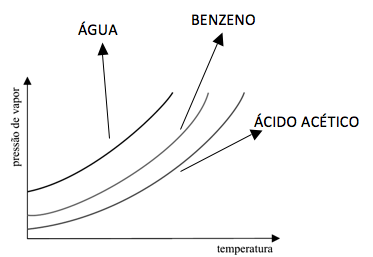
O ácido acético possui o maior número de partículas, maior temperatura de ebulição e as forças intermoleculares são mais intensas.
16-RESP:D
A questão fornece água pura( Te = 100ºC), temperatura menor que uma solução de glicose ( molecular) de concentração igual a 3 mol/L e cloreto de cálcio 1,0 mol/L ( CaCl2) composto iônico que dissocia e possui o fator de correção ( i ).
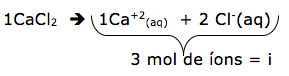
Portanto o produto ɱ.i = 3 mol/L.
Isto indica que a glicose e o cloreto de cálcio possui o mesmo número de partículas, consequentemente a mesma temperatura de ebulição
17-RESP:D
Quanto menor a temperatura de ebulição de um líquido, mais volátil ele se torna.
18-RESP:B
A pressão osmótica é calculada pela expressão:
π = ɱ.R.T.i
Substituindo os valores temos na equação temos:
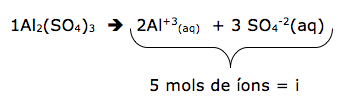
π = ɱ.R.T.i
π = 0,4.0,082.300.5
π =49,2 atm
19-RESP:D
A questão fornece os dados da glicose
C = 10 g/L , T = 15ºC
1º Passo
Transformar a concentração em mol/L e a temperatura em Kelvin.
C6H12O6 = 180 g/mol

Obs. Não utilizamos o fator i, porque a solução é molecular
20-RESP:D
Soluções isotônicas são aquelas que possuem a mesma pressão osmótica.
Para resolver esta questão, vamos precisar utilizar o produto ɱ.i para as soluções iônicas
produto ɱ.i = 0,15 x 2 = 0,3 mol/L
Glicerina = 0,2 mol/L
Uréia = 1,2 g/L = 0,02 mol/L
Observando as concentrações, notamos que tem o mesmo número de partículas a glicerina e o nitrato de potássio. Portanto são isotônicas
21-RESP:A
Segundo o texto, as soluções isotônicas possuem o mesmo número de partículas. Sabendo que a glicose é molecular e a concentração é 0,2 mol/L, menor que a do nitrato de cálcio que tem o fator i, já podemos eliminar esta alternativa.
Os outros solutos são iônicos, portanto dissociam e temos que utilizar o produto ɱ.i

22-RESP:A
Temos
C6H12O6 = 0,3 mol/L ( molecular ).
23-RESP a) 0,9% b) 4,4 g
a) Vamos calcular a concentração molar e logo em seguida calcular a porcentagem em massa.

24-RESP:C
Nesta questão, a resolução é mais “rápida” utilizando a fórmula, pois a questão fornece dados suficientes.
Temos:
M = 684 mg = 0,684 g
V = 0,01L
= 0,31 atm
T = 310 K
R = 0,082 L atm mol-1 K-1

25-RESP:E
A questão indica que são duas soluções isotônicas. Portanto uma solução de glicose molecular e uma solução de cloreto de cálcio que é iônica e possui o fator de correção ( i ).
1º passo
Transformar a concentração comum da glicose em concentração molar.
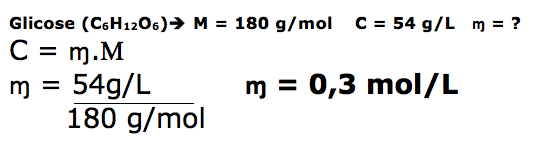
2º passo
Dissociação do cloreto de cálcio

Dica: a questão pede para calcular a concentração dos íons, portanto a concentração 0,1 mol/L corresponde ao CaCl2.
Obs. A concentração molar dos íons obedece uma proporção.
26-RESP: a) 5,4g
b) Como a concentração no meio salino é maior, o sapo irá perder água.
1º Passo
Para obter o mesmo efeito, será necessário o mesmo número de partículas ( cloreto de sódio e de uréia ).
Primeiro vamos calcular a concentração molar de cloreto de sódio.
Obs. O NaCl é iônico, portanto dissocia e temos o produto ɱ.i

produto ɱ.i = 0,449 x 2 = 0,899 mol/L partículas de NaCl
2º Passo
Agora vamos calcular para a uréia (H2N-CO-NH2).

Obs: utilizamos o número 0,889 mol, porque é o número de partículas que devemos ter de cada soluto para ter o mesmo efeito coligativo.
b) Portanto no processo de osmose, ocorre a passagem do solvente do meio diluído para o meio concentrado. Como o meio salino é mais concentrado, o sapo irá perde água.
27-RESP:C
A questão fornece dados suficiente para a utilização direta da fórmula.
28-RESP:C
Temos:
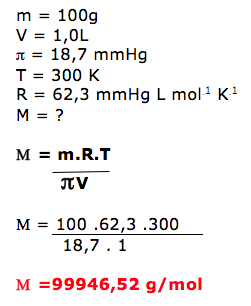
29-Resolução na questão 25
30-RESP:E
De acordo com os dados.
Temos:
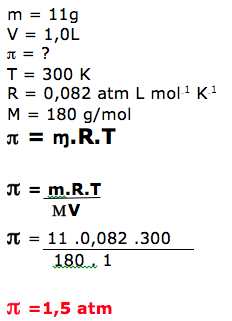
31-RESP:A
A questão refere-se aos efeitos provocados por um soluto não volátil.
Ao adicionar cloreto de sódio ( NaCl ) que é um soluto iônico, o mesmo provoca uma diminuição na pressão de vapor, um aumento na temperatura de ebulição e diminuição na temperatura de congelamento do líquido.
Encontramos essas condições na alternativa A
32-Resolução
Esta questão refere-se a radioatividade ( reação de desintegração nuclear).
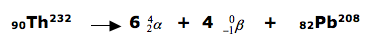
DICA: antes da seta( reagentes) temos uma massa igual a 232, portanto após a seta(nos produtos) a soma tem que ser igual a 232. Este processo é válido também para o número atômico ( parte de baixo).
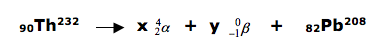
Sabendo que beta não possui massa, concluímos que a massa total será 208 mais x partículas alfa.
232 = x(4) + 208
232 = 4x + 208
-4x = 208 – 232
4x = 24
X = 6
Para determinar o valor de beta, vamos substituir na fórmula.
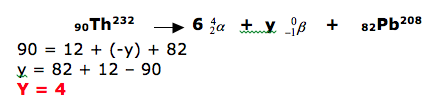
33-RESP:D
A questão refere-se aos efeitos provocados por um soluto não volátil.
Ao adicionar um soluto em um líquido, o mesmo provoca uma diminuição na pressão de vapor, um aumento na temperatura de ebulição e diminuição na temperatura de congelamento deste líquido.
De acordo com o enunciado:
Solução(I) A : possui menor número de partículas, maior pressão de vapor, menor temperatura de ebulição e maior ponto de congelamento.
Solução (II) B : Em relação a solução A possui maior número de partículas , menor pressão de vapor, maior temperatura de ebulição e menor ponto de congelamento.
Solução (III) C : Em relação a solução A e B possui maior número de partículas , menor pressão de vapor, maior temperatura de ebulição e menor ponto de congelamento.
Temos como correta a alternativa D
34-RESP:C
Os lagos de água salgada, possuem menor pressão de vapor, ou seja, quanto maior o número de partículas mais acentuado é este efeito ( efeito tonoscópico ).
35-Resolução
A concentração das soluções são todas iguais. Portanto as soluções iônicas possuem o fator de correção e o produto µ.i será maior na solução de K2SO4 – 3 mols íons = i. Portanto 0,1 . 3 = 0,3 mol/L. Portanto a resposta correta é o K2SO4.
Dica : cálculo do fator de correção ( i ), foi demonstrado na resolução da questão 17.
36-Resolução
A questão informa a meia-vida do césio ( 30 anos).
DICA : meia-vida é o tempo necessário para que a massa radioativa inicial se reduza a metade.
Temos:
A questão deseja determinar o tempo necessário para a massa radioativa cair para 3,125%.
Portanto a massa inicial é igual a 100%.

37-RESP: E
ISÓTOPO: elemento químico que possui o mesmo número atômico.
Consultando uma tabela encontramos:
86Rn222 A = P + N
N = 222 – 86
N = 136 nêutrons
38-RESP: D

39-RESP: E

40-RESP: E
A resolução é a mesma da questão 36
41- RESP: C
A questão fala sobre o ítrio-90 que é um radioisótopo que tem sido cada vez mais utilizado no tratamento de tumores, e apresenta meia-vida de 64 horas.

Segundo o gráfico foram decorridos 8 dias = 192 horas( o dia tem 24 horas).
A meia-vida é de 64 horas. Portanto temos que 192 horas = 3 meia-vida.
50 MBq -------------- 100 MBq --------------200 MBq ---------------400 MBq
(T = 8 dias ) ( t = 0 dias)
42- RESP: A
A questão indica no enunciado que a massa do elemento formado é 42% mais pesado que o átomo de chumbo.

43- RESP: E
I – correta.
II- correta
III- correta
IV – correta
44- RESP: C
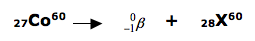
DICA: quando um núcleo emite uma partícula beta, forma-se um novo núcleo com o mesmo número de massa e número atômico uma unidade maior.
45- RESP: E
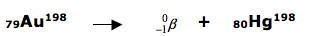
Obs: A radiação gama não possui massa e não possui carga.
46- RESP: B
Para balancear esta equação, precisamos de uma partícula que não possui massa e carga igual a -1. Concluímos que esta partícula é beta (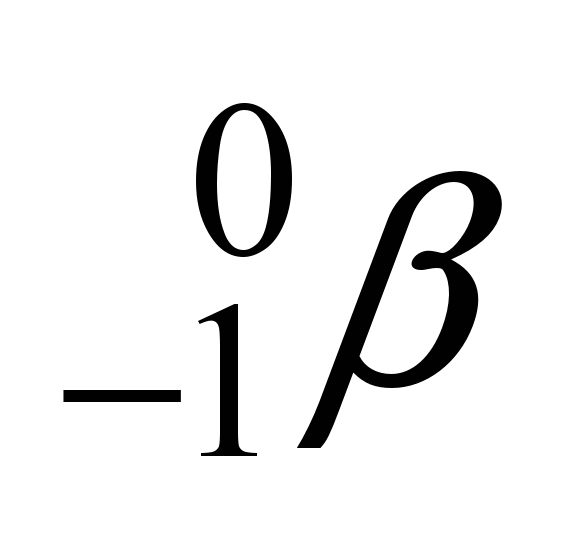 ).
).

47- RESP: B

48- Resolução
a)Hidrofílico significa o que tem afinidade com água. O açúcar é composto basicamente por sacarose, cujas moléculas possuem vários grupos hidroxila (–OH) que, através de ligações (pontes) de hidrogênio, se ligam às moléculas de água.
b)A pressão osmótica também existe quando o soluto é o sal, mas no caso do arroz salgado, pode-se colocar o sal no início e, mesmo assim, consegue-se uma cocção uniforme, porque a quantidade de NaCl adicionado é pequena quando comparada à quantidade de sacarose acrescentada ao arroz-doce.
49- RESP: B
De acordo com o enunciado, as notas de saída são voláteis, portanto apresentam baixa temperatura de ebulição, ou seja, evaporam facilmente.
50- RESP: C

Na emissão de partícula alfa, o número de massa do elemento formado diminui 4 unidades e o número atômico diminui 2 unidades.
51- RESP: C

52- RESP: B

53- RESP: B
Dados da questão.
Meia-vida = 30 anos
Para ocorrer à desintegração de mais de 99% do elemento radioativo, será necessário 180 anos.
Após 99%, teremos apenas 0,12 g.
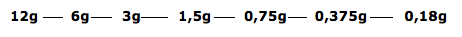
Após seis períodos, teremos 180 anos, indicando que após este tempo, terá desintegrado mais de 99%.
54- RESP: E

Notamos que na reação de desintegração, a massa não sofre alteração e o número atômico vai aumentando em uma unidade. Portanto a partícula utilizada foi a beta (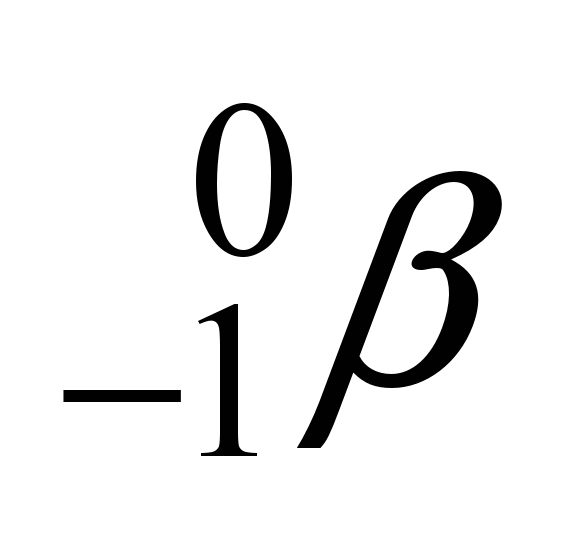 )
)
![]() 10–5.
10–5.![]() 10–5.
10–5.![]() 10–3.
10–3.![]() 105.
105.![]() 105.
105.![]() L–1 foram misturados a 300 mL de uma solução aquosa de hidróxido de sódio de concentração igual a 2 mol
L–1 foram misturados a 300 mL de uma solução aquosa de hidróxido de sódio de concentração igual a 2 mol![]() L–1. Após o final do processo químico ocorrido, é correto afirmar que
L–1. Após o final do processo químico ocorrido, é correto afirmar que![]() L–1.
L–1.![]() L–1.
L–1.![]() L–1.
L–1.![]() L–1.
L–1.![]() 10–3.
10–3.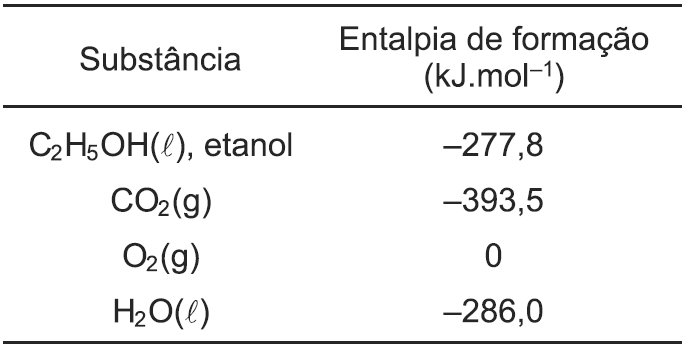

![]() mL–1, apresenta 70% em massa de soluto. Calcule a concentração, expressa em mol por litro, para essa solução.
mL–1, apresenta 70% em massa de soluto. Calcule a concentração, expressa em mol por litro, para essa solução. ![]() Na+ + CH3COO– + H2O
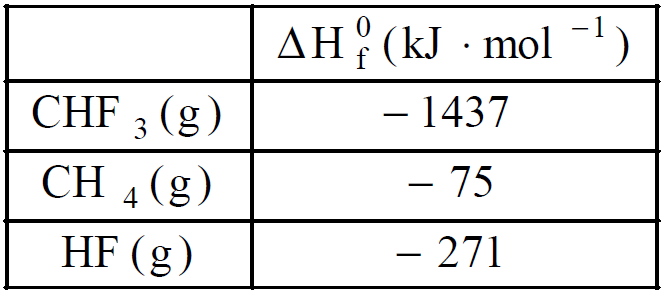
Na+ + CH3COO– + H2O![]() CHF3(g) + HF(g).
CHF3(g) + HF(g).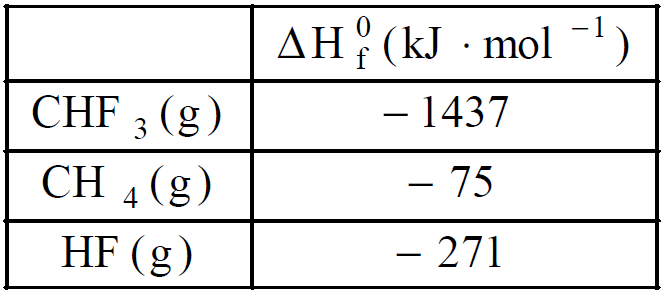

![]()
![]()
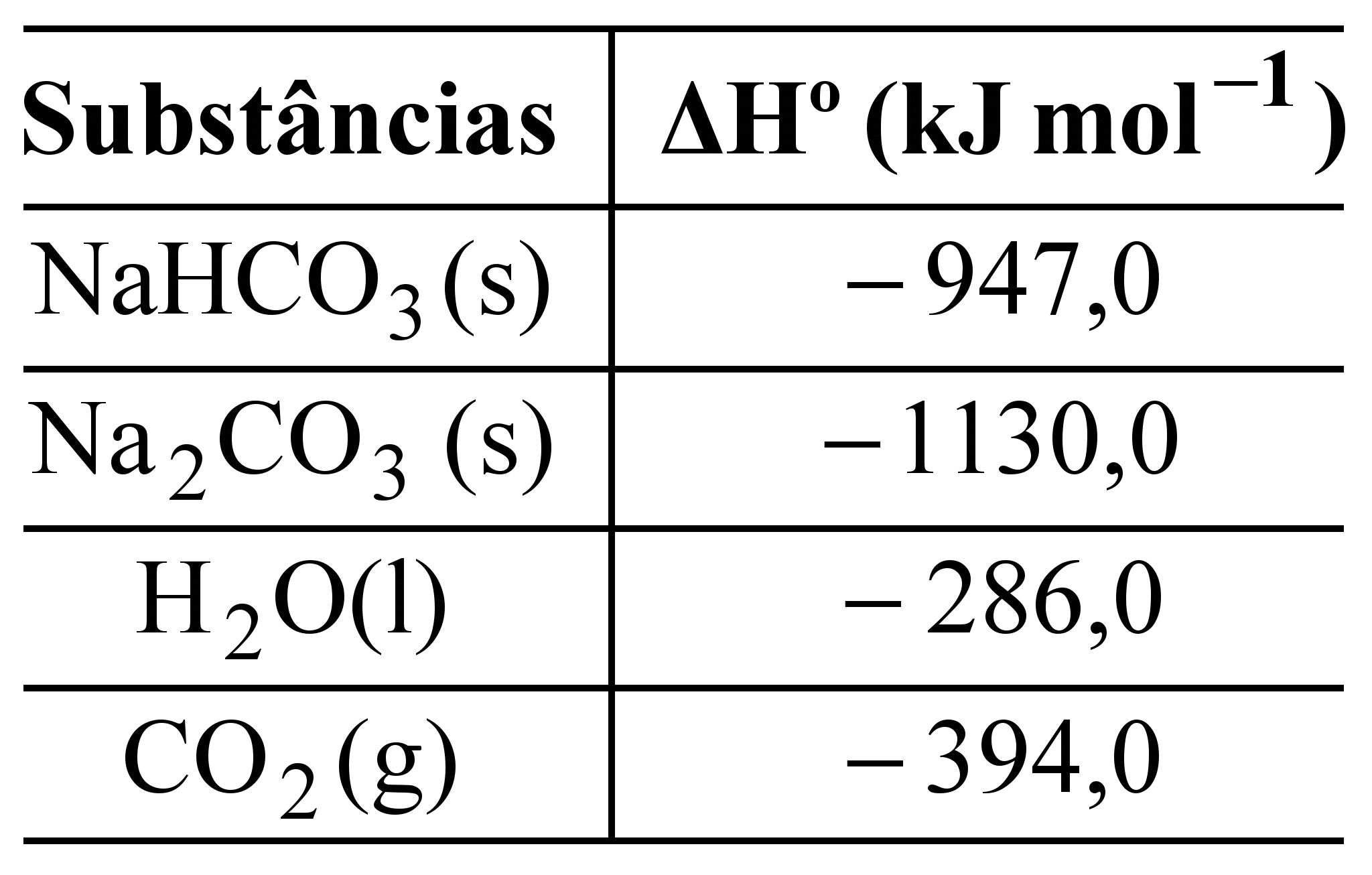
![]() Na2CO3(s) + H2O(l) + CO2 (g).
Na2CO3(s) + H2O(l) + CO2 (g).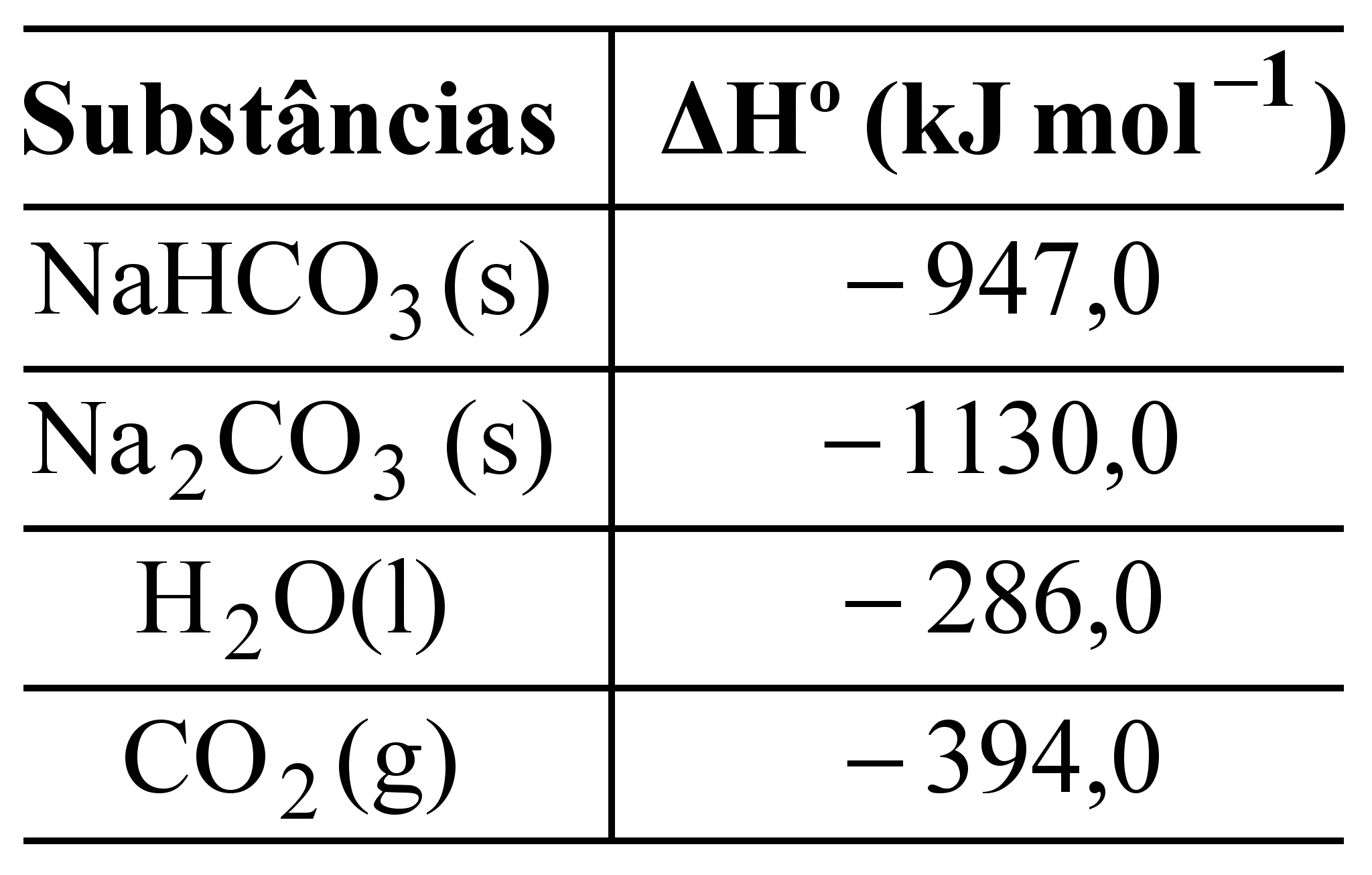



































































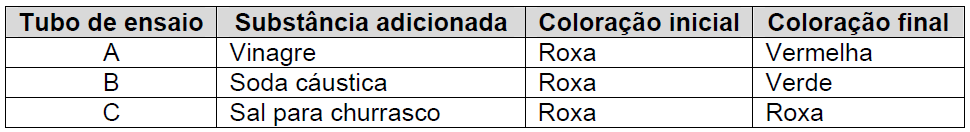
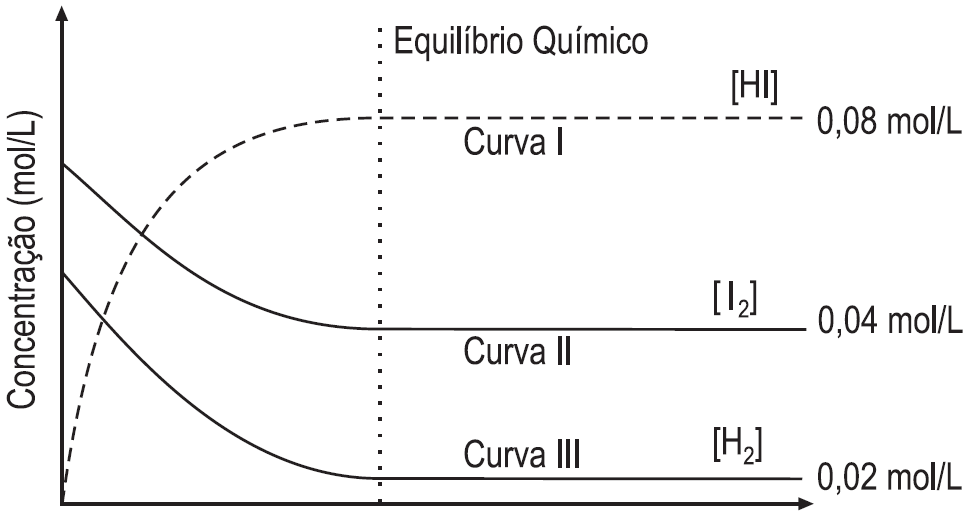
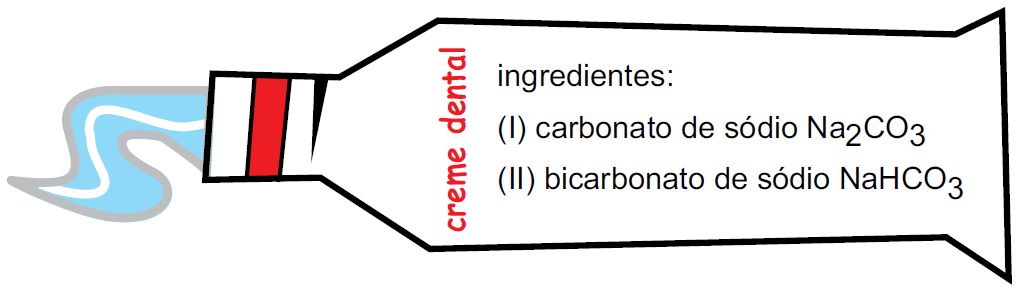
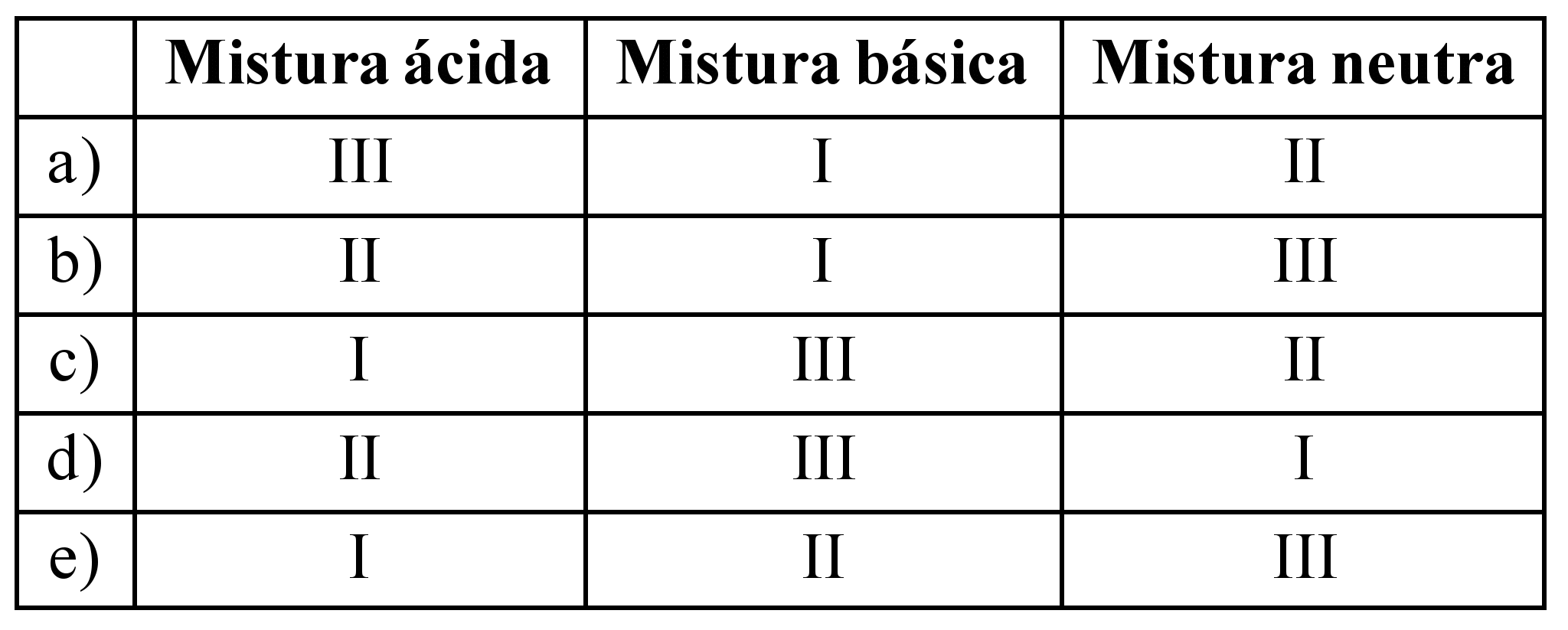


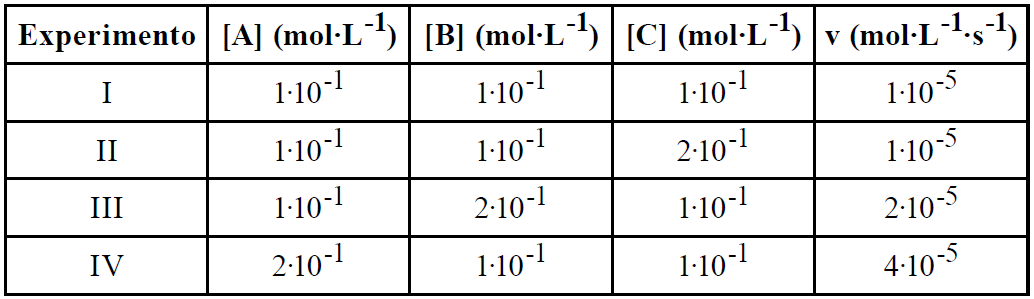

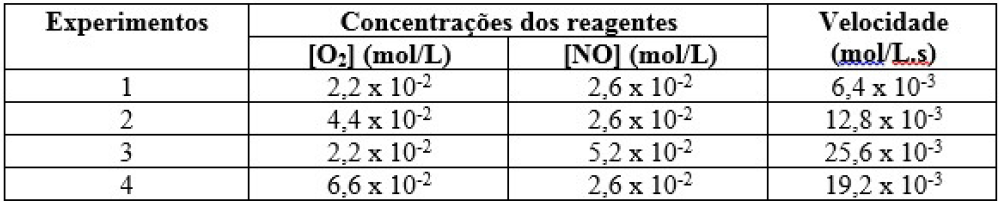




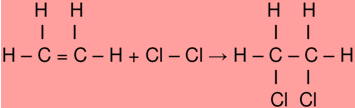

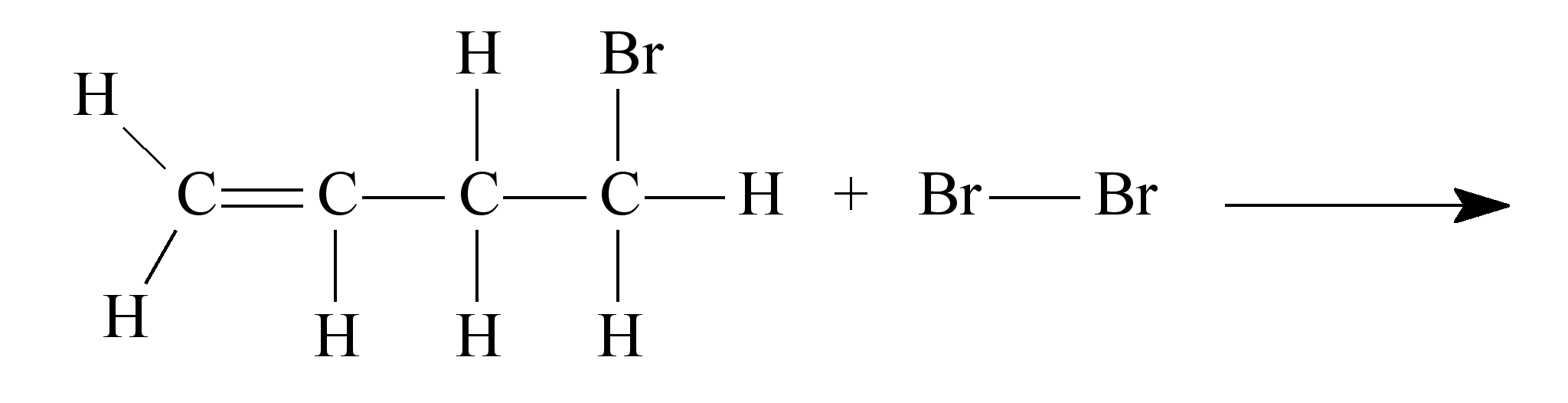
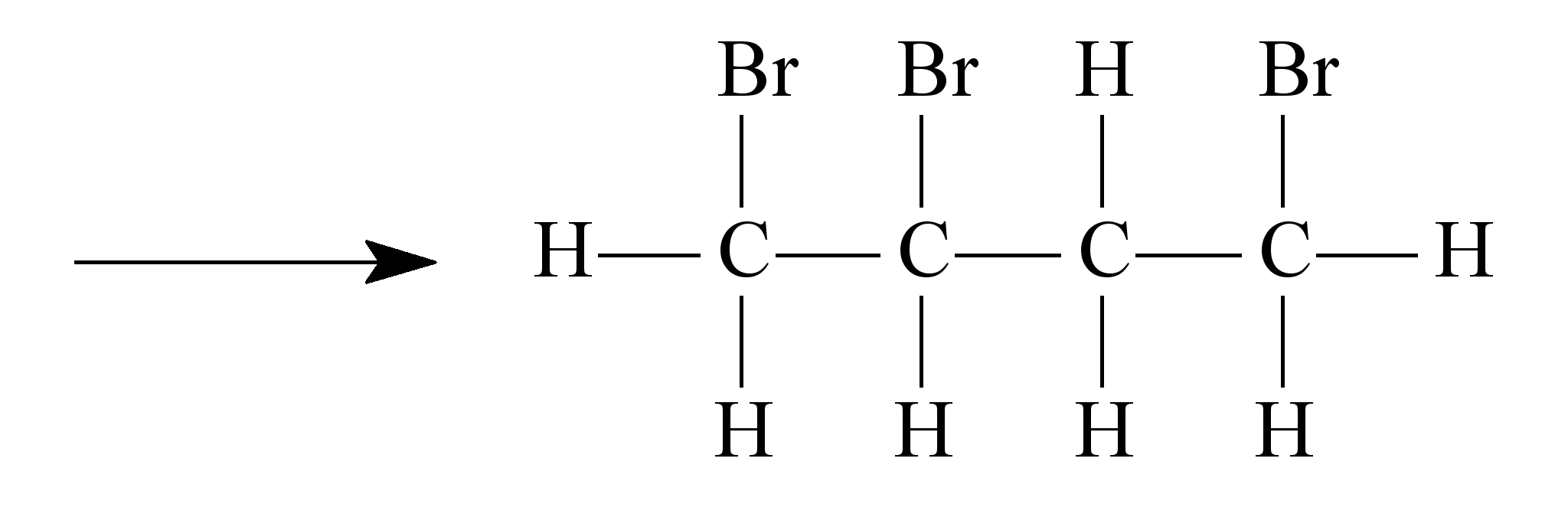



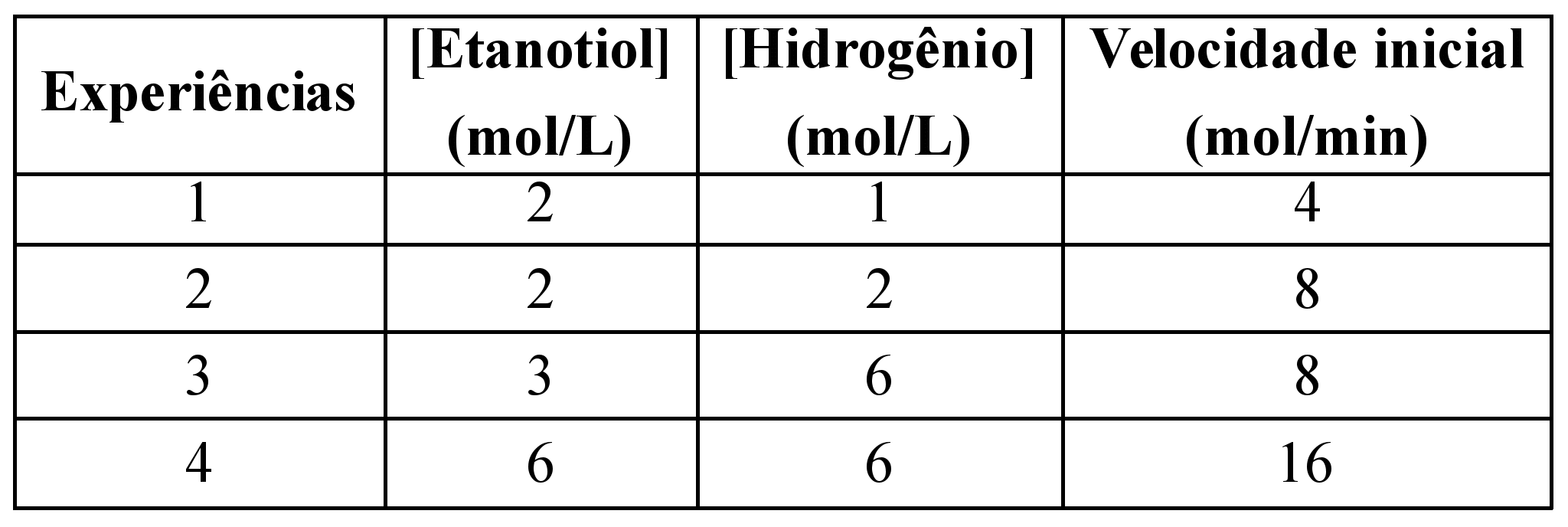



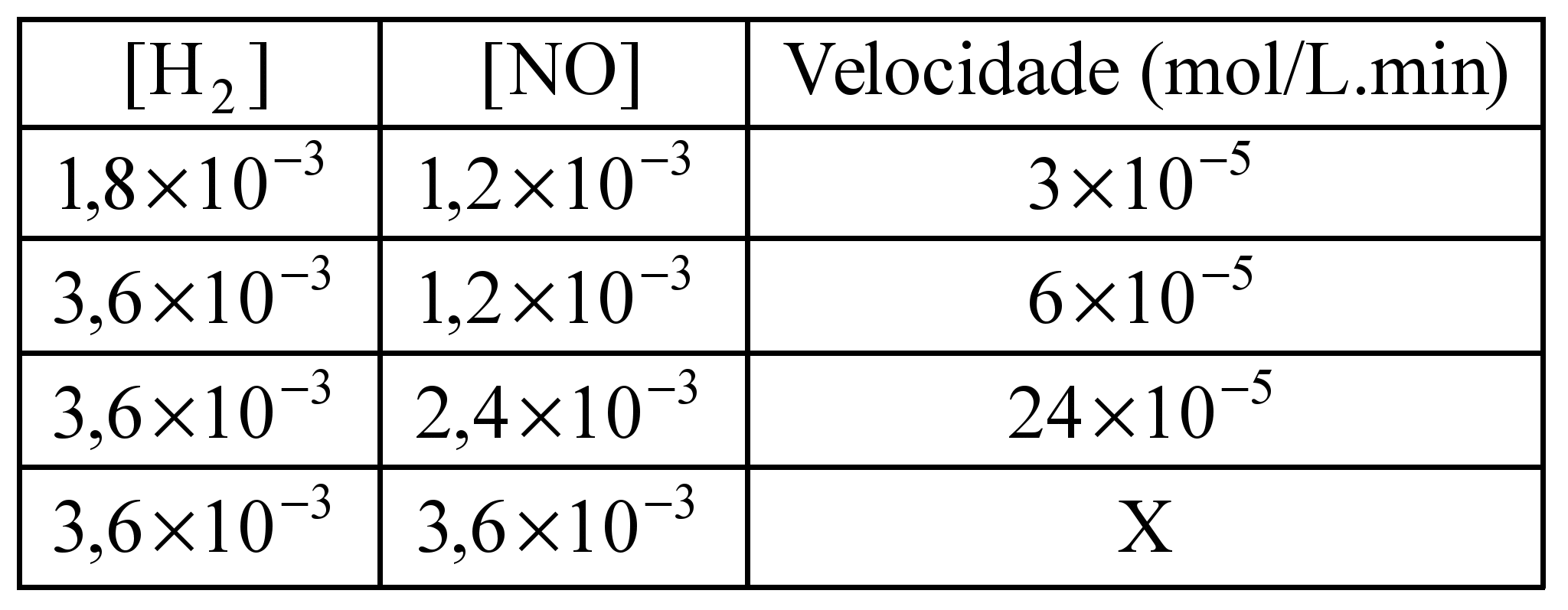
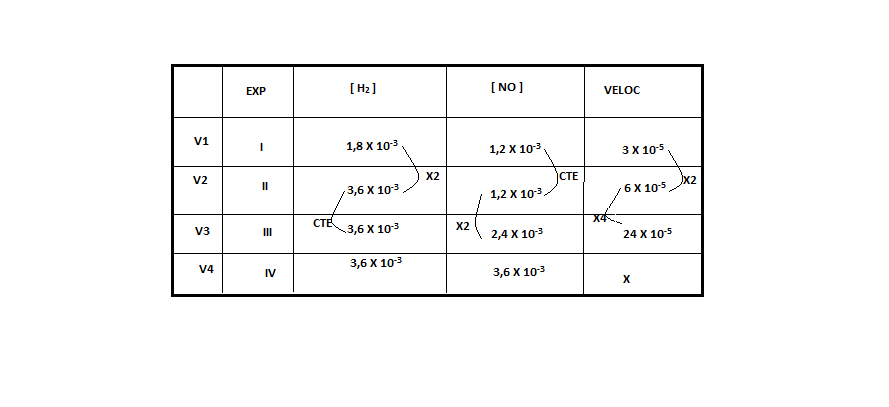


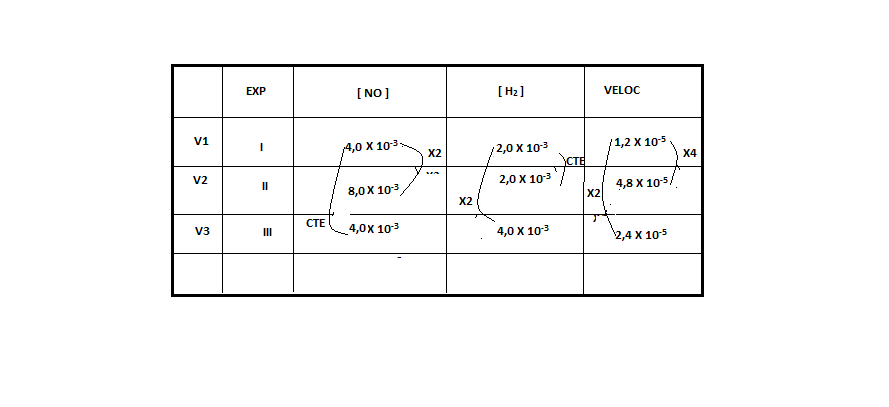


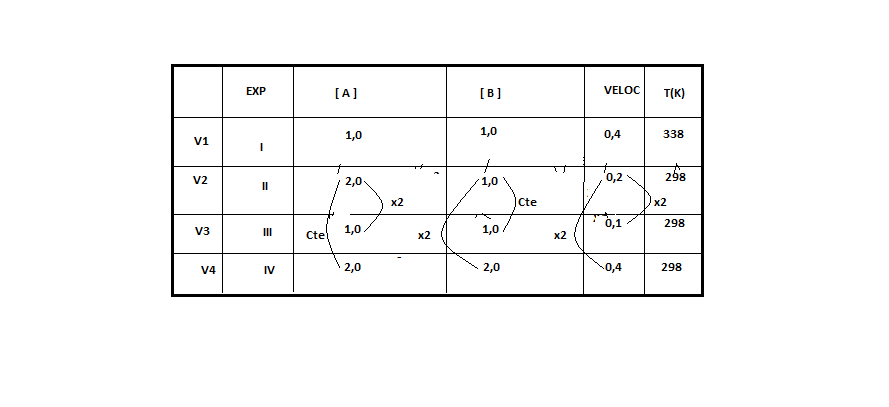


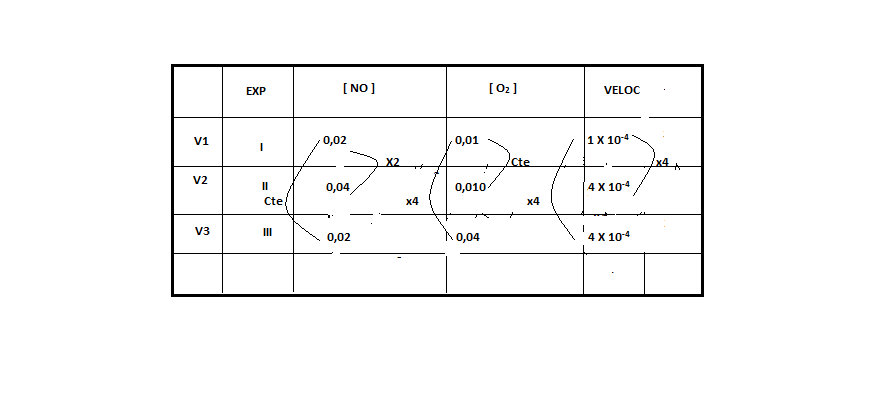


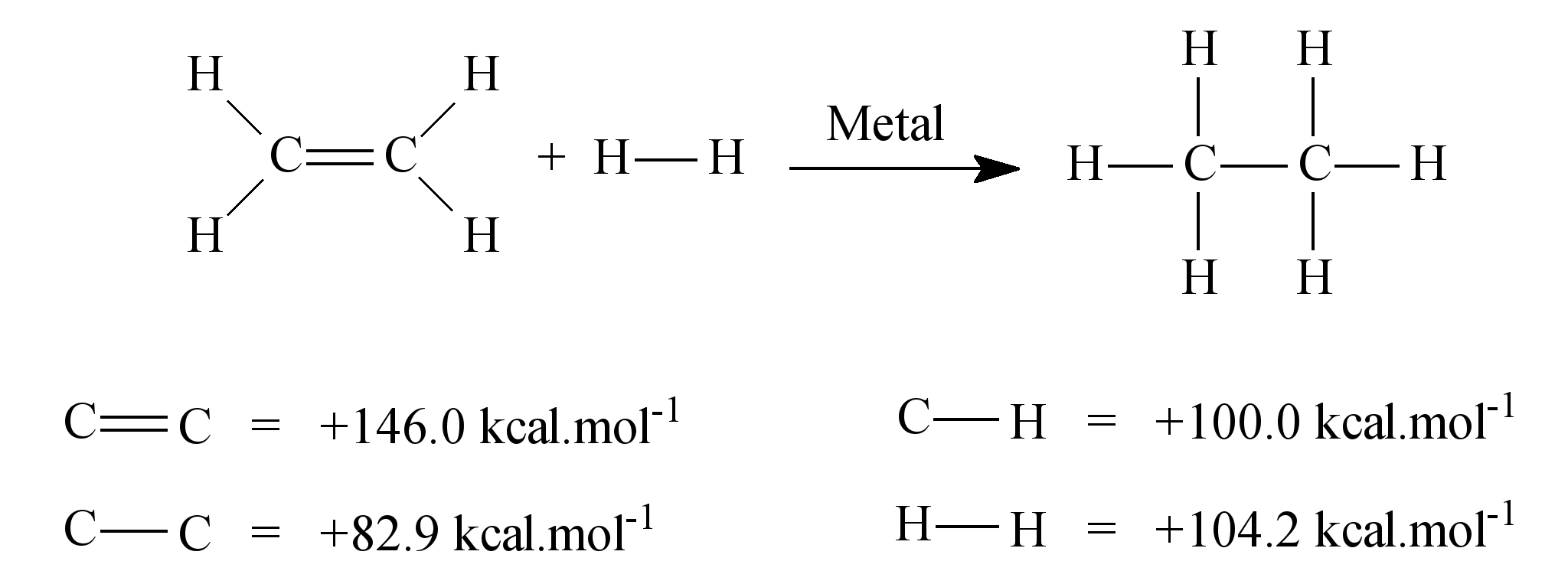

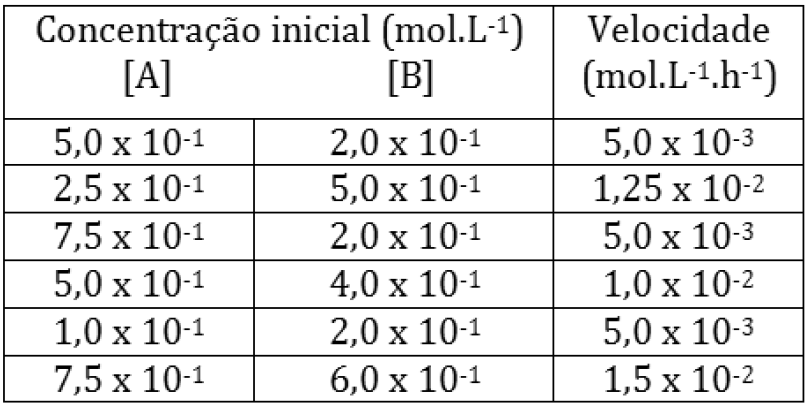
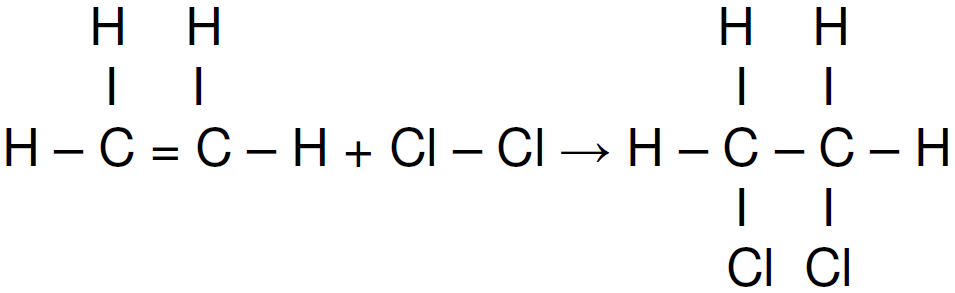
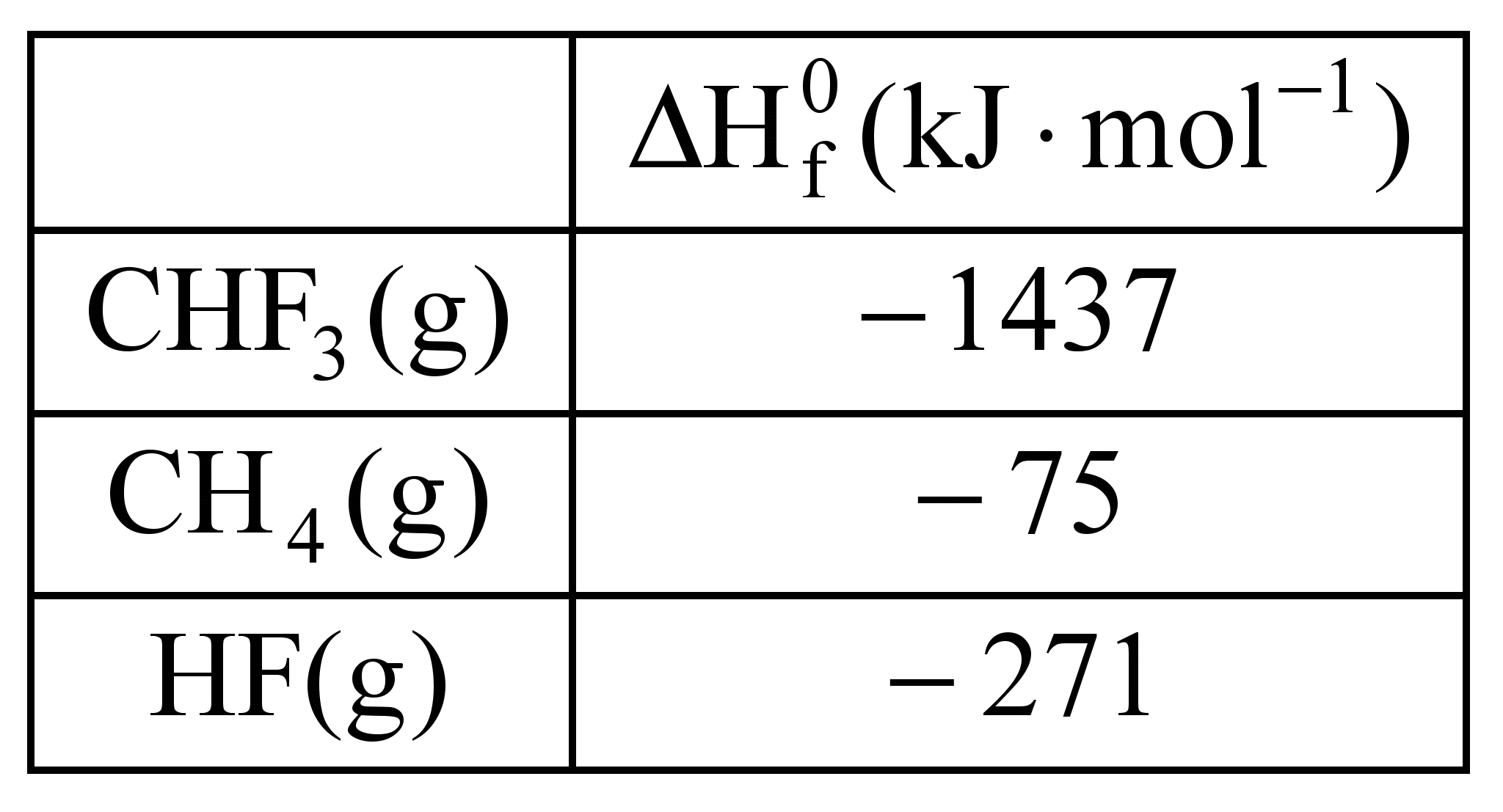
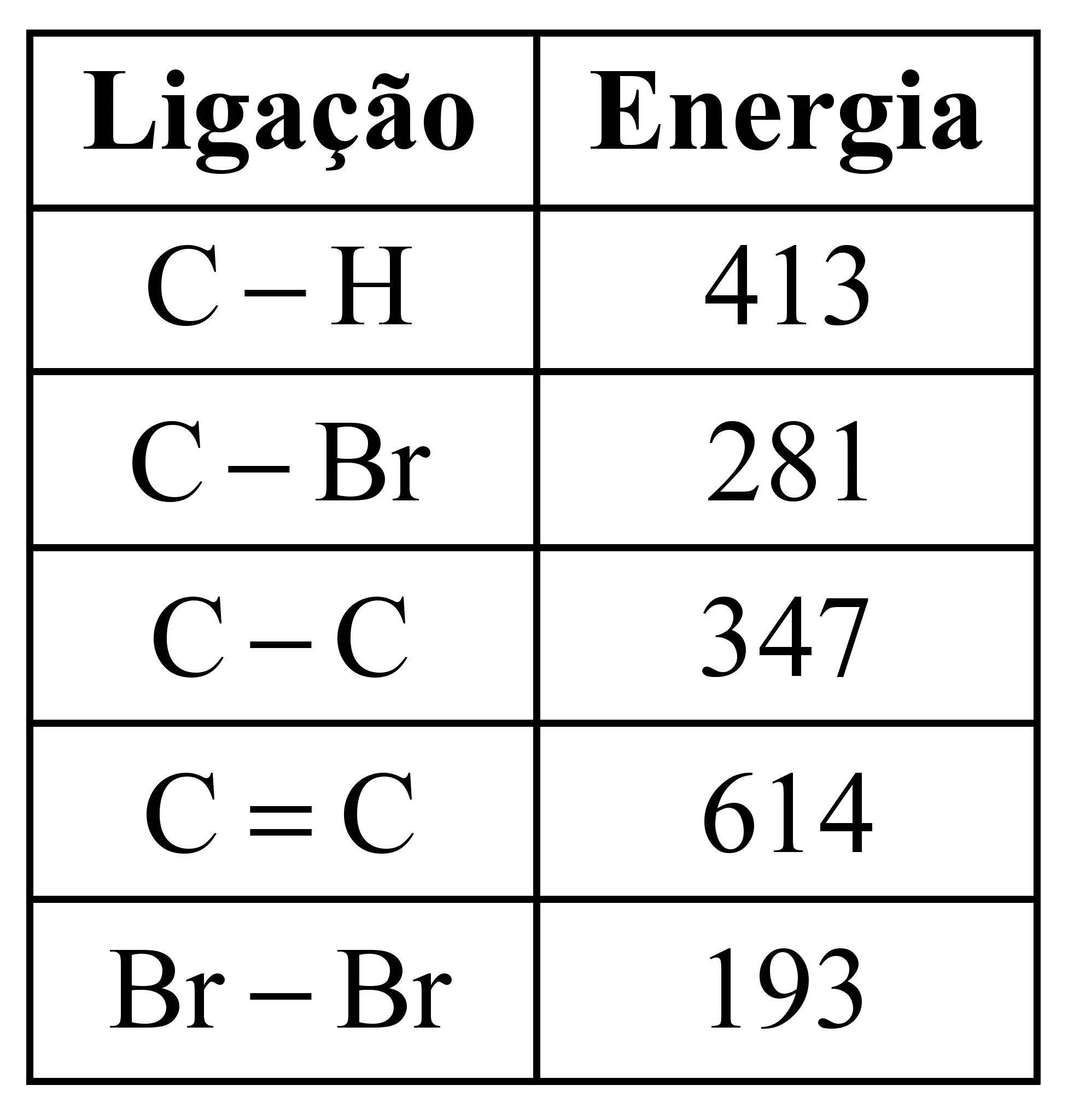


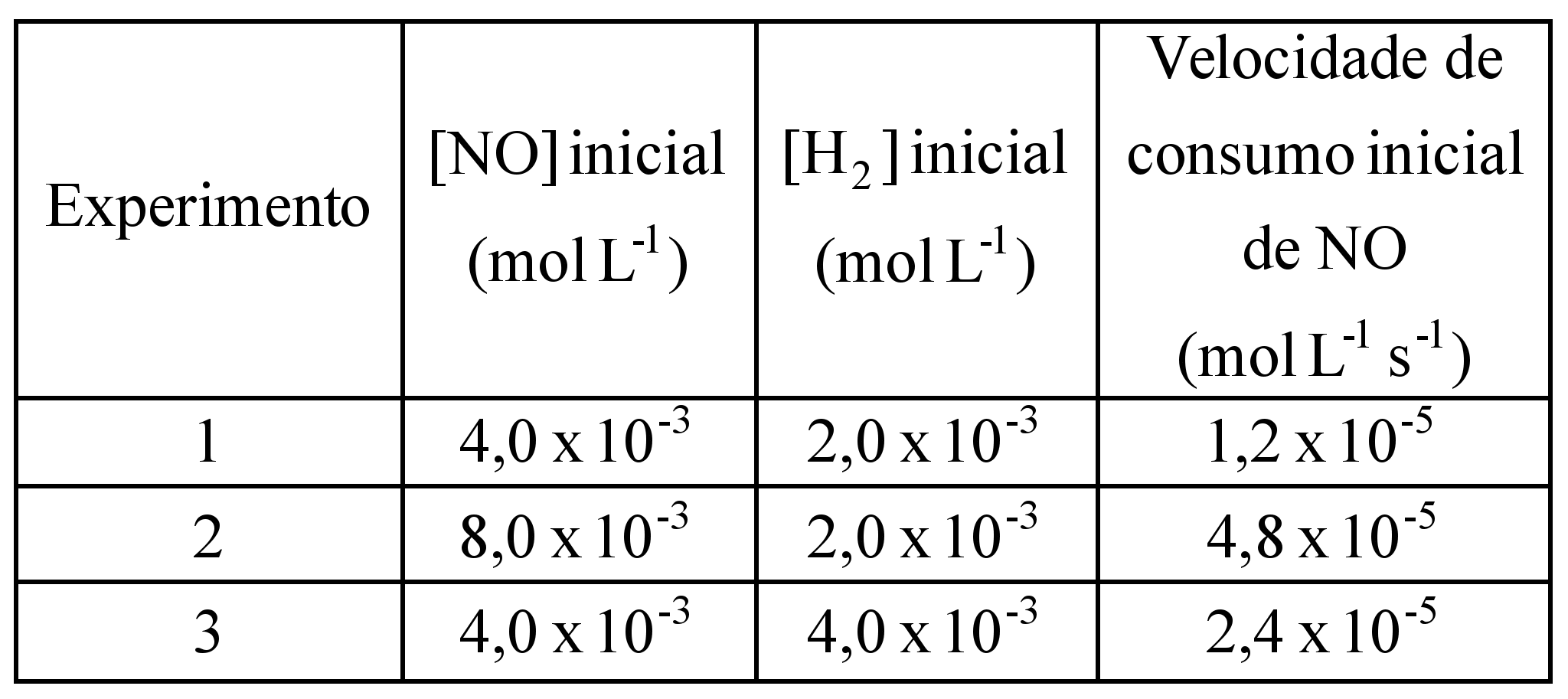
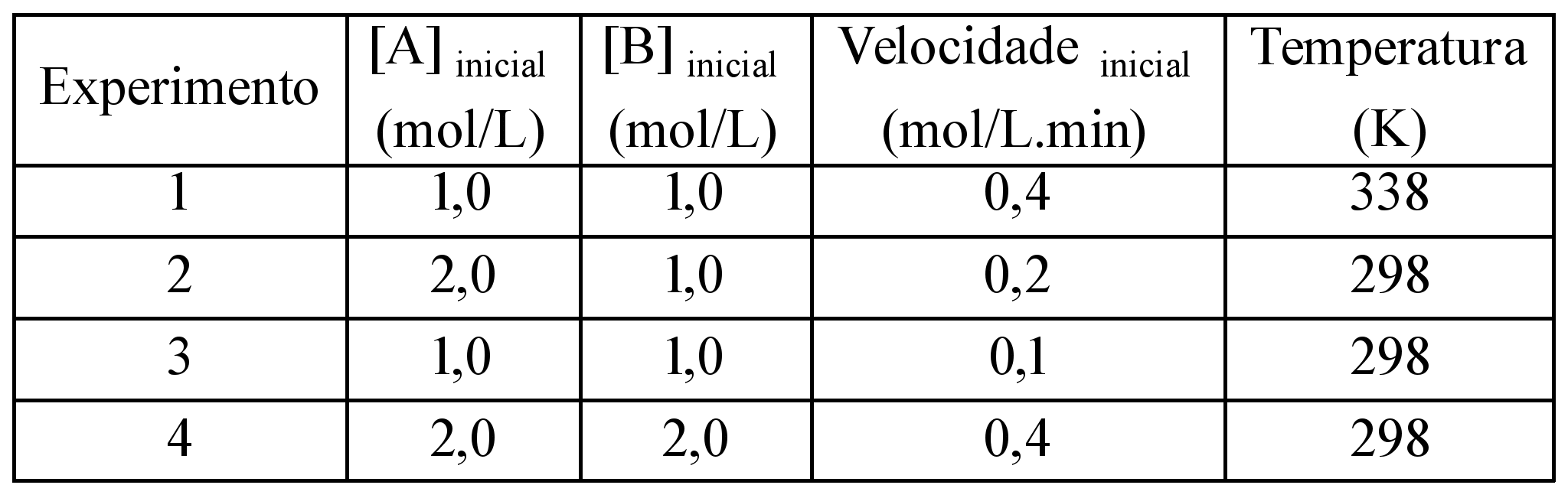
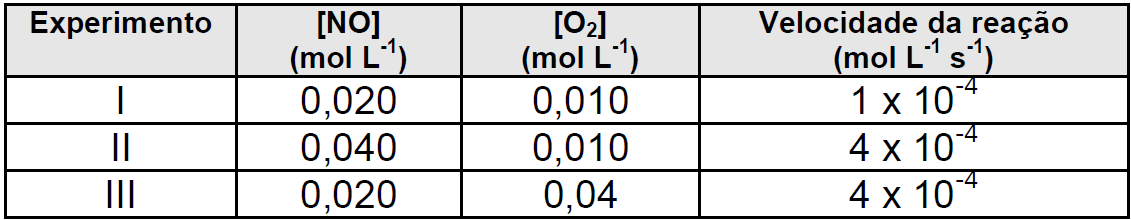
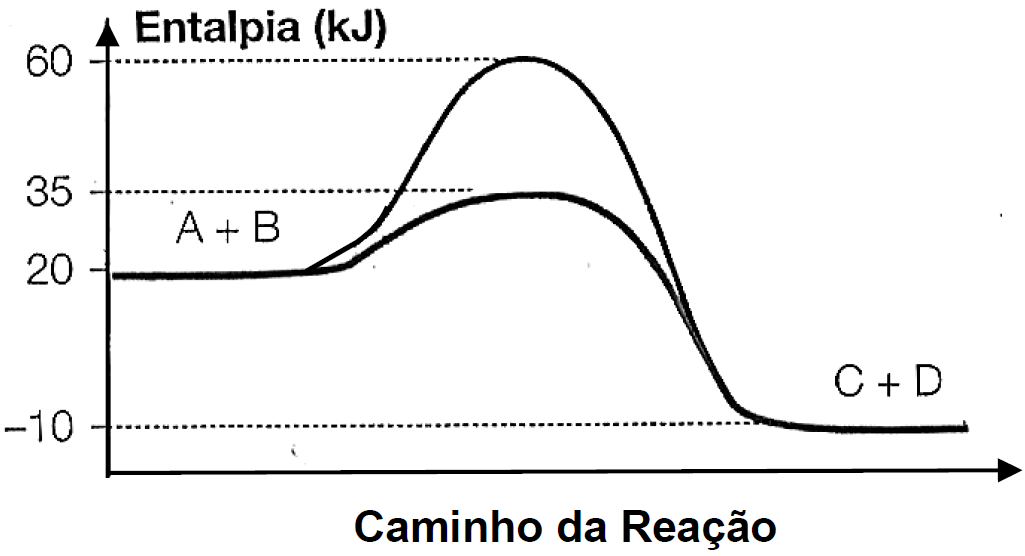
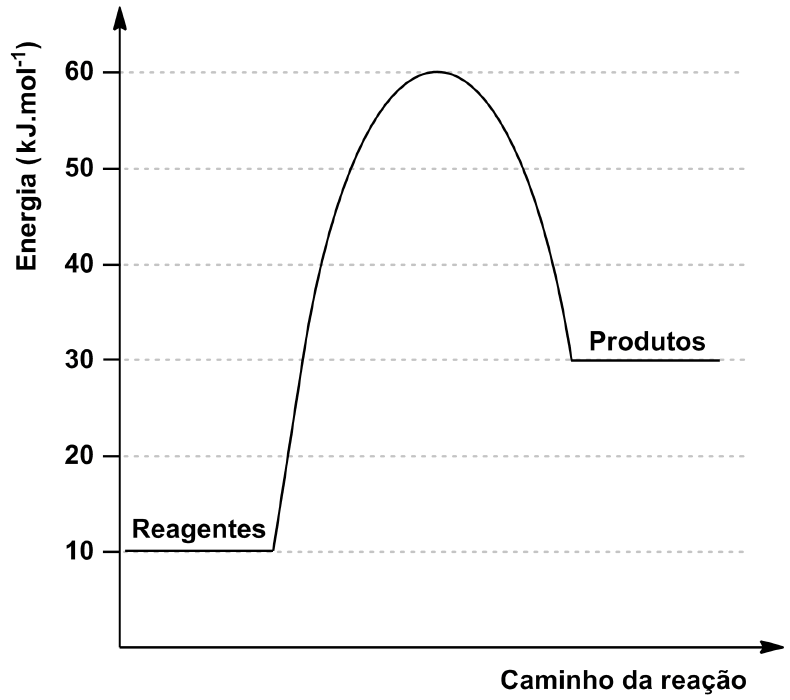
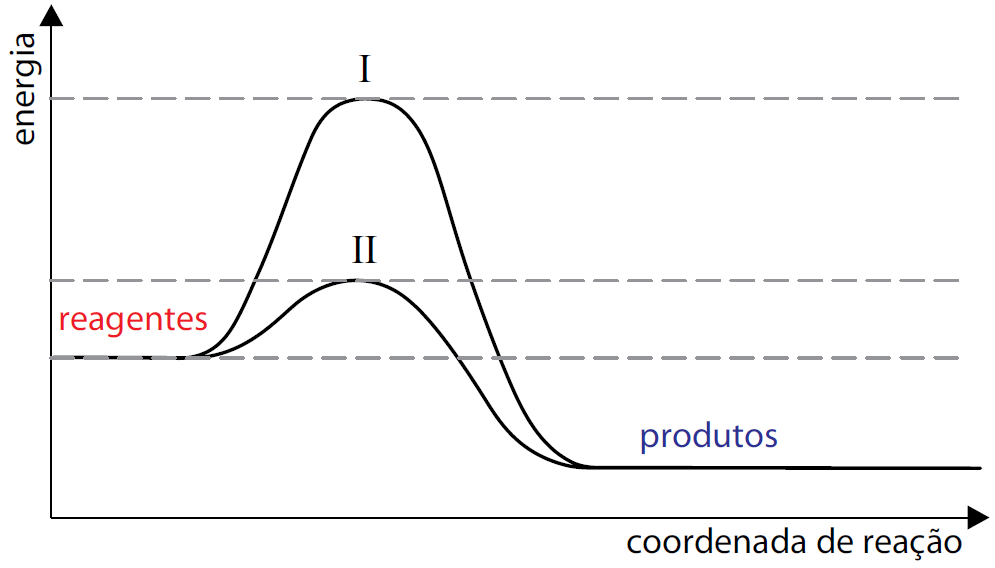
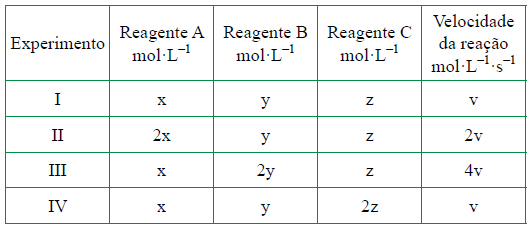 ara otimizar as condições de um processo industrial que depende de uma reação de soluções aquosas de três diferentes reagentes para a formação de um produto:
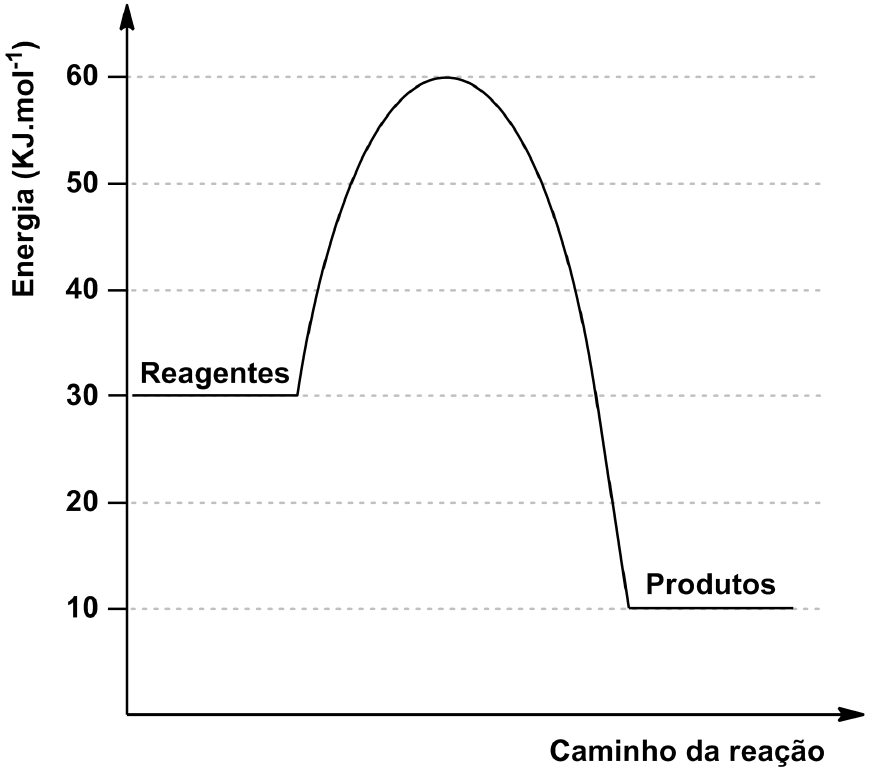
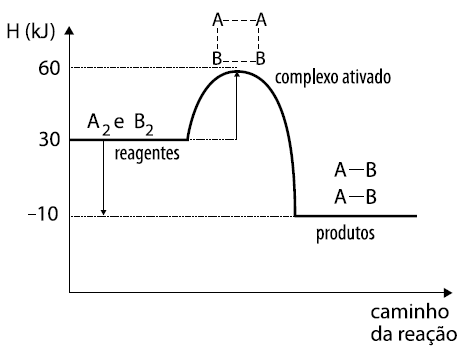
ara otimizar as condições de um processo industrial que depende de uma reação de soluções aquosas de três diferentes reagentes para a formação de um produto: 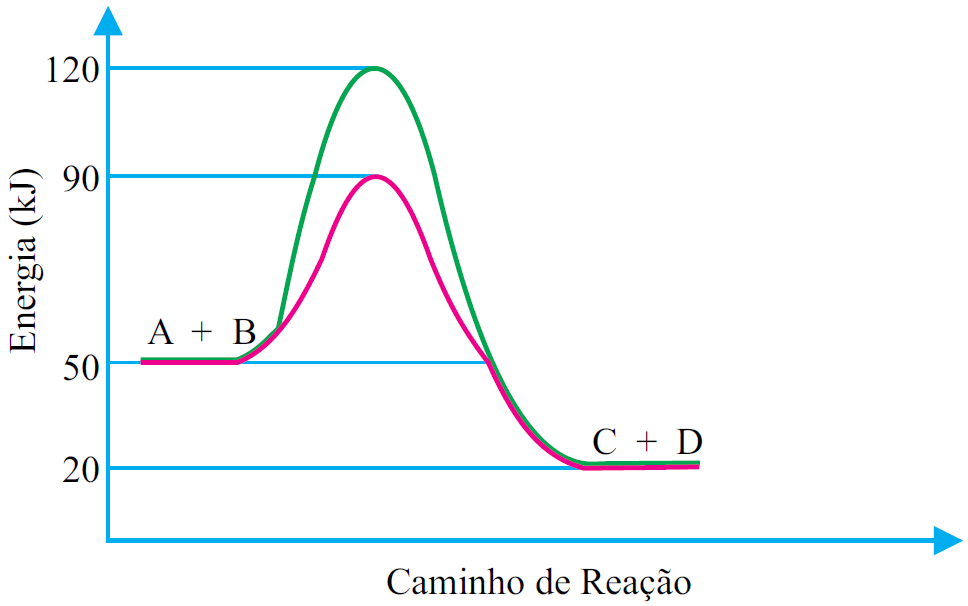 )Calcule a energia de ativação na reação inversa para o caminho não catalisado.
)Calcule a energia de ativação na reação inversa para o caminho não catalisado.