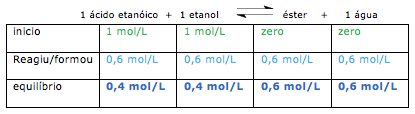
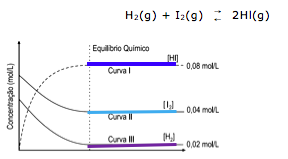
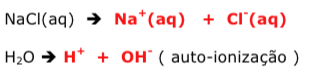
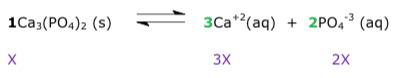
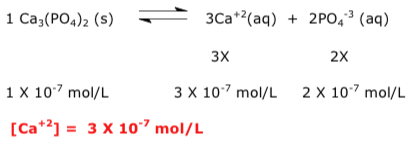
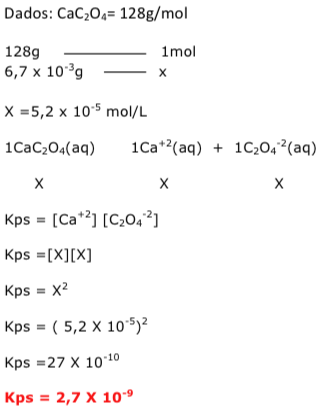
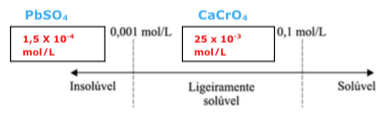
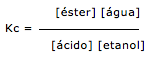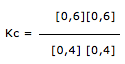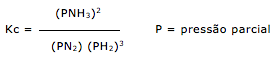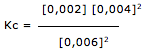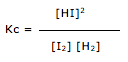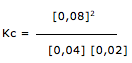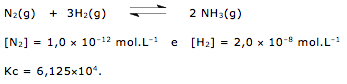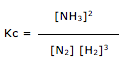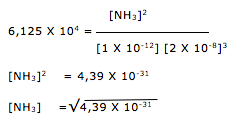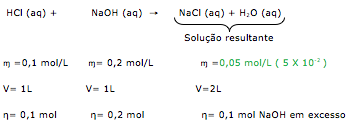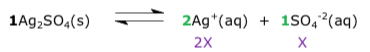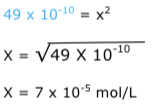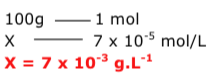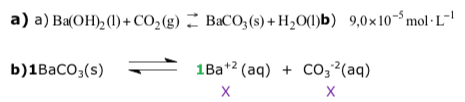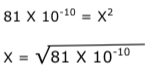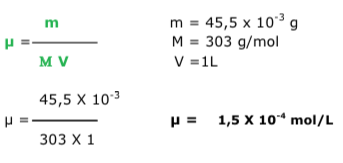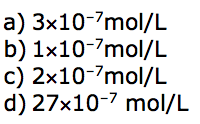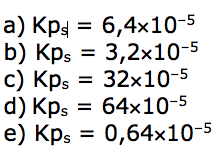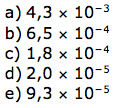Exercícios de teoria atômico molecular, solubilidade, concentração comum, concentração molar.
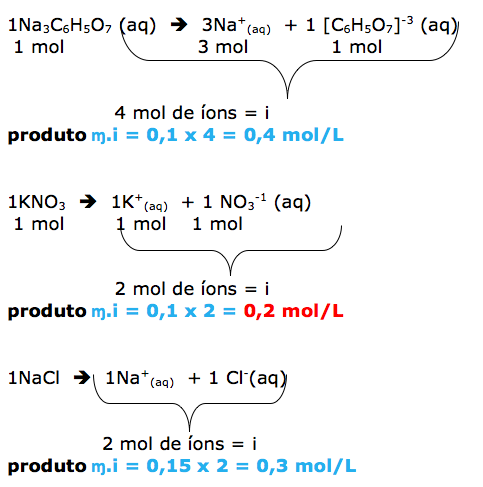
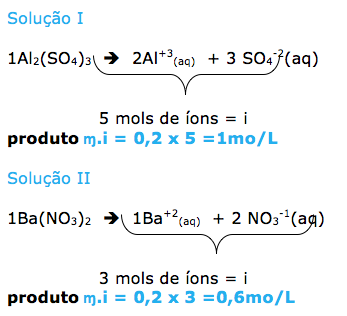
- CONCENTRAÇÃO COMUM.
- TEORIA ATÔMICA MOLECULAR.
- COEFICIENTE DE SOLUBILIDADE
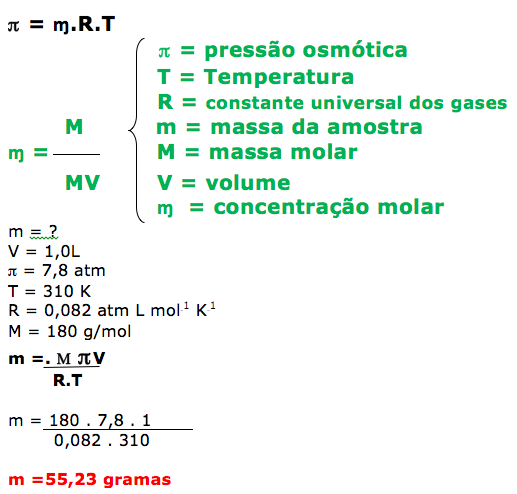
- CONCENTRAÇÃO MOLAR.
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
01 - (IFRS/2015)
O soro caseiro, excelente para evitar a desidratação causada por vômitos e diarreia, é preparado com 20 g de açúcar refinado; 3,5 g de sal refinado e 1 litro de água filtrada ou fervida. Com relação à solução de soro caseiro, ao evaporar toda a água, num recipiente adequado,teremos aproximadamente quantos gramas de sólido no final.
02 - (UNCISAL/2015)
O aspartame é um dos aditivos alimentares mais utilizados para substituir o açúcar comum; contudo, quando aquecido, decompõe-se, levando a formação de metanol, como ilustrado pela reação abaixo.
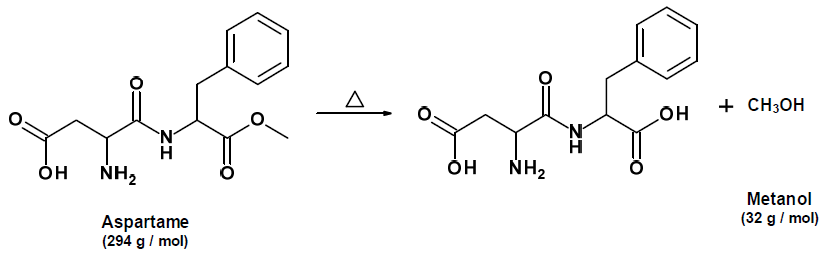
Disponível em: <www.anvisa.gov.br>.
Acesso em: 24 out. 2014.
Sabendo que uma lata de 350 mL de refrigerante apresenta a concentração de 0,5 mg/mL em aspartame, indique quantas latas de refrigerante, aproximadamente, deveriam ser usadas para se obter uma massa de metanol igual a 190 mg, após a decomposição do aspartame.
03 - (UFPEL RS/2015)
Segundo algumas orientações nutricionais, a dose diária recomendada de vitamina C (C6H8O6), a ser ingerida por uma pessoa adulta, é de 2,5 X 10–4 mol. Se uma pessoa consome, diariamente, uma cápsula de 440 mg dessa vitamina, a dose consumida por esse paciente é X vezes maior do que a recomendada. Nesse caso, X equivale a quanto?
04 - (IFPE/2015)
O sulfato ferroso faz parte da composição de remédios indicados para combater a anemia (deficiência de ferro). Esses remédios são usados para combater a deficiência alimentar de ferro, prevenção de anemia e reposição das perdas de ferro por dificuldades na absorção. Considere um vidro de remédio de 200mL que contém 3,04g de sulfato ferroso dissolvido na solução. Assinale a alternativa que indica corretamente a concentração, em quantidade de matéria por litro (mol/L), do ferro (II) no sulfato ferroso, presente neste remédio. Dados: Fe =56 S = 32 O = 16
a) 0,05
b) 0,20
c) 0,60
d) 0,10
e) 0,40
05 - (UNISC RS/2015)
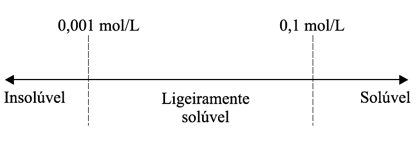
O sulfato de cobre anidro (CuSO4 ) apresenta coeficiente de solubilidade aproximado de 19,50 g L–1. Analise as alternativas a seguir e assinale a única verdadeira.
Dado: CuSO4: 159,609 gmol–1
a) Uma solução a 25 g L–1 será classificada como saturada.
b) Uma solução que apresente concentração 2 mol L–1 é dita diluída.
c) A solução preparada pela dissolução de 10 g de CuSO4 em 100 mL de água não apresentará precipitado.
d) Uma solução 1,0 x 10–2 mol L–1 é classificada como concentrada.
e) Uma solução 10 g L–1 é mais concentrada que outra solução 0,03 mol L–1.
06 - (UFAM/2015)
Dados recentes publicados pelo Ministério de Minas e Energia no Balanço Energético Nacional (BEN 2014 - Ano base 2013, http://www.epe.gov.br) revelam que em 2013, cada brasileiro, consumindo e produzindo energia, emitiu em média 2,3 t de CO2. Considerando que a população brasileira em 2013 era de aproximadamente 200 milhões de habitantes, quantas moléculas de CO2 foram produzidas, aproximadamente, pela população brasileira?
07 - (Unimontes MG/2015)
Os dados abaixo se referem às substâncias, carbono, eteno, dióxido de carbono e glicose. Essas substâncias encontram-se representadas por I, II, III e IV, respectivamente.
I. 12,0 g de C.
II. 8 mols de C2H2.
III. 9,0 x 1023 moléculas de CO2.
IV. 180,0 g de C6H12O6.
Em relação aos dados fornecidos, apresenta maior número de átomos de carbono à substância representada em
a) I.
b) III.
c) IV.
d) II.
08 - (Fac. Santa Marcelina SP/2014)
A cafeína é muito utilizada por atletas, mas existe preocupação com o abuso do seu consumo. Recentemente, alguns estudos mostraram que os efeitos da cafeína na melhora da tolerância ao exercício prolongado devem-se ao aumento da mobilização da gordura durante o exercício, preservando os estoques de glicogênio muscular.
O gráfico representa a curva de solubilidade da cafeína em água.
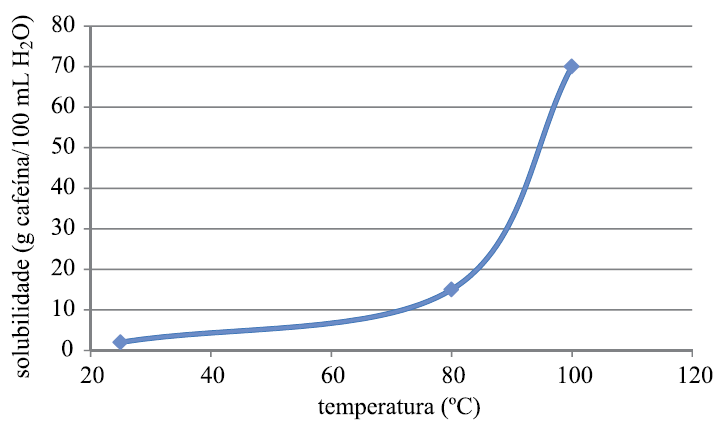
Quando uma solução saturada de cafeína contendo 200 mL de água é resfriada de 100 ºC para 80 ºC, a quantidade máxima de cafeína cristalizada, em gramas, será igual a
a) 110.
b) 70.
c) 35.
d) 55.
e) 15.
09 - (Centro Universitário São Camilo SP/2014)
O selênio (Se) é um micronutriente que tem sido associado à redução de risco de alguns tipos de câncer. No entanto, o excesso desse mineral pode causar selenose. A figura apresenta um dos alimentos mais ricos em selênio e o teor de Se encontrado na análise de uma amostra oriunda da região Amazônica.

(www.agencia.cnptia.embrapa.br. Adaptado.)
Um homem adulto ingeriu 7,2 × 1017 átomos de selênio, ao consumir castanhas do brasil com as características indicadas na figura. Dado que a constante de Avogadro é 6,0 × 1023mol–1 e 1g = 10–6g, é correto afirmar que o número de castanhas do brasil consumidas por esse adulto foi
a) 2.
b) 1.
c) 5.
d) 3.
e) 4.
TEXTO: Comum às questões: 10, 11
As informações destacadas abaixo foram retiradas do rótulo de um refrigerante “zero açúcar”:

A água gaseificada apresenta o seguinte equilíbrio químico:
CO2(aq) + 2 H2O(l)  HCO3–(aq) + H3O+(aq)
HCO3–(aq) + H3O+(aq)
E ainda estão presentes acidulantes utilizados para realçar o sabor e para inibir o desenvolvimento de microrganismos. Os acidulantes, comumente usados pela indústria alimentícia, são os ácidos cítrico (C6H8O7) e fosfórico (H3PO4). Para regular a acidez do meio usa-se o citrato de sódio (C6H7O7Na) e para substituir o açúcar usa-se o aspartame (C14H18N2O5) e o ciclamato de sódio (NaC6H12SNO3).
10 - (UEPA/2015)
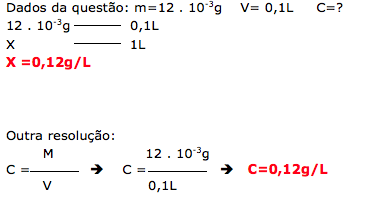
Sobre a presença do aspartame em 100 mL do refrigerante, é correto afirmar que a concentração desse adoçante no meio é:
a) 0,0012 g/L
b) 0,012 g/L
c) 0,12 g/L
d) 12,0 g/L
e) 120,0 g/L
11 - (UEPA/2015)
Em 100 mL do refrigerante, exposto no Texto XXV, à concentração em mol/L de ciclamato de sódio (NaC6H12SNO3), conforme o rótulo, é:
Dados: considere a massa molar do ciclamato de sódio=201 g/mol.
a) 5,0 x10–4 mol/L
b) 1,2 x10–3 mol/L
c) 3,5 x10–3 mol/L
d) 4,7 x10–3 mol/L
e) 5,5 x10–3 mol/L
12 - (UERJ/2015)
A salinidade da água é um fator fundamental para a sobrevivência dos peixes. A maioria deles vive em condições restritas de salinidade, embora existam espécies como o salmão, que consegue viver em ambientes que vão da água doce à água do mar. Há peixes que sobrevivem em concentrações salinas adversas, desde que estas não se afastem muito das originais.
Considere um rio que tenha passado por um processo de salinização. Observe na tabela suas faixas de concentração de cloreto de sódio.
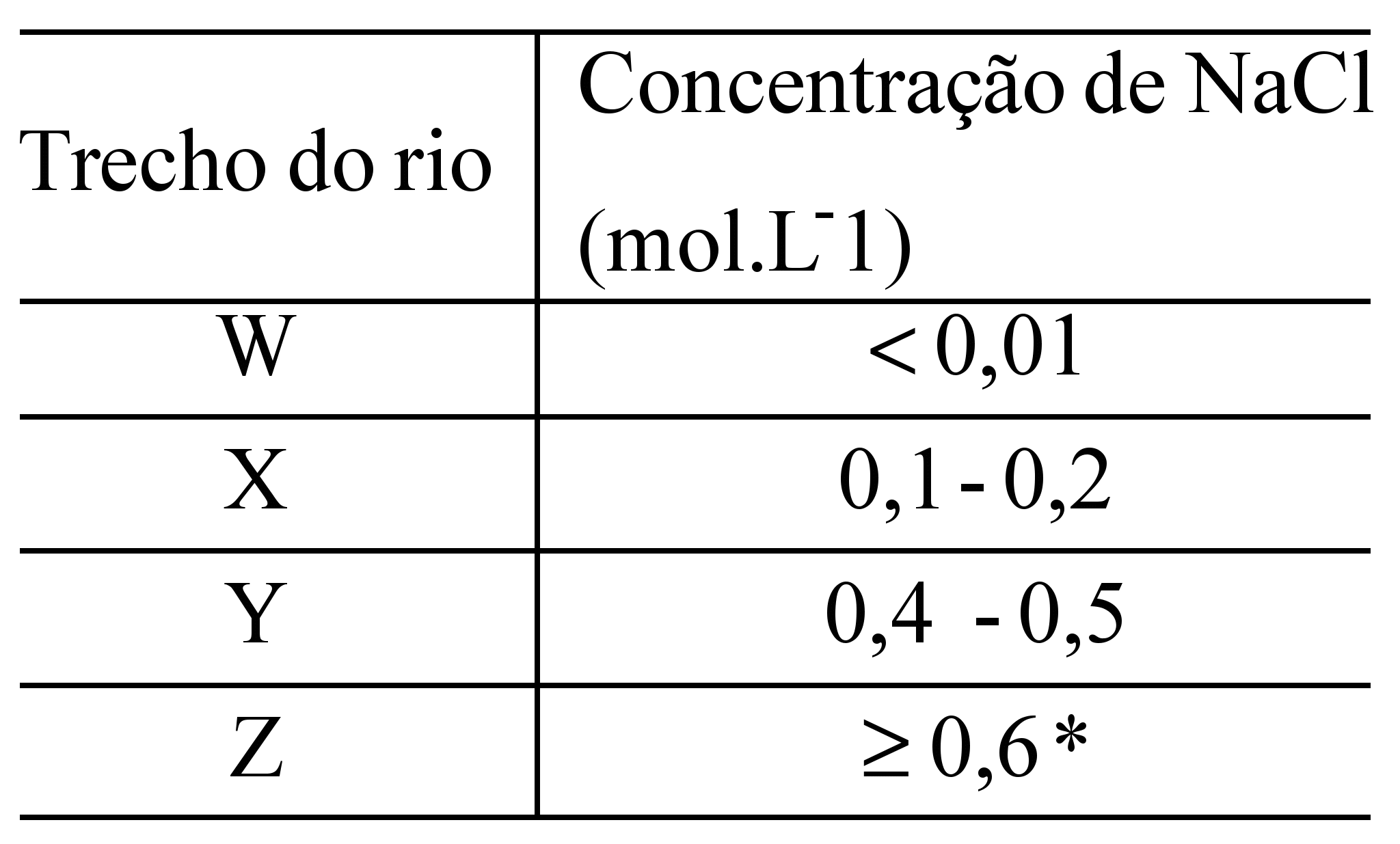
*isotônica à água do mar
Um aquário com 100 L de solução aquosa de NaCl com concentração igual a 2,1 g.L –1, será utilizado para criar peixes que vivem no trecho Z do rio. A fim de atingir a concentração mínima para a sobrevivência dos peixes, deverá ser acrescentado NaCl à solução, sem alteração de seu volume.
A massa de cloreto de sódio a ser adicionada, em quilogramas, é igual a:
a) 2,40
b) 3,30
c) 3,51
d) 3,72
13 - (UNIFICADO RJ/2015)
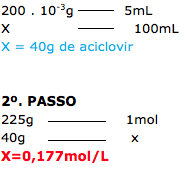
Aciclovir é um antiviral indicado no tratamento do vírus do herpes humano, incluindo o vírus do herpes simplex, tipos 1 e 2, e o vírus varicella zoster.
Há, no mercado, comprimidos de aciclovir de 200 mg, 400 mg e 800 mg. Há também a forma em xarope, com apresentação de 200 mg/5 mL. Portanto, a concentração em quantidade de matéria do aciclovir no xarope é, em mol.L–1,
Dado: A massa molar do aciclovir é 225 g/mol.
a) 0,18
b) 0,28
c) 0,58
d) 0,88
e) 0,98
14 - (UDESC SC/2013)
A figura abaixo representa a curva de solubilidade de alguns sais.
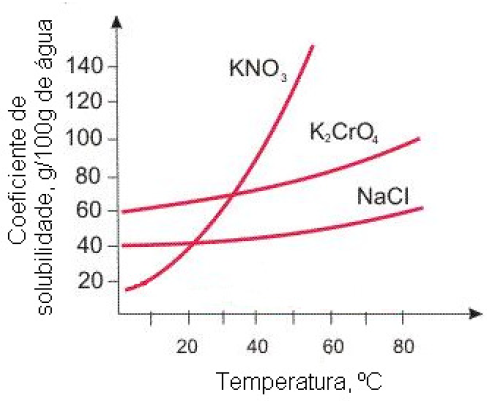
Assinale a alternativa que representa, sequencialmente, a massa (em gramas) de nitrato de potássio que é cristalizada e a massa que permanece na solução, quando uma solução aquosa saturada desse sal a 50ºC é resfriada para 20ºC.
a) 90g e 40g
b) 40g e 90g
c) 90g e 130g
d) 10g e 65g
e) 05g e 40g
15 - (Univag MT/2013)
A solubilidade em água do glutamato monossódico mono-hidratado, sal muito utilizado na culinária oriental para reforçar o sabor dos alimentos, é cerca de 60 g/100 mL a 20 ºC. Sabendo que a fórmula molecular dessa substância é C5H8NNaO4.H2O, conclui-se que a concentração aproximada, em mol/L, de uma solução saturada desse sal a 20 ºC é
a) 4.
b) 5.
c) 2.
d) 1.
e) 3.
16 - (UNEMAT MT/2012)
O coeficiente de solubilidade pode ser definido como sendo a quantidade máxima de um soluto capaz de ser dissolvida por uma determinada quantidade de solvente, sob determinadas condições de temperatura e pressão.
Sabendo-se, então, que o coeficiente de solubilidade do K2Cr2O7 é de 12,0 gramas em 100 mL de água a T=20ºC, que tipo de sistema será formado quando forem adicionadas 120 gramas de K2Cr2O7 em 600 mL de água a T=20ºC?
a) Um sistema heterogêneo, com 48 gramas de K2Cr2O7 como precipitado (corpo de fundo).
b) Um sistema homogêneo, com 48 gramas de K2Cr2O7 dissolvidas completamente.
c) Uma solução insaturada.
d) Um sistema heterogêneo, saturado, com volume final igual a 820 mL.
e) Um sistema homogêneo onde 120 gramas de K2Cr2O7 foram completamente dissolvidas.
17 - (UDESC SC/2011)
A tabela a seguir refere-se à solubilidade de um determinado sal nas respectivas temperaturas:

Para dissolver 40 g desse sal à 50ºC e 30ºC, as massas de água necessárias, respectivamente, são:
a) 58,20 g e 66,67 g
b) 68,40 g e 57,14 g
c) 57,14 g e 66,67 g
d) 66,67 g e 58,20 g
e) 57,14 g e 68,40 g
18 - (UESPI/2011)
Certa substância X pode ser dissolvida em até 53g a cada 100 mL de água (H2O). As soluções formadas por essa substância, descritas a seguir, podem ser classificadas, respectivamente, como:
1. 26,5g de X em 50 mL de H2O
2. 28g de X em 100 mL de H2O
3. 57,3g de X em 150 mL de H2O
4. 55g de X em 100 mL de H2O
a) Insaturada, Insaturada, Saturada com precipitado e Saturada.
b) Saturada, Saturada, Saturada com precipitado e Insaturada.
c) Saturada com precipitado, Insaturada, Saturada e Saturada.
d) Saturada com precipitado, Insaturada, Insaturada e Saturada.
e) Saturada, Insaturada, Insaturada e Saturada com precipitado.
19 - (UNESP SP)
No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em gramas de soluto por 1000 g de água).
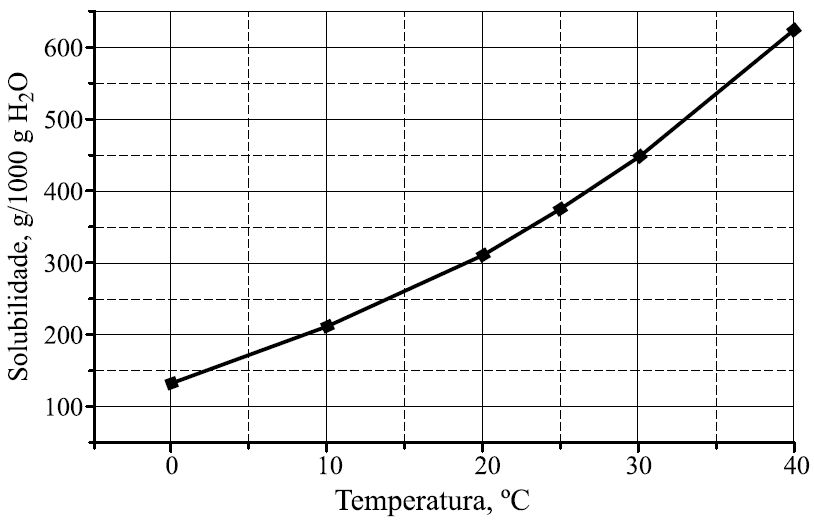
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução deve estar a uma temperatura, aproximadamente, igual a
a) 12 °C.
b) 17 °C.
c) 22 °C.
d) 27 ºC.
e) 32 °C.
20 - (PUC SP)
O gráfico a seguir representa a curva de solubilidade do nitrato de potássio (KNO3) em água.
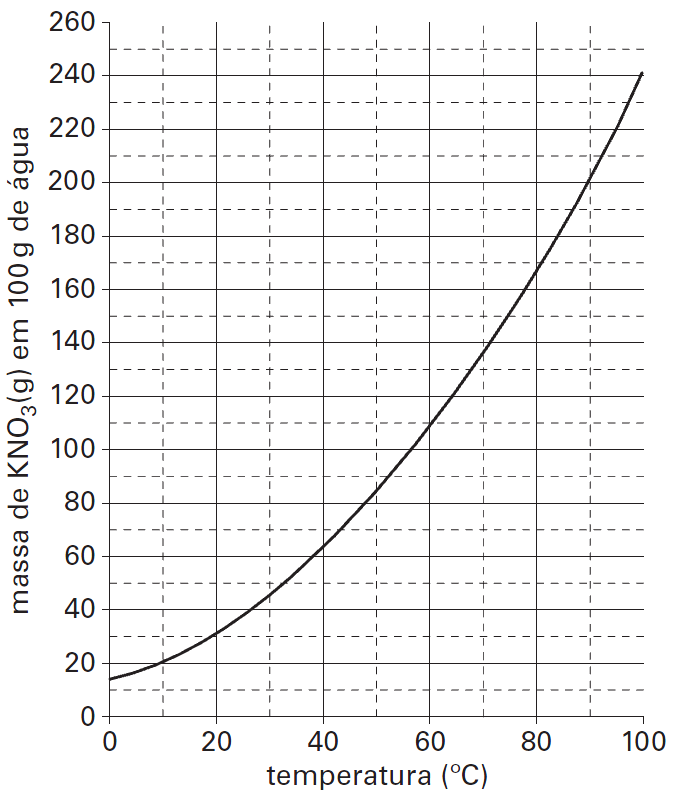
A 70ºC, foram preparadas duas soluções, cada uma contendo 70g de nitrato de potássio (KNO3) e 200g de água.
A primeira solução foi mantida a 70ºC e, após a evaporação de uma certa massa de água (m), houve início de precipitação do sólido. A outra solução foi resfriada a uma temperatura (t) em que se percebeu o início da precipitação do sal.
A análise do gráfico permite inferir que os valores aproximados da massa m e da temperatura t são, respectivamente,
a) m = 50g e t = 45ºC
b) m = 150g e t = 22ºC
c) m = 100g e t = 22ºC
d) m = 150g e t = 35ºC
e) m = 100g e t = 45ºC
21 - (UFV MG)
A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico abaixo:
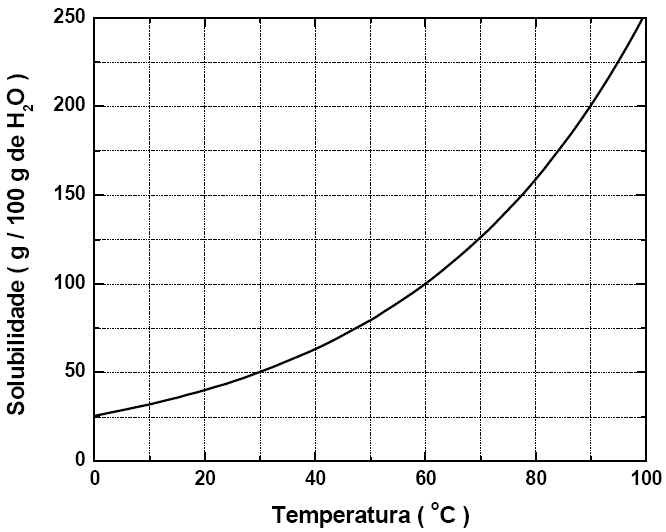
De acordo com o gráfico, assinale a alternativa que indica CORRETAMENTE a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 °C:
a) 250
b) 375
c) 150
d) 100
e) 500
22 - (UFMS)
Preparou-se uma solução saturada de nitrato de potássio (KNO3), adicionando-se o sal a 50 g de água, à temperatura de 80°C. A seguir, a solução foi resfriada a 40°C. Qual a massa, em gramas, do precipitado formado?
Dados:

23 - (UNIRIO RJ)
A figura abaixo representa a variação de solubilidade da substância A com a temperatura. Inicialmente, tem-se 50 g dessa substância presente em 1,0 litro de água a 70 ºC. O sistema é aquecido e o solvente evaporado até a metade. Após o aquecimento, o sistema é resfriado, até atingir a temperatura ambiente de 30 ºC.
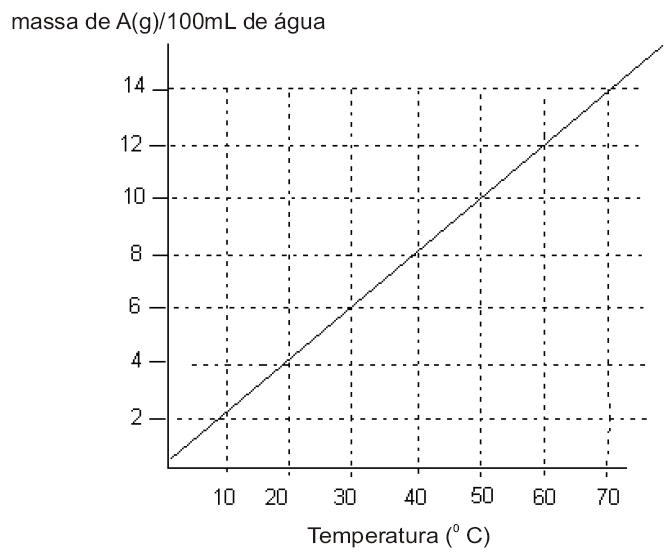
Determine a quantidade, em gramas, de A que está precipitada e dissolvida a 30 ºC.
24 - (FMJ SP/2014)
Considere as informações sobre o brometo de ipratrópio, fármaco empregado no tratamento de doenças respiratórias como broncodilatador.
Estrutura:
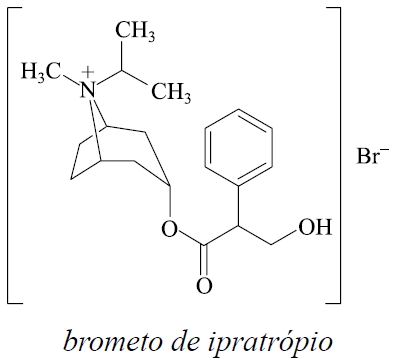
Massa molar aproximada: 4 × 102 g/mol
Informação extraída da bula:
Cada mL (20 gotas) da solução para inalação contém:
brometo de ipratrópio........... 0,25 mg
veículo q.s.p. ........................ 1 mL
(cloreto de benzalcônio, edetato dissódico, cloreto de sódio, ácido clorídrico e água purificada.)
A quantidade de brometo de ipratrópio, em mol, que entra no organismo do paciente a cada mililitro de solução inalada é, aproximadamente,
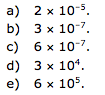
25 - (Unicastelo SP/2014)
Utilize as informações reunidas na tabela, obtidas do rótulo de uma água mineral natural.
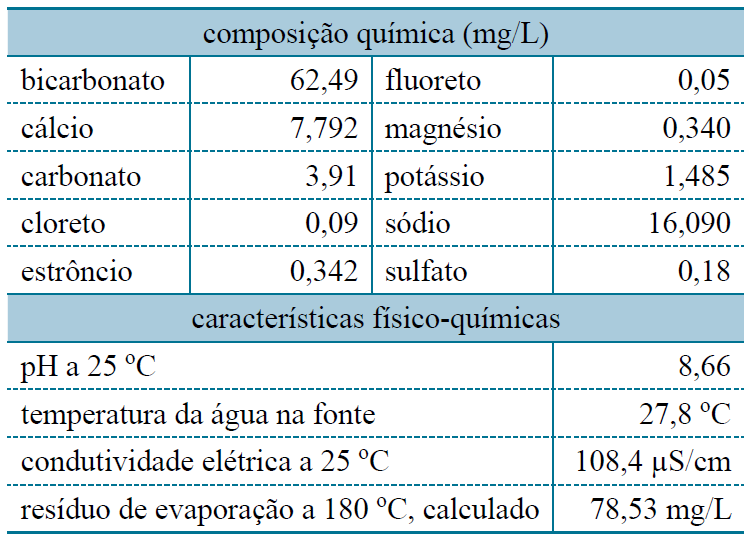
Segundo as informações da tabela, a massa total de íons de metais alcalino-terrosos dissolvidos nessa água, em mg/L, é igual a
a) 4,180.
b) 8,132.
c) 17,575.
d) 8,474.
e) 0,682.
26 - (UFSCAR SP/2013)
Após a conclusão do ensino médio, uma jovem estudante começou a se preparar para a realização das provas de vestibulares de algumas universidades. Em certo dia, durante os estudos, sentiu azia estomacal. Preocupada, sua mãe dissolveu todo o conteúdo de um envelope de medicamento num copo d’água (200 mL) e deu para a filha tomar. Após o alívio estomacal, a estudante pediu para ver o envelope do medicamento e anotou a sua composição:
• bicarbonato de sódio: 2,10 g
• carbonato de sódio: 0,50 g
• ácido cítrico: 2,25 g
A estudante, entusiasmada, recordou das aulas de química e lembrou-se de alguns conceitos, como soluções e reações químicas, especialmente da reação entre o carbonato de sódio e o ácido produzido pelo estômago, o HCl:

Se o envelope do medicamento contivesse somente bicarbonato de sódio (2,10 g) e se o volume final do conteúdo do copo d’água não se alterasse após a dissolução do medicamento, é correto afirmar que a concentração, em mol/L, de bicarbonato de sódio (massa molar 84 g/mol) nesta solução seria de
a) 0,025.
b) 0,050.
c) 0,075.
d) 0,100.
e) 0,125.
27 - (ESCS DF/2014)
Há muitos séculos, a humanidade aprendeu a utilizar as propriedades biológicas de substâncias presentes nas plantas. Por exemplo, no século V a.C., o médico grego Hipócrates relatou que a casca do salgueiro branco (Salix alba) aliviava dores e diminuía a febre. O responsável por essas atividades terapêuticas é o ácido salicílico, gerado pela metabolização, pelas enzimas do fígado, da salicilina presente no salgueiro. O ácido salicílico, apesar de suas propriedades terapêuticas, provoca lesões nas paredes do estômago. Para solucionar esse problema, a molécula foi modificada pelo laboratório alemão Bayer, em 1897, por meio da inserção de um grupo acetil. Assim surgiu o ácido acetilsalicílico, primeiro fármaco sintético empregado na terapêutica e que é hoje o analgésico mais consumido e vendido no mundo. A seguir, são apresentadas as estruturas moleculares da salicilina, do ácido salicílico e do ácido acetilsalicílico.
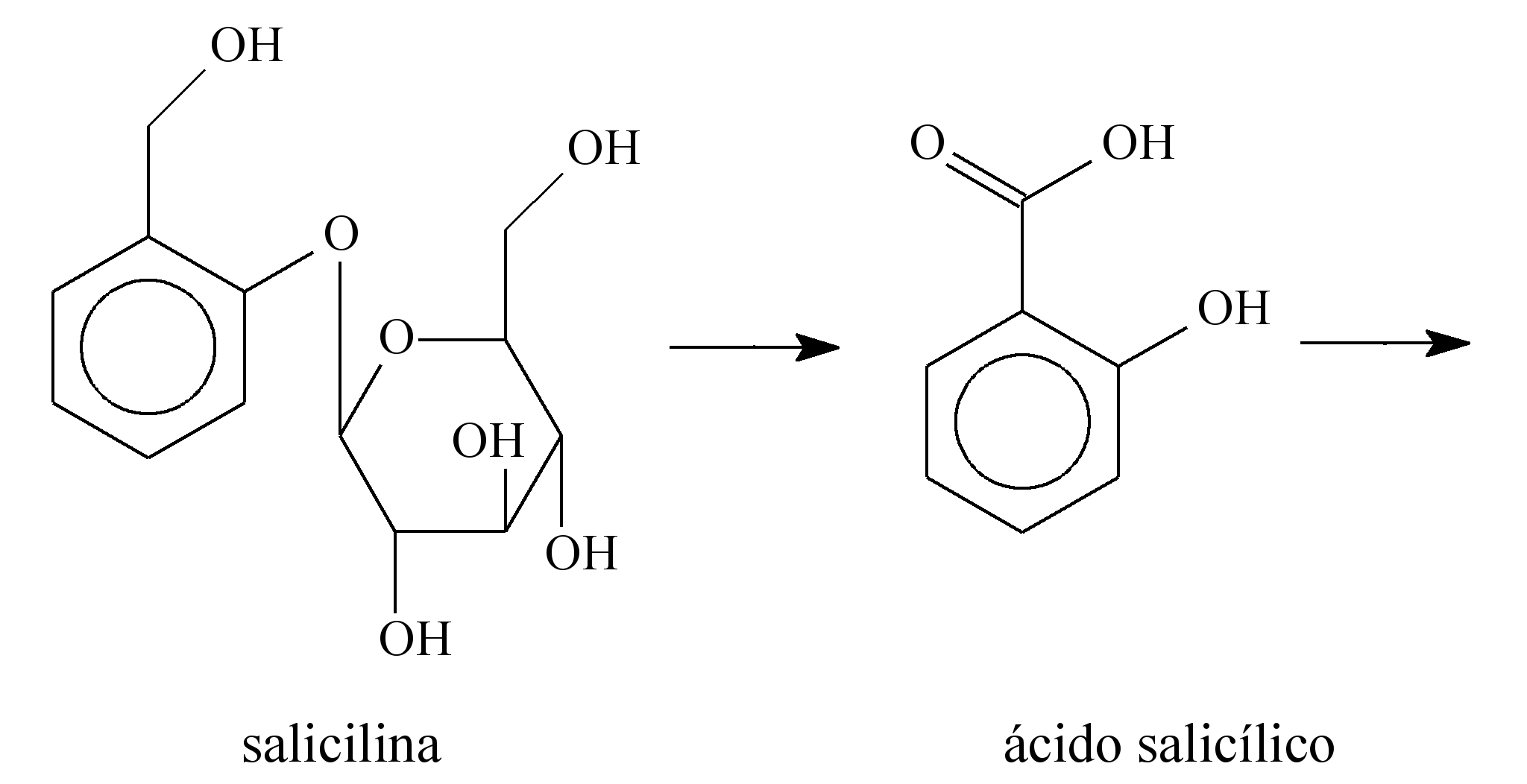
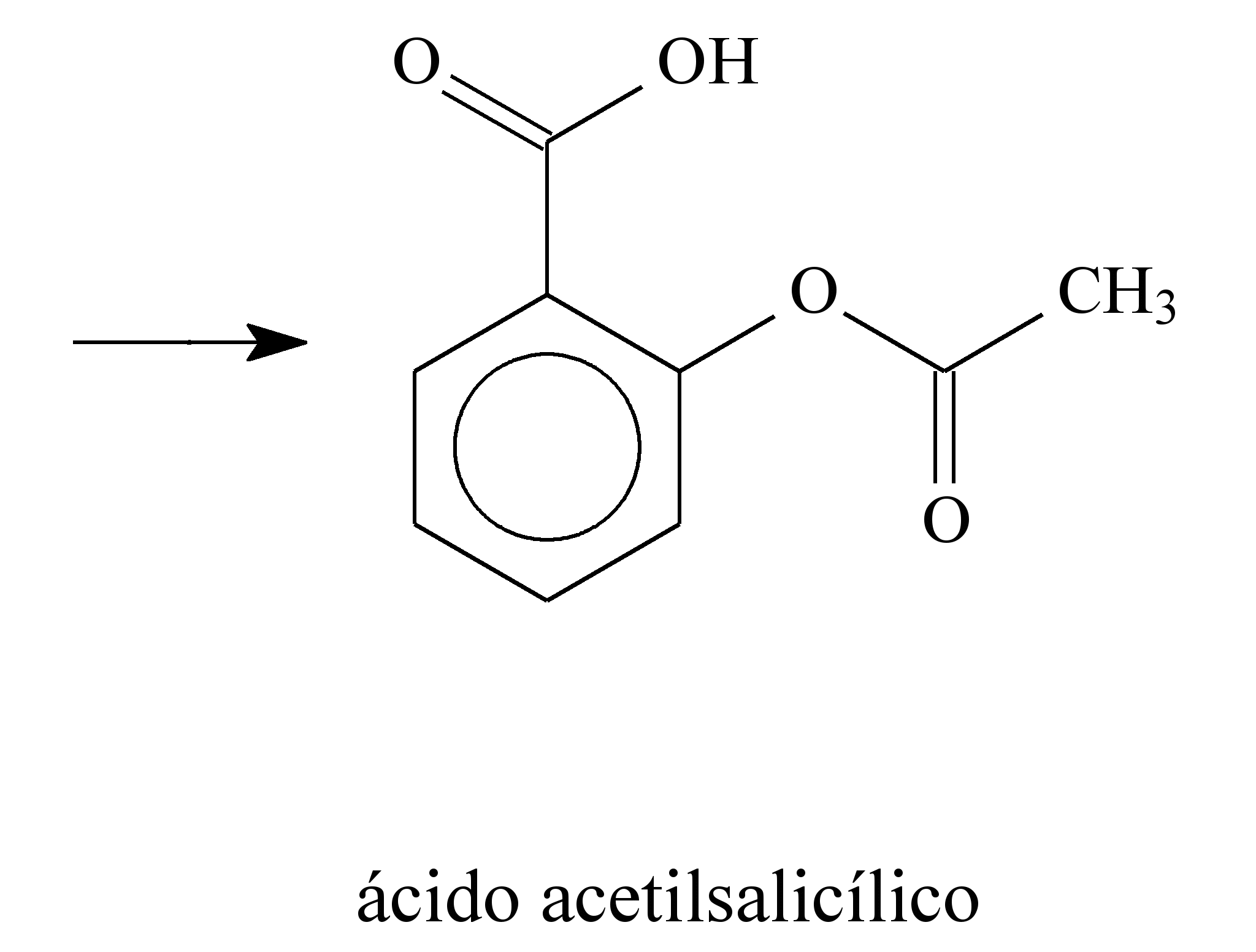
O ácido acetilsalicílico é pouco solúvel em água e, por isso, é comercializado na forma de comprimido. Considere que a massa molar e a solubilidade do ácido acetilsalicílico sejam iguais a 180 g/mol e 0,225 g em 100 mL de água, respectivamente. Desprezando-se a variação de volume decorrente da adição do ácido em água, uma solução aquosa saturada de ácido acetilsalicílico apresenta concentração de ácido dissolvido igual a
a) 1,25 × 10–2 mol/L.
b) 2,25 × 10–2 mol/L.
c) 1,25 g/L.
d) 18,0 g/L.
28 - (Unicastelo SP/2013)
Para economizar água, basta fechar a torneira. Por exemplo, escovar os dentes por cinco minutos com a torneira aberta gasta, em média, 12 litros de água, enquanto que molhar a escova, fechar a torneira e bochechar com um copo d’água, gastam 0,3 L. Considerando que a densidade da água é 1 g.mL–1 e a constante de Avogadro 6,0×1023 mol–1, a economia, em número de moléculas de água, H2O, demonstrada é de, aproximadamente,
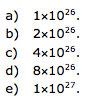
29 - (ESCS DF/2011)
Para tentar explicar a presença de clorometano e diclorometano em amostras recolhidas em Marte pela sonda Viking, cientistas aqueceram uma mistura de percloratos com o solo do deserto do Atacama, no Chile, possivelmente similar ao solo marciano. As reações químicas da experiência destruíram os compostos orgânicos do solo, liberando traços de clorometano e diclorometano como os encontrados pela sonda.
Considerando que em uma amostra foram encontradas 6 1015 moléculas de clorometano e 1,2 1017 moléculas de diclorometano, os números de mols aproximados de clorometano e de diclorometano são, respectivamente:
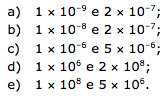
30 - (ACAFE SC/2014)
No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem sobre o ataque com armas químicas na Síria ´´[...] O gás sarin é inodoro e invisível. Além da inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio miligrama. […]”.
Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140g/mol.
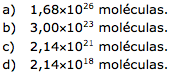
31 - (UFTM MG/2013)
Os “cianokits”, que são utilizados por socorristas em outros países nos casos de envenenamento por cianeto, geralmente contêm 5 g de hidroxocobalamina ( massa molar igual a 1,3 x 103g/mol ) injetável. Considerando a constante de Avogadro igual a 6 1023 mol–1, calcula-se que o número aproximado de moléculas existentes nessa massa de hidroxocobalamina é
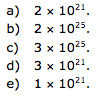
RESOLUÇÃO COMENTADA
1-Resolução:
A questão fornece a quantidade de soluto adicionada para preparar o soro caseiro.
Este soro foi preparado com 20 gramas de açúcar e 3,5 gramas de sal refinado (NaCl) em um litro de água. Portanto temos 23,5g de soluto em um litro de água. Aquecendo, até a evaporação total de toda a água, resta no sistema apenas o soluto, pois o mesmo não evapora. Concluímos que a massa de soluto ( sólido) no final é de 23,5 gramas.
2-Resolução:
Esta questão, mostra um cálculo estequiométrico com relação entre as massas.
A questão deseja saber quantas latas de refrigerante, devem ser consumidas para obter uma massa de 190mg de metanol.
A questão fornece a massa molar do aspartame ( 294g/mol) e do metanol (32 g/mol).
1º. PASSO
Vamos transformar as massas dadas em miligramas para grama. Para isto, basta multiplicar por 10-3
Assim temos: 0,5 . 10-3g/mL de aspartame e 190. 10-3 g de metanol.
Cálculo da massa de aspartame em 190 . 10-3g de metanol.

2º. PASSO
Calcular o volume em mL existente nessa massa de aspartame

3º. PASSO
Cálculo do número de latas de refrigerantes.
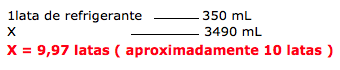
3-Resolução:
1º. PASSO
Determinar a massa molar da vitamina C ( 176g/mol).
E calcular a massa de vitamina em gramas da dose diária recomendada ( 2 x10-4 mol )
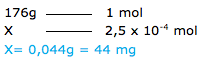
2º. PASSO
Determinação do número de doses na capsula de 440 mg.

4-Resp: D
Esta questão, refere-se ao cálculo da concentração molar de uma solução de sulfato ferroso.
1º. PASSO
Determinar a fórmula da substância citada.
Sulfato ferroso ( FeSO4 )
FeSO4 = 152g/mol.
2º. PASSO
Separar os dados fornecidos na questão.

5-Resp: E
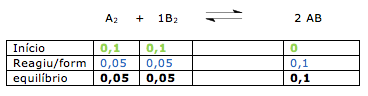
Esta questão, podemos dizer que envolve solubilidade, concentração comum e concentração molar.
1º. PASSO
Temos a solubilidade em gramas por litro (19,50g/L).
Esta informação indica que em 1 litro de solução, temos 19,50g.
Alternativa A – FALSA
A questão indica que o coeficiente de solubilidade é de 19,50g/L. Portanto 25g de soluto é maior que o coeficiente de solubilidade.
Alternativa B – FALSA
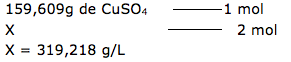
Portanto a quantidade de soluto é superior a 19,50g.
Alternativa C – FALSA
Vamos determinar a quantidade de soluto quando o volume for de 100Ml.
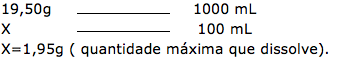
Adicionando 10 gramas, vamos ter precipitado.
Alternativa D – FALSA
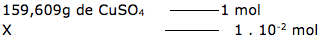
X = 1,59 g/L ( solução diluída).
Alternativa E – VERDADEIRA
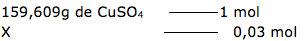
X = 4,78 g/L ( solução diluída).
Portanto uma solução 10g/L é mais concentrada.
Dica: Quanto maior a quantidade de soluto, mais concentrada é a solução.
6-Resolução:
Esta questão refere-se à teoria atômica molecular.
1º. PASSO

7-Resp: D
Esta questão é sobre teoria atômica molecular, a qual se refere ao cálculo do número de átomos.

8-RESP:A
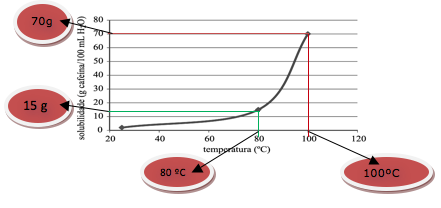
Pelo gráfico

Portanto:
140 – 30 = 110 g de cafeína cristalizada
9-RESP:C
1º. PASSO
Calcular o quanto de selênio que temos em 4 gramas de castanha. O enunciado fornece os valores e a relação entre as unidades.

2º. PASSO
Agora é só calcular o quanto de selênio que o adulto consumiu.
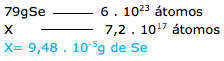
3º. PASSO
Finalizamos com o cálculo da quantidade de castanhas.

10-RESP:C
A questão fornece a quantidade de cada ingrediente presente no refrigerante.
Esta questão fala sobre a presença do aspartame e pede para calcular a concentração em g/L.
No enunciado, não foi especificado em qual unidade deve-se calcular a concentração,porém conseguimos identificar através das alternativas.
11-RESP:B
A questão fornece a quantidade de cada ingrediente presente no refrigerante.
Esta questão fala sobre a presença do ciclamato de sódio e pede para calcular a concentração em mol/L.
Dados da questão:

12-RESP:B
A questão fala sobre a sobrevivência de peixes, em diversos trechos de um rio. O trecho em questão é o Z.
1º. PASSO
A tabela mostra a concentração em mol/L. A questão quer a resposta em massa (kg).Portanto vamos transformar essa concentração em massa.

4º. PASSO
Na água do aquário temos uma massa de 210g. Para ter uma concentração adequada, igual ao trecho Z do rio, será necessário 3510g. Isto indica que falta acrescentar mais NaCl.
3510g – 210g = 3300g (3,3kg)
13-RESP:A
A questão é sobre concentração molar (mol/L).
O xarope é vendido no mercado, sob diversas formas, porém a concentração é sobre o xarope.
1º. PASSO
Vamos determinar a concentração de aciclovir em 1L, pois a concentração deve sair em mol/L.
14-RESP:A
Analisando o gráfico, notamos que :
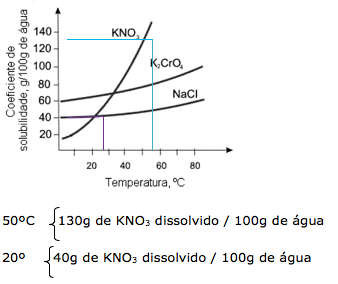
Portanto concluímos que a 20ºC, a quantidade que permanece dissolvida na solução é de 40g, enquanto que 90g de KNO3 ( 130 – 40 ) irá cristalizar.
15-RESP:E
A questão fornece a massa ( 60g) presente em 100 mL (0,1L) de solução.
A questão pede a concentração em mol/L, ou seja, quantos mols de glumato em um litro de solução.
Para resolver, primeiro vamos determinar a massa molar do glutamato.
1)Massa molar
C5H8NNaO4 . H2O = 60 + 8 = 14 + 23 +64 + 18 = 177 g/mol
2) Determinar o número de mols em 60g de glutamato.
177g glutamato .............. 1 mol
60g glutamato .............. x
X = 0,338 mol de glutamato.
3) Calculo da concentração molar em 1 litro.
0,338 mol ............... 0,1L
X mol ............... 1,0L
X= 3,38 mol/L
16-RESP:A
A questão fornece o coeficiente de solubilidade do K2Cr2O7 que é de 12g em 100 mL de água.
A questão fornece uma massa de 120 gramas e 600 mL de água ( 600g água)
Dica: A densidade da água é de 1g/mL, indicando que 600mL é igual a 600g de água.
A quantidade de água é que determina o quanto de soluto irá dissolver.
Portanto vamos calcular quanto os 600 mL consegue dissolver de K2Cr2O7.
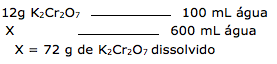
Temos: 120 – 72 = 48g não dissolvido
Concluímos que dos 120g de K2Cr2O7 em 600 mL de água, 72g dissolvem e 48 gramas cristaliza formando o precipitado, indicando um sistema heterogêneo.
17-RESP:C
A questão forneceu uma tabela com o coeficiente de solubilidade do sal.

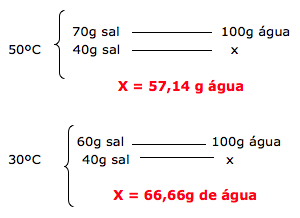
18-RESP:E
Pelo enunciando temos que o coeficiente de solubilidade da substância X é de 53g em 100 mL de água.
Dica: Como a questão fornece valores diferentes de água, temos que calcular a quantidade de sal dissolvida nestas quantidades.
Para 50 mL de água

X= 79,5g de x dissolvido.
Conhecimento para a resolução:
Solução insaturada: quantidade de soluto dissolvido é menor que o estipulado pelo coeficiente.
Solução saturada: quantidade de soluto dissolvido é igual ao estipulado pelo coeficiente.
Solução supersaturada: quantidade de soluto dissolvido é maior que o estipulado pelo coeficiente.
Soluções:
1- Saturada pois a quantidade dissolvida é igual ao coeficiente para 50 mL de água.
2- Insaturada, pois a quantidade dissolvida é menor que a determinada para 100 mL de água.
3- Insaturada, pois a quantidade dissolvida é menor que a determinada para 150 mL de água.
4-Saturada com precipitado, pois a quantidade estipulada é maior que o coeficiente para 100 mL de água.
19-RESP:D
Para determinar a temperatura, vamos calcular a massa de soluto necessária para atingir o coeficiente de solubilidade. De acordo com o gráfico, a quantidade de água é de 1000g.
O enunciado fornece 500g de água e 200g de soluto.
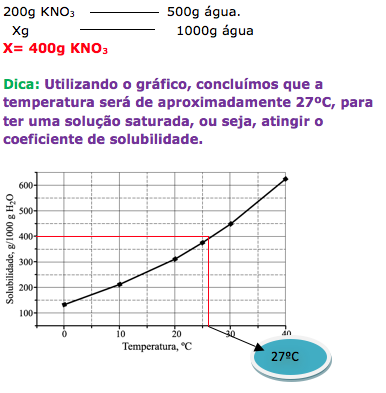
20-RESP:B
A questão diz que preparou duas soluções a 70ºC, onde cada uma contém 70g de soluto em 200g de água. Uma solução foi resfriada até começar a cristalizar. Portanto vamos calcular o quanto de água será necessário para dissolver os 70 gramas de KNO3
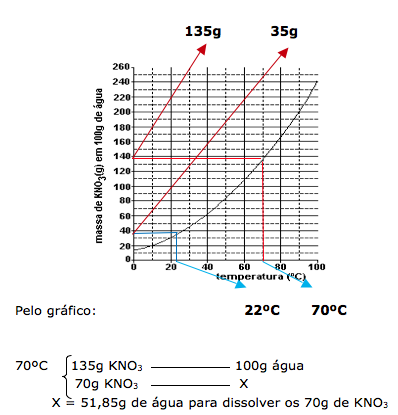
Como temos 200g de água ( 200 – 51,85 =148,15), concluímos que após evaporar 148,15 g de água, o sal começa a precipitar.
Através do gráfico temos que a quantidade de água é de 100g.
Traçando no gráfico vamos achar a temperatura de 22ºC.
21-RESP:A
Através do gráfico podemos determinar o coeficiente a 30ºC e determinar a quantidade de soluto e solvente.
Dica: A questão fornece 750g de solução, isto indica que: soluto + solvente = solução (750g).
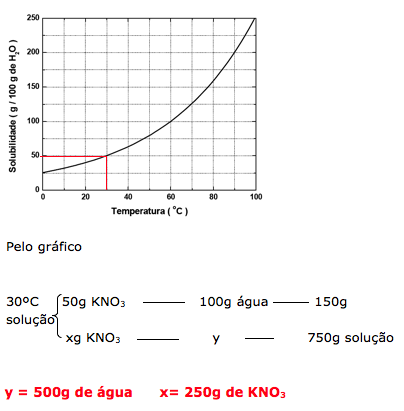
22-RESOLUÇÃO
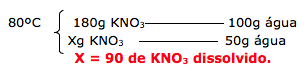
Resfriando até 40ºC
Dica: Quando resfria, a quantidade de água permanece a mesma, ou seja , a quantidade de água a 80ºC é a mesma em 40ºC.
Quanto ao soluto, muda apenas a quantidade que permanece dissolvida.
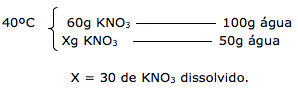
Na temperatura de 80ºC, temos dissolvido 90 gramas de KNO3. Após o resfriamento a 40ºC, apenas 30g permanecem dissolvidos.
Dica: Para calcular o quanto de precipitado será formado, basta apenas realizar a subtração do dissolvido no inicio e no final.
Portanto temos:
90 – 30 = 60g de precipitado.
23-RESOLUÇÃO
Pelo enunciado temos 50g de uma substância A dissolvida em 1 litro (1000g) de água, a 70ºC que é aquecida até evaporar a metade da água. Portanto passamos a ter 500 gramas de água e 50g da substância A.
Esta solução é resfriada até atingir 30ºC.
Analisando o gráfico temos que a 30ºC a solubilidade é de 6g de A em 100g de água. Com isso podemos calcular quanto dos 50g de A permanecem dissolvidos e posteriormente calcular o quanto precipitou.
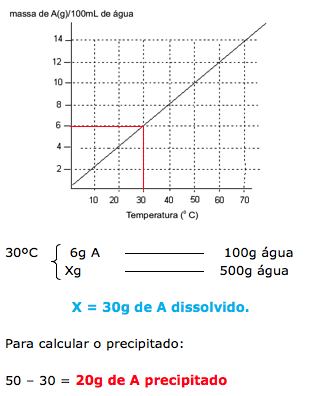
24-RESP:C
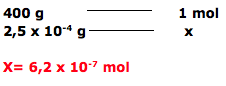
Esta questão refere-se a teoria atômica molecular, onde se deve calcular o número de mols existentes em 0,25mg=0,25 x 10-3g de brometo de ipratrópio.
Dica: massa molar – 1 mol – 6 x 1023 moléculas.
A questão fornece a massa molar igual a 400 g.mol-1
25-RESP:D
Questão que possui enunciado longo, porém a resolução é mais simples.
Dica: Os metais alcalinos-terrosos são aqueles que pertencem a família 2A
Trata-se de um rótulo de água mineral. Concluímos que os sais estão na forma de íons. A tabela fornece a quantidade de íons em mg e a questão pede a massa total de metais alcalinos em mg. Portanto é só somar.
Cálcio + estrôncio + magnésio ( metais alcalino-terrosos)
7,792 + 0,342 + 0,340 = 8,474
RESPOSTA = 8,474 mg/L
26-RESP:E
A questão fornece um enunciado longo que não interfere na resolução do exercício.
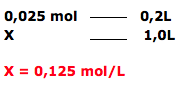
Dica: A reação dada não será utilizada, pois foi apenas uma maneira da aluna recordar as aulas de química. Se você não ficar atento ao enunciado, vai querer balancear a equação que não será usada. O que vamos utilizar é apenas a massa molar do Bicarbonato ( 84 g/mol), o volume do copo d´água ( 200 Ml = 0,2L) e a massa contida no envelope de 2,10 g.
Calcular o número de mols de bicarbonato de sódio(NaHCO3).
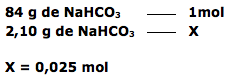
Cálculo do número de mols em 1 litro de solução ( mol/L )
27-RESP:A
Calculo do número de mols do ácido

28-RESP:C
Gasto com a torneira aberta = 12 litros.
Gasto , fechando a torneira = 0,3 L.
Economia: 11,7L
Sabendo-se que a densidade da água é de 1g/ml.
1g ----- 1X10-3L
X ------ 11,7 L
X = 11700 gramas de água
Cálculo do número de moléculas.
18 g de água ------------------ 6 x 1023 moléculas
11700 g água ------------------ x
X = 3,9 x 1026 moléculas de água
29-RESP: B
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de mols do clorometano
1mol ------------ 6 x 1023 moléculas.
X ------------ 6 x 1015 moléculas
X= 1 x 10-8 moléculas de clorometano.
Cálculo do número de mols do diclorometano
1mol ------------ 6 x 1023 moléculas.
X ------------ 1,2 x 1017 moléculas
X= 2 x 10-7 moléculas de diclorometano.
30-RESP: D
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de moléculas do gás sarin
140 g sarin ------------ 6 x 1023 moléculas.
0,5 x 10-3 g ------------ x
X= 2,14 x 1018 moléculas de gás sarin
31-RESP: A
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de moléculas do hidroxocobalamina
1300 g ------------ 6 x 1023 moléculas.
5,0 g ------------ x
X= 2,3 x 1021 moléculas hidroxocobalamina
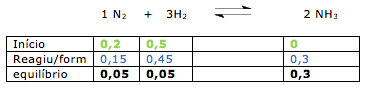
![]() 2 NH3(g)
2 NH3(g)![]() CH3COOH (aq) + OH– (aq)
CH3COOH (aq) + OH– (aq)![]() Mg2+ (aq) + 2 OH– (aq)
Mg2+ (aq) + 2 OH– (aq)![]() 2Ag+(aq) + 1SO4-2(aq)
2Ag+(aq) + 1SO4-2(aq) ![]() 1Pb+2 (aq) + 2Cl-1(aq)
1Pb+2 (aq) + 2Cl-1(aq) 























































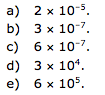




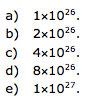
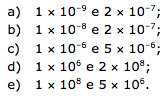
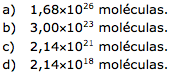
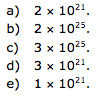


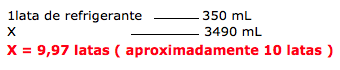
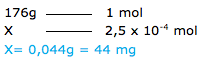


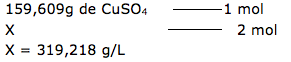
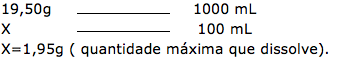
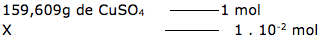
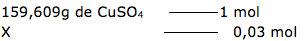





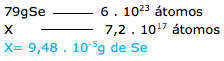






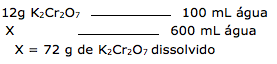




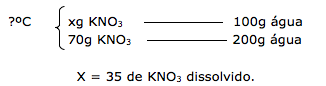





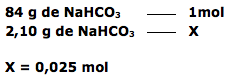



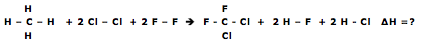
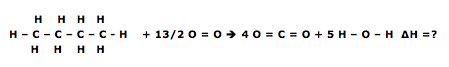
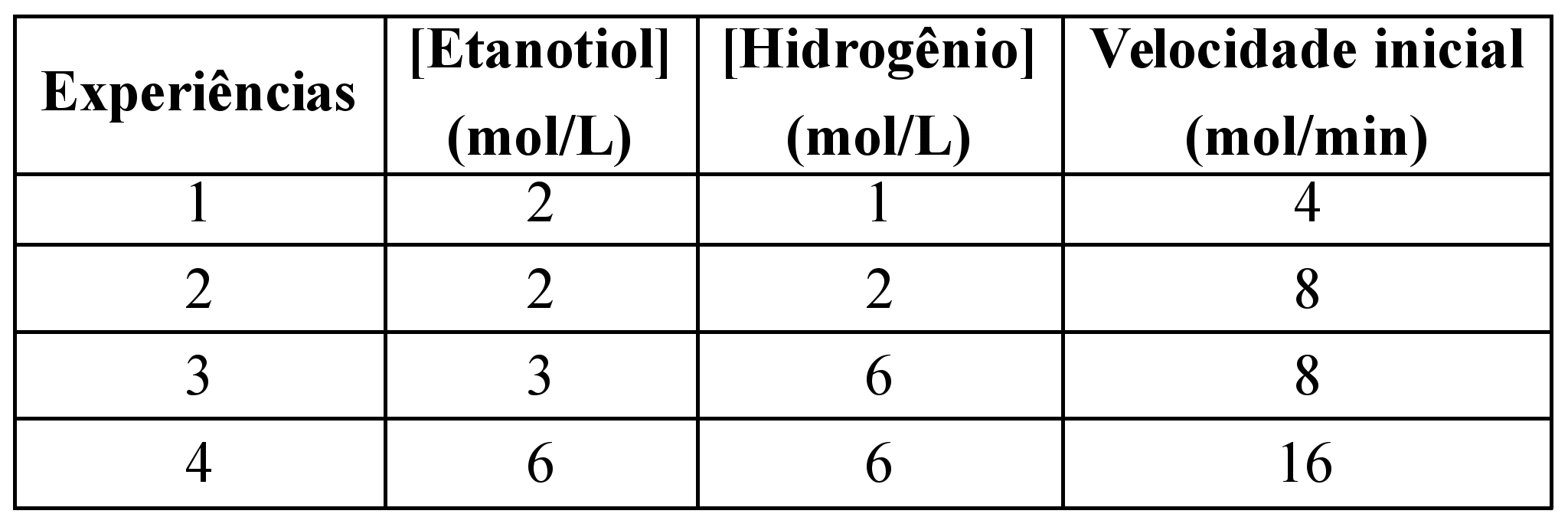
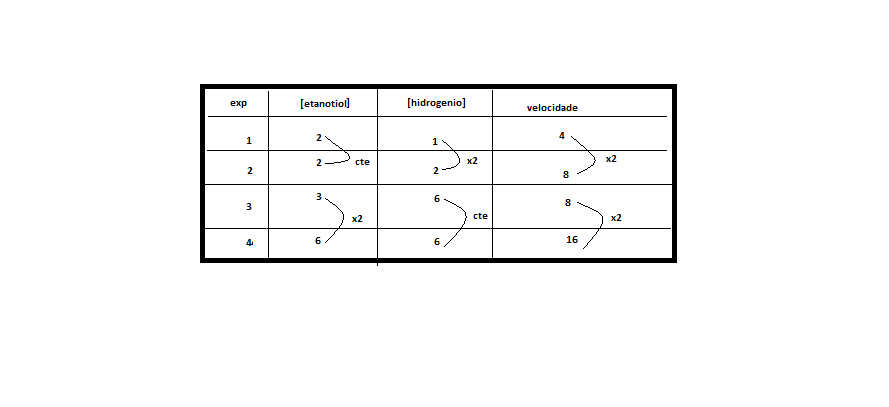
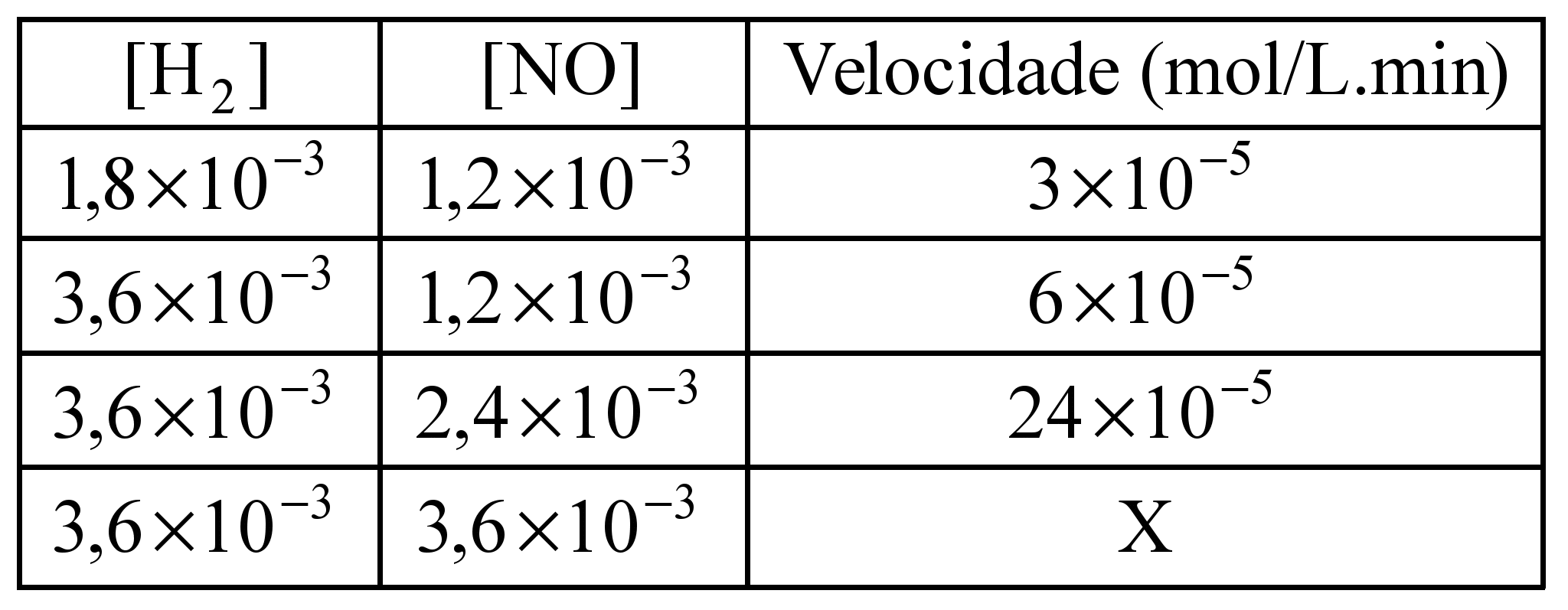
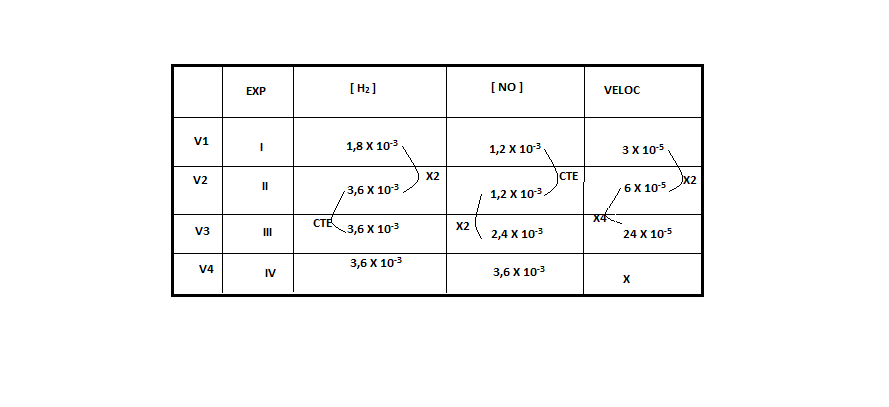
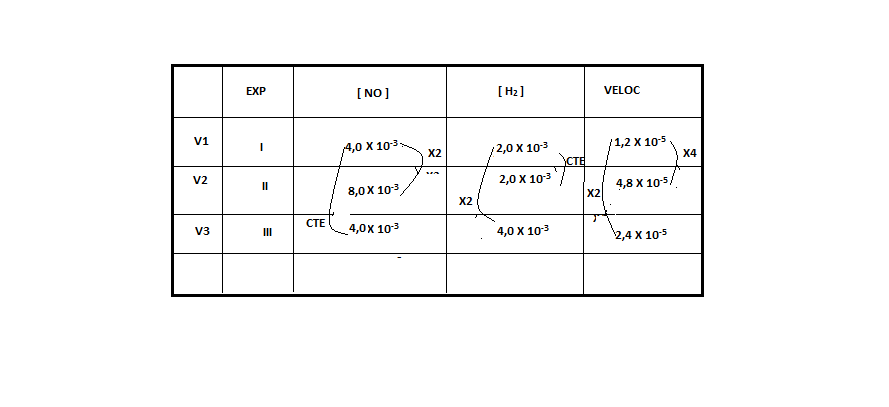
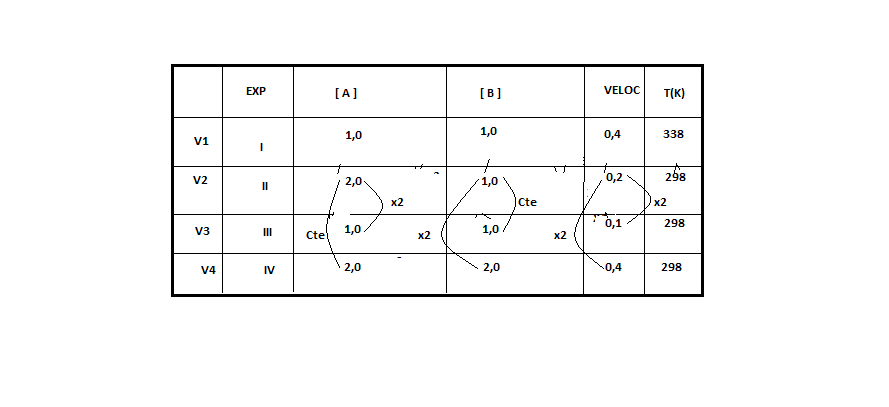
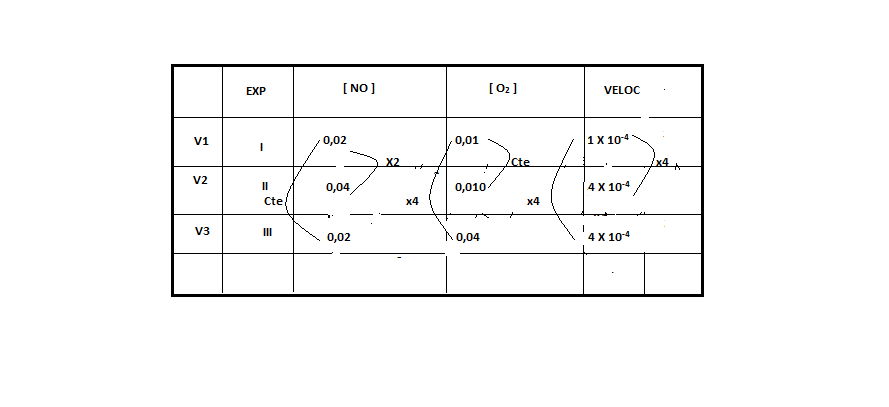
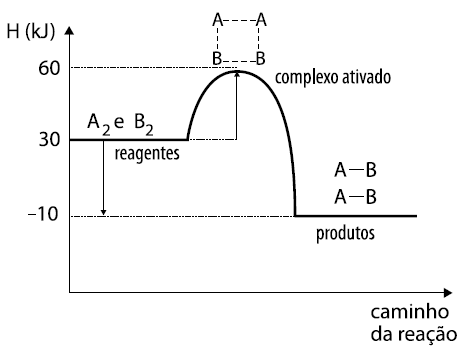
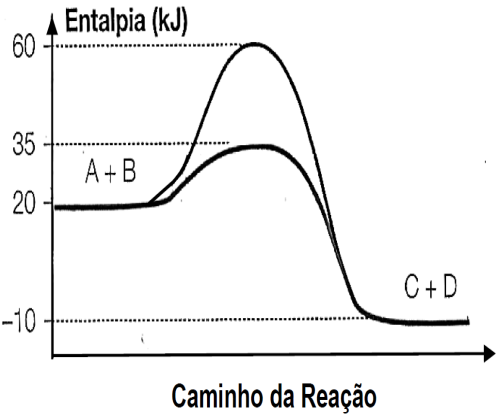
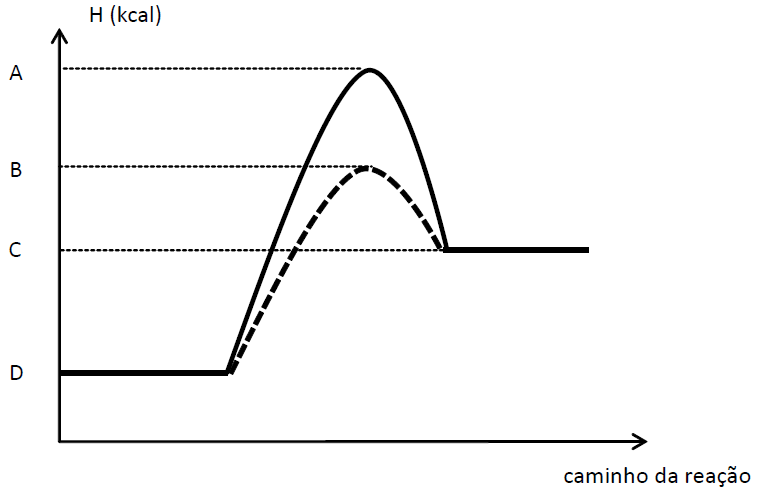
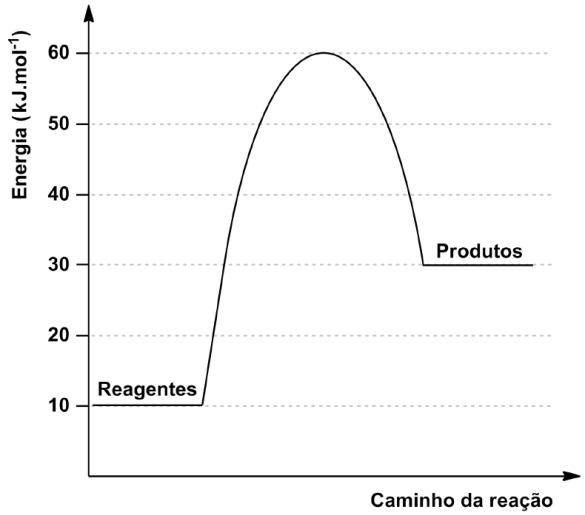
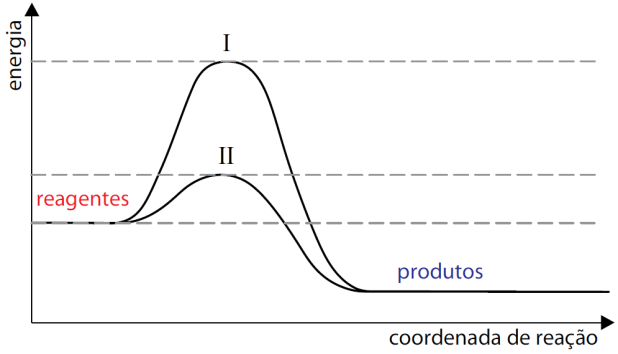
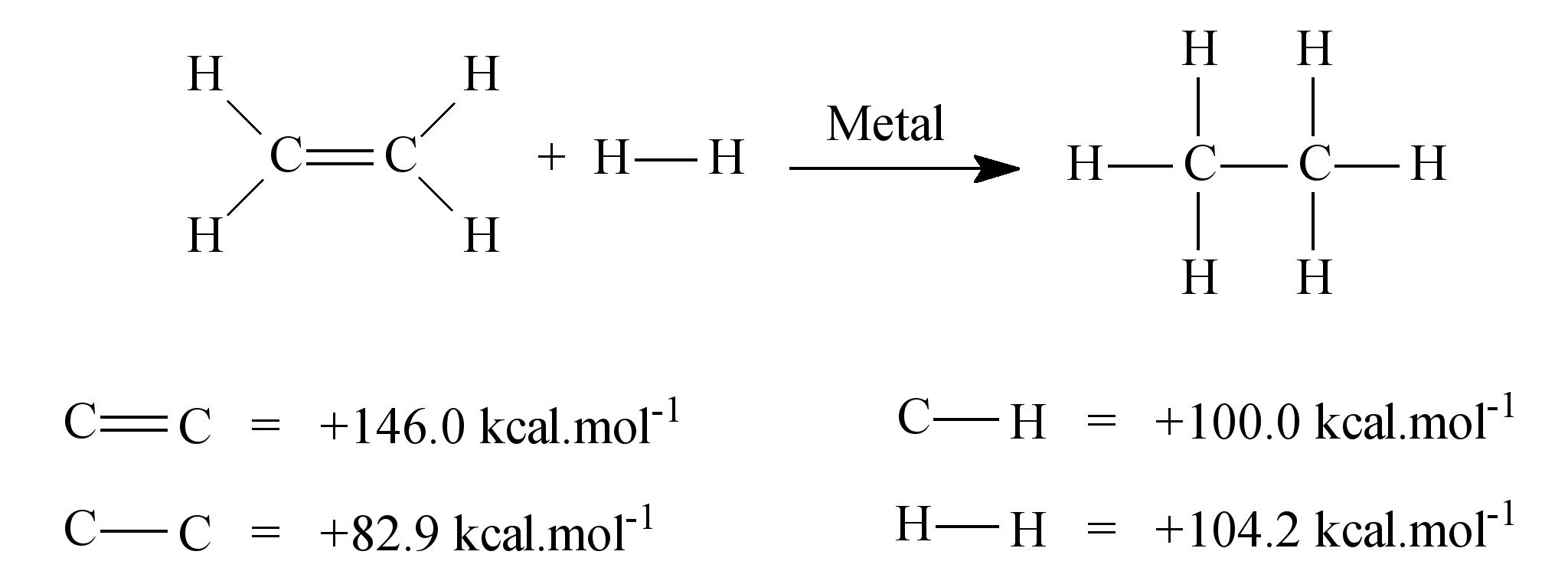

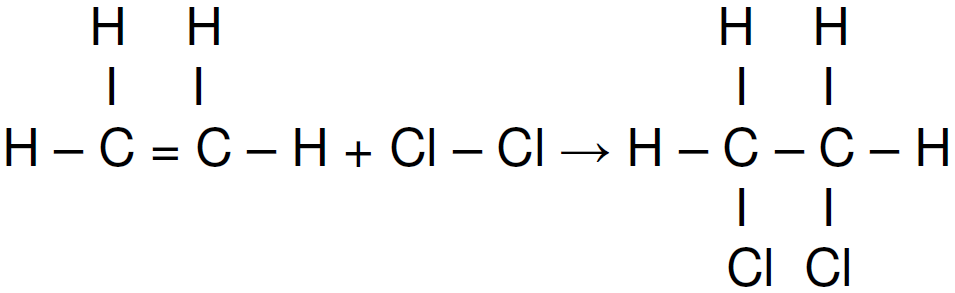
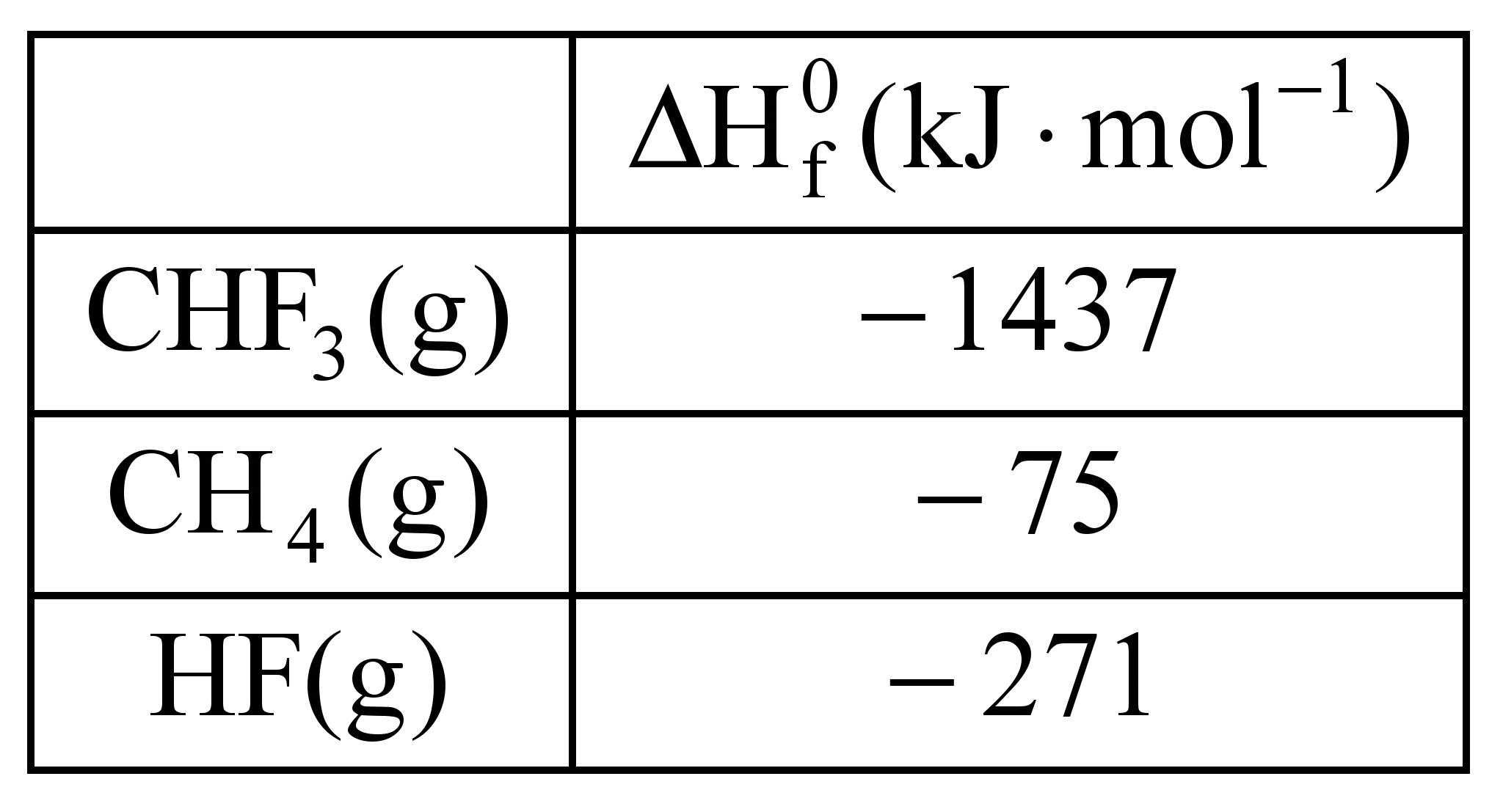
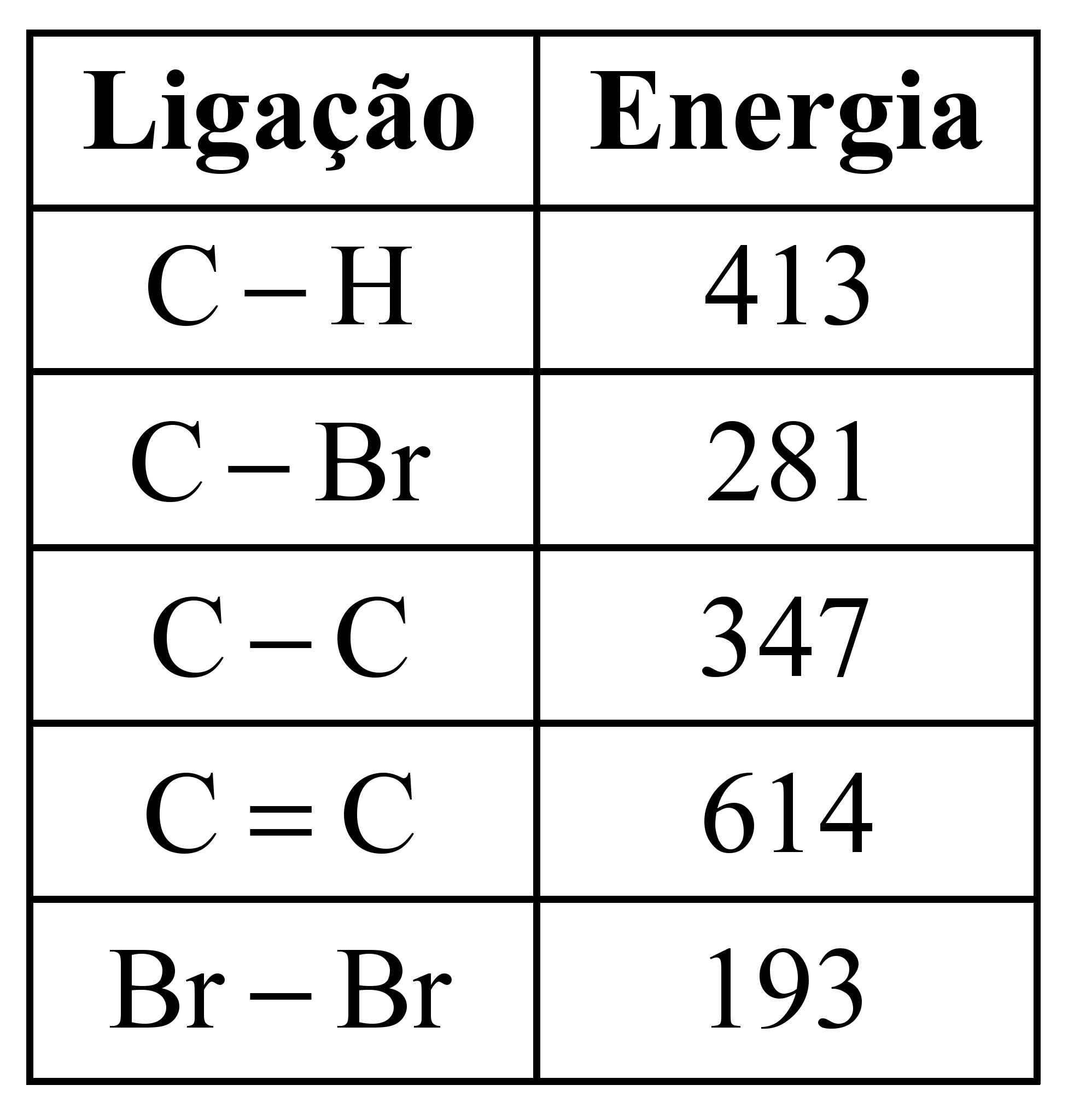


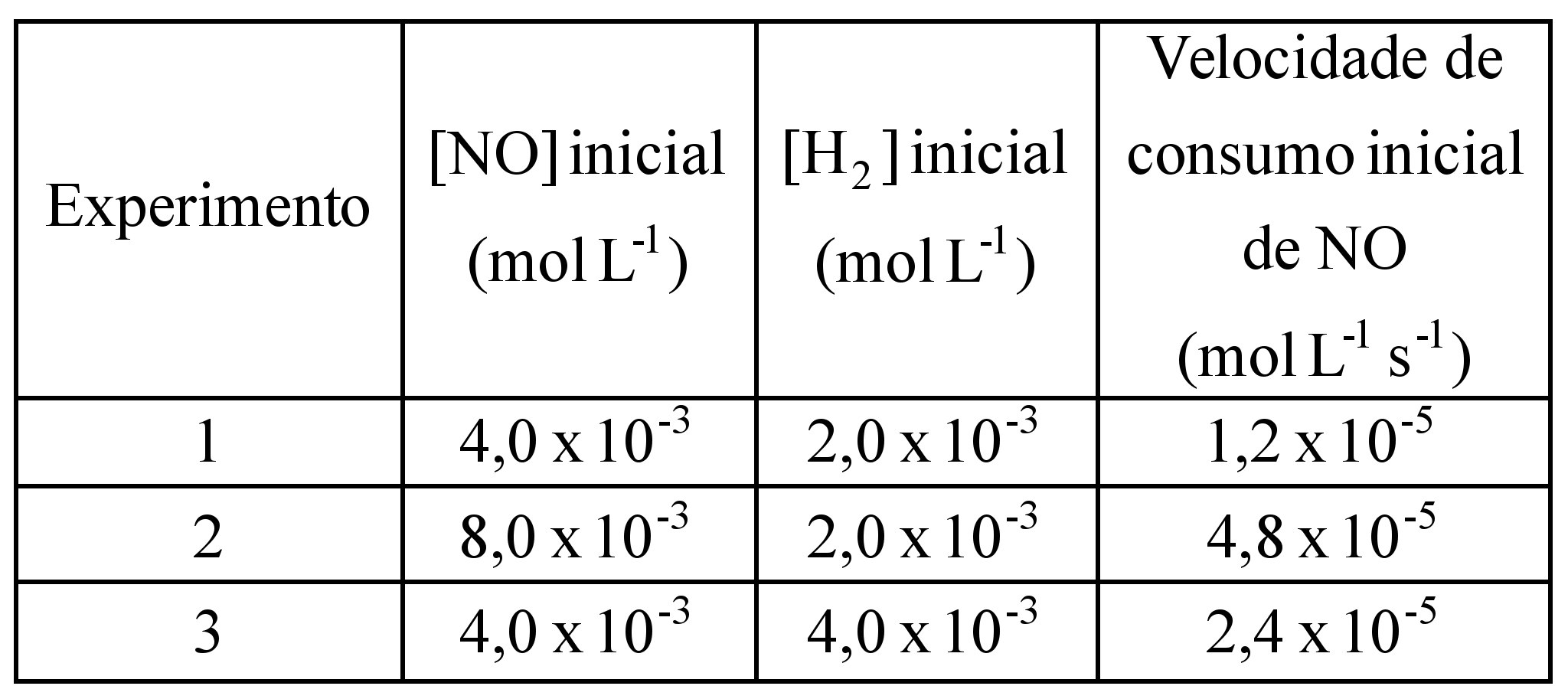
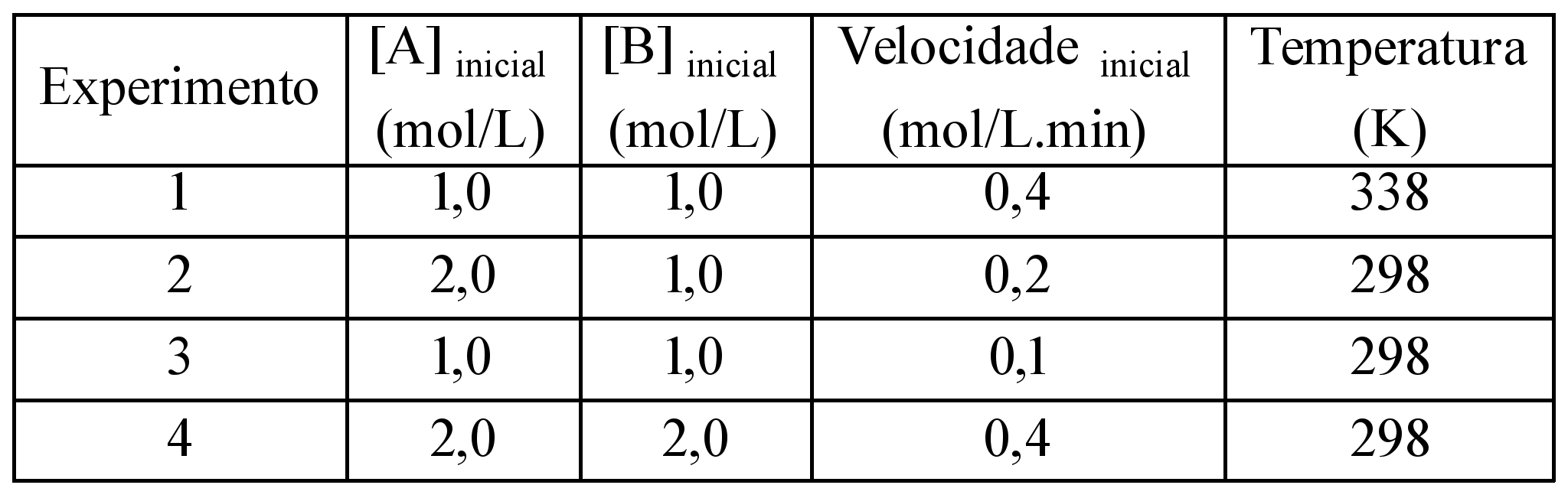
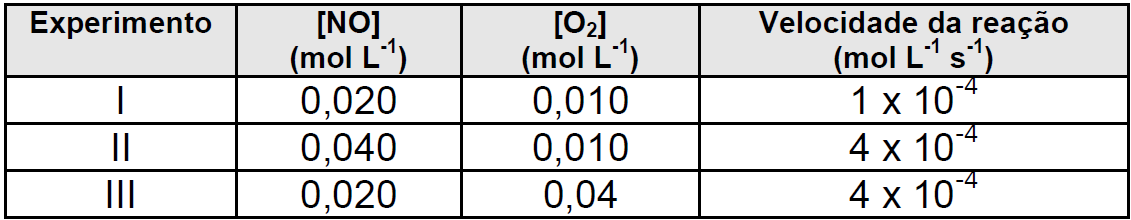
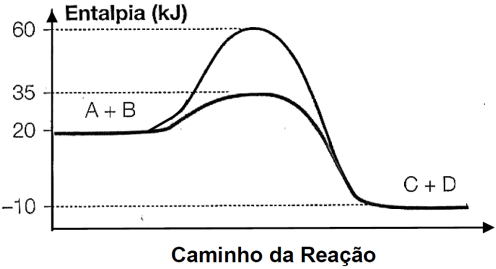
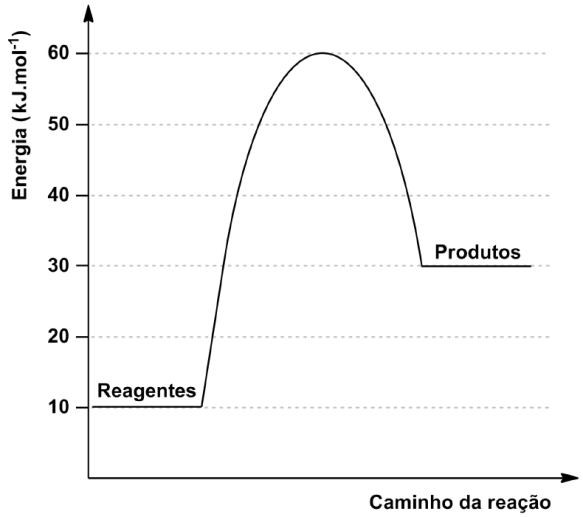
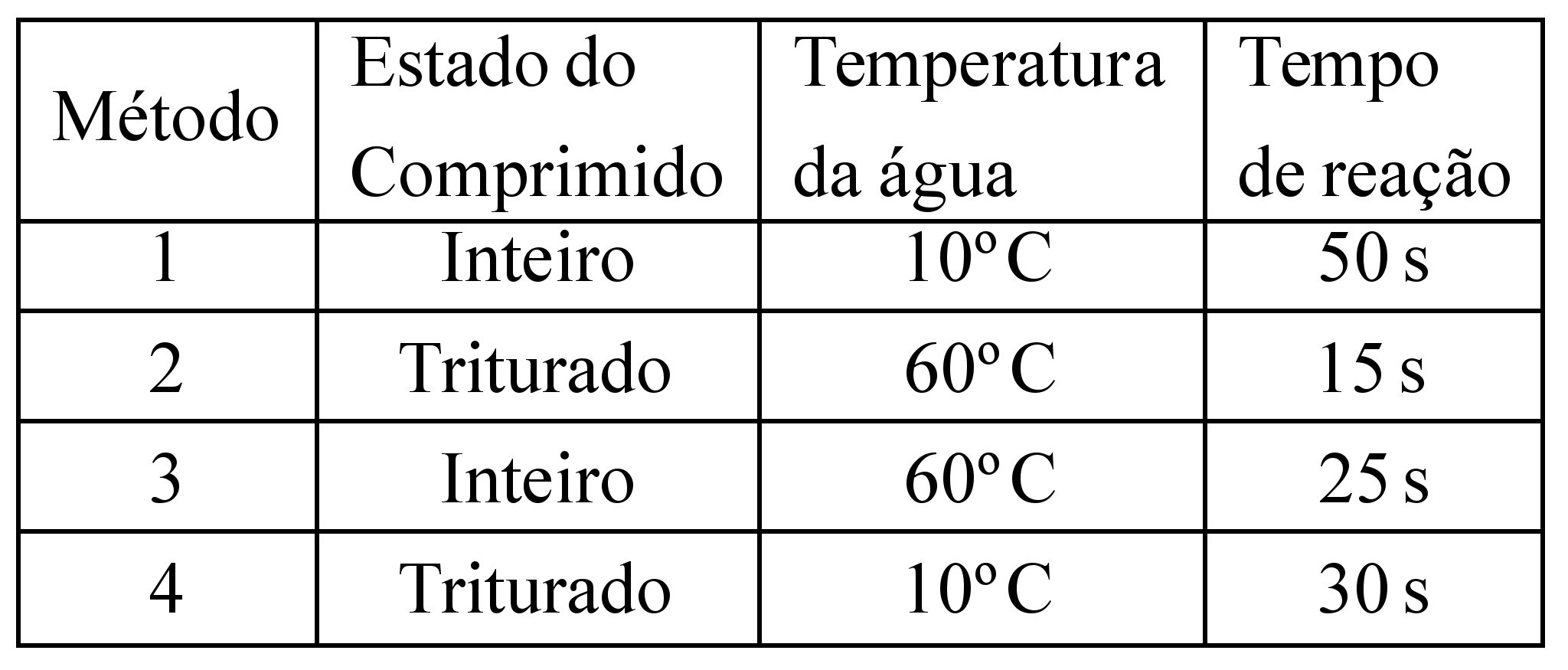
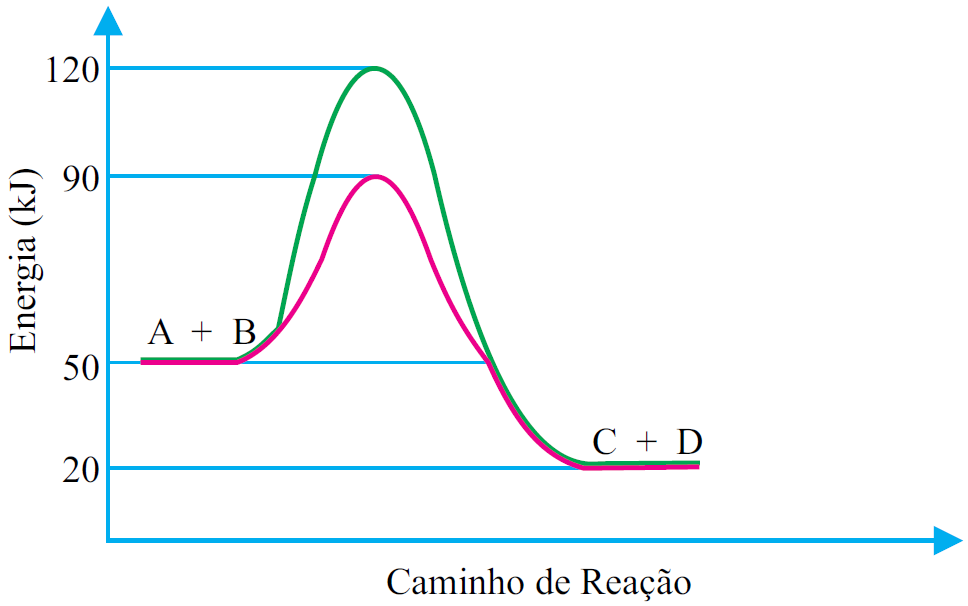 )Calcule a energia de ativação na reação inversa para o caminho não catalisado.
)Calcule a energia de ativação na reação inversa para o caminho não catalisado.














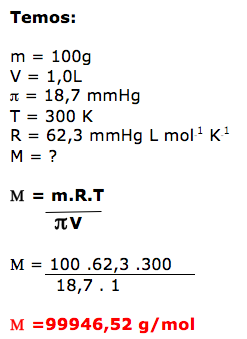






 + 1 = 141 + 92 + 3
+ 1 = 141 + 92 + 3

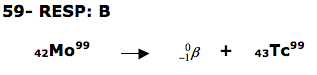


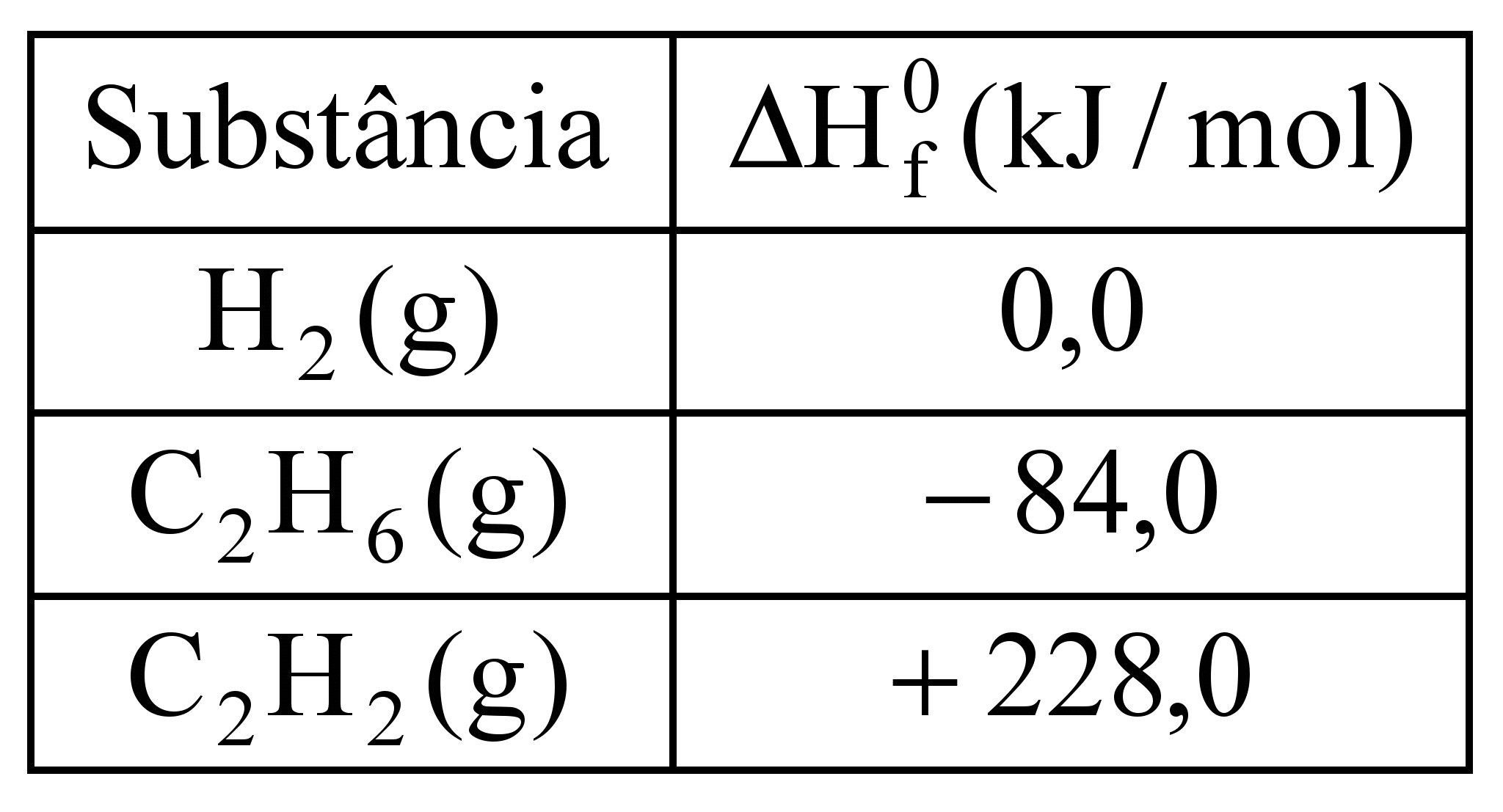
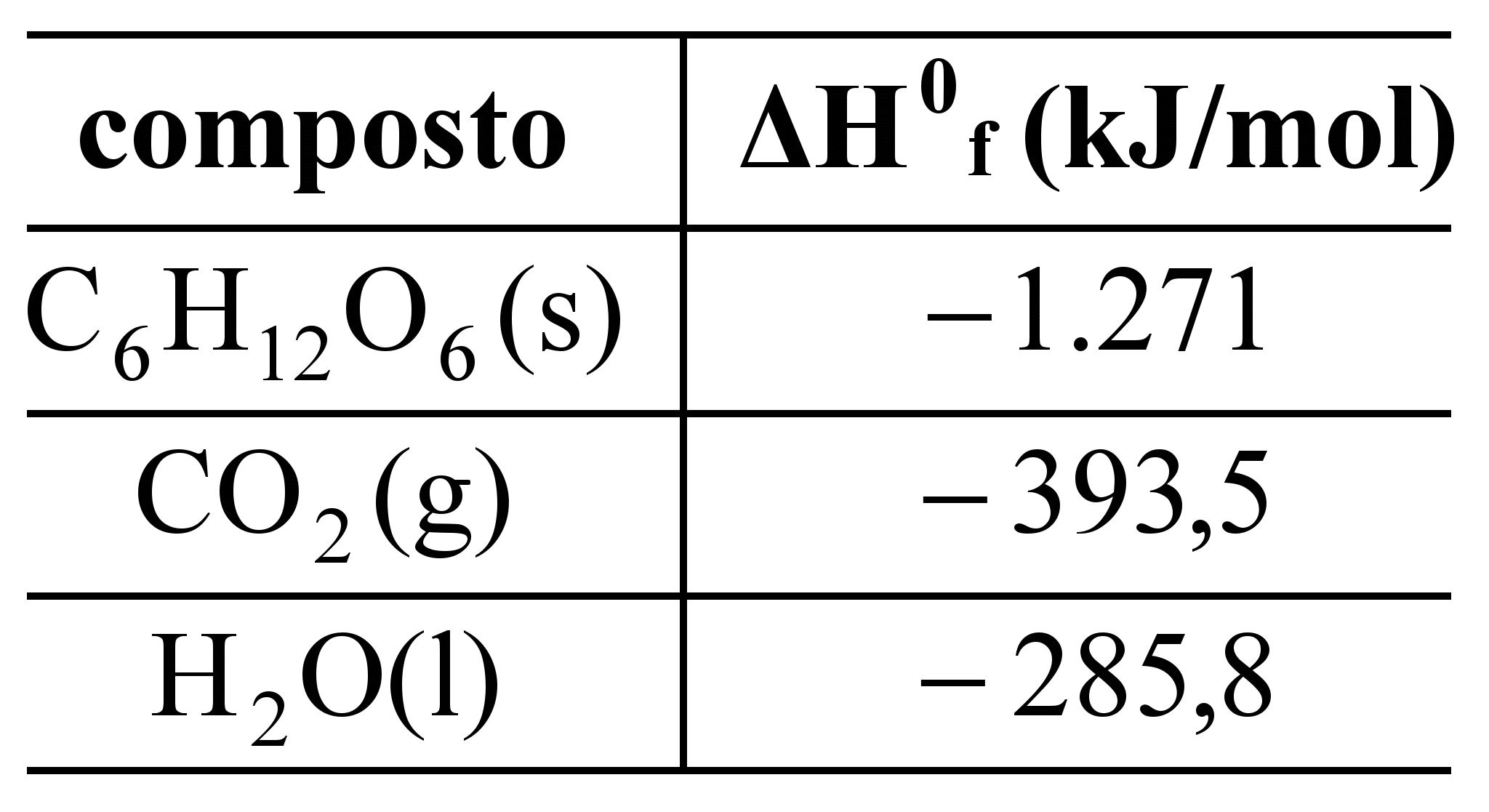
 Retinol
Retinol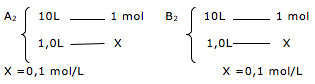
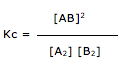
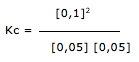
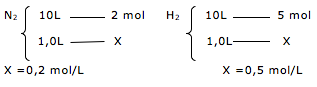
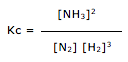
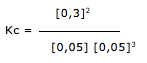
 etanoato de etila + água
etanoato de etila + água