Radioatividade
A Radioatividade é a propriedade que certos elementos químicos (átomos) possuem de emitir espontaneamente partículas e/ ou radiações eletromagnéticas, ou seja, isto ocorre quando um núcleo instável emite radiações sob forma de energia e partículas, transformando-se em um núcleo mais estável.
Os raios X foram observados pela primeira vez em 1895 pelo físico Wilhem Konrad. Já a descoberta da radioatividade remonta a 1896, quando o cientista francês Henri Becquerel realizou as primeiras observações de emissões radioativas em um sal de urânio. Becquerel notou que o minério de urânio conseguia sensibilizar uma placa fotográfica virgem, embrulhada em papel opaco, com a qual estivera em contato; no local formava-se uma mancha escura após a revelação da placa. Becquerel notou também que o minério de urânio era luminoso na escuridão.
Com o prosseguimento das pesquisas verificaram a radioatividade no Tório e em outros elementos. Em 1898 conseguiram isolar um elemento 400 vezes mais radioativo que o urânio e a ele deram o nome de Polônio. Pouco depois um elemento mais radioativo que o polônio foi isolado e recebeu o nome de rádio. Dois anos mais tarde, os cientistas Rutherford e Villard determinaram, simultânea e independentemente, os constituintes das emissões radioativas, por meio da experiência a seguir:
Verifica-se que as emissões radioativas não são formadas por um só tipo de feixe de partículas ou energia. As emissões radioativas são compostas de três tipos de radiação, denominadas de alfa (α), beta (β) e gama (γ). A radiação atraída pela placa negativa do campo elétrico é denominada radiação α, aquela atraída pela placa positiva é denominada radiação β e finalmente, a radiação que atravessa o campo elétrico sem sofre desvio é denominada de radiação γ.
|
Assim, os elementos radioativos naturais emitem espontaneamente, a partir do seu núcleo, três tipos de radiações. Esse processo denomina-se desintegração nuclear. |
- Radiações alfa
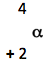
-
São partículas pesadas ( sofrem pequeno desvio ).
-
Possuem carga elétrica relativa = +2
-
Possui massa = 4 u
-
Velocidade média em torno de 5 % da velocidade da luz e pequeno poder de penetração. As quais são detidas por uma camada de 7 cm de ar, uma lâmina de Al de 0,06 mm ou camada de células mortas da pele.
Radiações beta
![]()
-
Carga elétrica relativa = -1
-
Massa = massa de um elétron ( praticamente desprezível).
-
São partículas leves ( sofrem grande desvio).
-
Velocidade média em torno de 95 % da velocidade da luz.
-
Médio poder de penetração são detidas por alguns metros de ar e podem penetrar até 2 cm no corpo humano e causar sérios danos.
Radiações gama
![]()
-
Não possuem carga elétrica e nem massa.
-
São ondas eletromagnéticas que usualmente acompanham as emissões alfa e beta.
-
Possuem velocidade igual à da luz e são aproximadamente cem vezes mais penetrantes que as partículas beta, portanto tendo mais energia do que elas. As radiações gama são do mesmo tipo que os raios X, porém com menor comprimento de onda e com muito mais energia.
-
São detidos por 25 cm de madeira, lâmina de 15 cm de aço, ou placa de chumbo com mais de 5 cm ou grossas paredes de concreto.
-
Atravessam milhares de metros de ar.
Leis da radioatividade
-
Lei de Sody
|
Quando um núcleo emite uma partícula α, forma-se um novo núcleo com número de massa quatro unidades menor e número atômico duas unidades menor. |
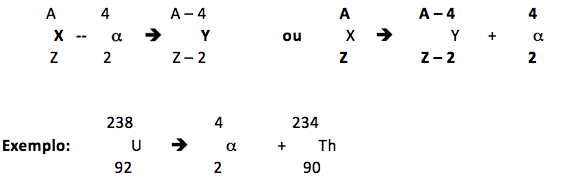
-
Lei de Sody, Fajans e Russel
|
Quando um núcleo emite uma partícula β, forma-se um novo núcleo com igual número de massa, e número atômico uma unidade maior. |

Quando ocorre a emissão de uma partícula beta, um nêutron presente no núcleo se decompõe e dá origem a um próton, a um elétron e a uma subpartícula atômica, denominada antineutrino. O próton permanece no núcleo, o elétron e o antineutrino ( com carga zero e massa aproximadamente zero) são emitidos, de acordo com o esquema:
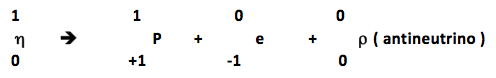

Alguns termos utilizados:
Nuclídeo : é o nome dado a um núcleo caracterizado por um nº. atômico e um nº. de massa.
Radionúclideo ou radiosótopo: é um núcleo emissor de radiação.
Meia vida ou período de semi desintegração ( P) :
Tempo necessário para que a massa radioativa inicial de uma amostra se reduza à metade.
Exemplo: Após 40 dias um determinado radiosótopo cuja meia vida é de 10 dias, pesa 0,5 gramas. Calcule a sua massa inicial
M = m0 / 2x onde : m0 = massa inicial . m = massa final após o tempo T ; x = nº. de períodos transcorridos
T = x P
Portanto temos : m = 0,5 gramas m0 = ? x = 40/10 = 4.
-
m0 = 0,5 . 16 = 8,0 gramas
Utilização dos radiosótopos
Os radiosótopos são utilizados:
-
Na indústria: são empregados na fabricação de pilhas elétricas ( pilhas nucleares), as quais funcionam ininterruptamente por mais de um ano sem a necessidade de serem recarregadas, as quais são empregadas nos satélites artificiais e na obtenção de luz, nas bóias marítimas, nos faróis situados em ilhas isoladas, na conservação de alimentos (estes duram mais, sem perder o valor).
-
Na medicina: além da cura de tumores, hoje se emprega o radiosótopo iodo-131 na cura das doenças da tireoide ( hipotireoidismo que impede o crescimento de jovens).
-
Na agricultura: São empregados na seleção de fertilizantes mais eficazes, na obtenção de novas variedades de vegetais, que produzam frutos maiores e melhores.
-
Na mineralogia: empregam-se radiosótopos na prospecção de jazidas petrolíferas e de minerais.
-
Nos transportes: Atualmente, mais de uma centena de submarinos nucleares sulcam os mares ( munidos, naturalmente de foguetes dotados de ogivas nucleares). Existem também cruzadores, porta-aviões, um navio quebra-gelo e um navio marcante, todos movidos com energia nuclear.
Fissão Nuclear.
É o nome que se dá ao processo pelo qual, bombardeando um núcleo grande com uma partícula acelerada, ocorre divisão deste núcleo em outros menores e mais estáveis, liberando-se grande quantidade de energia, chamada de energia nuclear. A primeira divisão nuclear foi realizada em 1939 por Otto Hahn e Strassman:

Os dois nêutrons produzidos irão atingir dois novos núcleos de urânio, e assim sucessivamente, continuando o processo por uma reação em cadeia. A energia liberada é tão grande, que faz explodir a massa de urânio. A bomba atômica se baseia na fissão de U – 235. Para haver explosão é necessária existir uma quantidade mínima de urânio, que é chamada de massa crítica.
O uso da fissão para fins pacíficos consiste no controle da energia nuclear em reatores, a fim de produzir eletricidade. Nos reatores atômicos, ocorre a emissão controlada de energia.
Outro processo para impedir a reação em cadeia ( detonação) é a utilização de urânio-235, impurificado com seu isótopo, o urânio-238, neste caso a mistura isotópica ( não natural) recebe o nome de urânio enriquecido. O urânio enriquecido é realmente o mais utilizado nos reatores atômicos.
Fusão Nuclear.
Consiste na união de núcleos, dando origem a um núcleo maior e mais estável, havendo emissão de grande quantidade de energia. Para ocorrer à fusão nuclear, são necessárias altas temperaturas para que ocorra a fusão nuclear. A bomba de hidrogênio baseia-se no processo da fusão e é detonada por uma pequena bomba A ( bomba atômica), que fornece as altas temperaturas necessárias.
Enriquecimento do Urânio
O urânio- 235 é o único capaz de sofre fissão. No entanto, só 0,7% do urânio encontrado na natureza é constituído por esse isótopo. Desse modo, para que seja possível utilizá-lo como combustível de usinas nucleares ou em armas atômicas, é necessário enriquecer o urânio natural, isto é obter uma porcentagem muito maior de urânio-235.
Um dos métodos de enriquecimento utilizados consiste em “filtrar” o urânio através de membranas muito finas. O urânio-235, mais leve atravessa esse coador um pouco mais rápido do que o urânio-238. Para se conseguir uma quantidade suficiente de combustível com níveis satisfatórios do urânio-235, algo em torno de 3% do total da amostra, é preciso repetir a operação inúmeras vezes. Aparentemente simples, esse processo é complexo e dispendioso, pouquíssimos países do mundo possuem tecnologia e recursos para levá-lo adiante em escala industrial.
Principais aplicações dos radiosótopos.
-
Cobalto – 60 : é um radiosótopo utilizado no tratamento do câncer, pois emite partículas beta.
-
Iodo radioativo: Usado no tratamento das doenças da tireóide.
-
Carbono-14: existe em seres animais e vegetais, e é utilizado na determinação da idade dos fósseis, determinação da idade da Terra pela dosagem de teor em chumbo em minerais de urânio, medição na indústria, da espessura de lâminas e fios de aço, utilizando uma fonte de partícula beta, esterilização de alimentos por fontes de raios gama e em pesquisas bot6anicas, provocam-se mutações em sementes por aplicações radioativas.

