Revisão Dissertativa
Revisão Dissertativa
Nesta área do site você encontrará diversas listas de exercícios dissertativas de química resolvidas
Nesta área do site você encontrará diversas listas de exercícios dissertativas de química resolvidas
AULA 04
ELETROQUÍMICA
QUÍMICA DESCRITIVA
TERMOQUÍMICA
ESTEQUIOMETRIA
01 - (MACK SP/2014-MOD)
A respeito da equação iônica de oxirredução abaixo, não balanceada, são feitas as seguintes afirmações:
IO3– + HSO3– → I2 + SO42– + H+ + H2O
I. a soma dos menores coeficientes inteiros possível para o balanceamento é 17.
II. o agente oxidante é o ânion iodato.
III. o composto que ganha elétrons sofre oxidação.
IV. o Nox do enxofre varia de +5 para +6.
Das afirmações acima,quais estão corretas?
02 - (ITA SP/2013)
Por exposição à atmosfera ambiente, o hidróxido de cálcio hidratado (cal hidratada) produz um filme que é utilizado na proteção de superfícies de alvenaria em um processo denominado “caiação”. Escreva a(s) equação(ões) química(s) balanceada(s) da(s) reação(ões) que representa(m), respectivamente,:
a) a formação do filme acima citado, e
b) o processo de produção industrial da cal hidratada.
03 - (FGV SP-MOD)
O Teflon é um polímero sintético amplamente empregado. Ele é formado a partir de um monômero que se obtém por pirólise do trifluormetano.
O trifluormetano, CHF3, é produzido pela fluoração do gás metano, de acordo com a reação
CH4(g) + 3F2(g) CHF3(g) + 3 HF(g).
Dados:
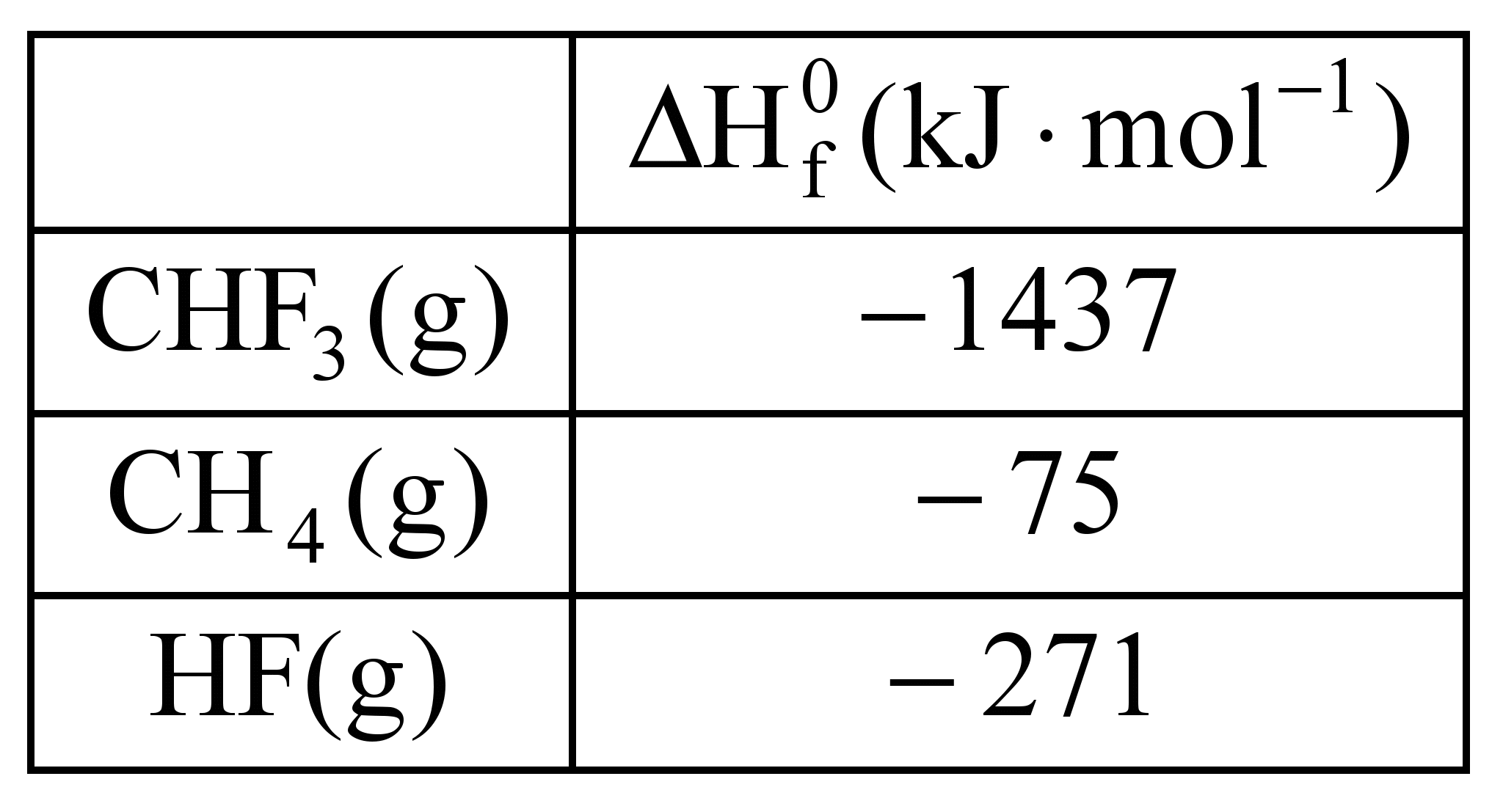
Qual a entalpia (ΔH) padrão da reação de fluoração do gás metano, em kJ.mol–1?
04 - (FGV SP/2014-MOD)
Para otimizar as condições de um processo industrial que depende de uma reação de soluções aquosas de três diferentes reagentes para a formação de um produto, um engenheiro químico realizou um experimento que consistiu em uma série de reações nas mesmas condições de temperatura e agitação. Os resultados são apresentados na tabela:
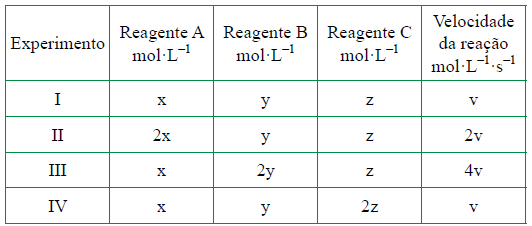
Após a realização dos experimentos, qual a ordem global da reação estudada ?
05 - (UNICAMP SP)
Uma maneira de se produzir ferro metálico de uma forma “mais amigável ao meio ambiente” foi desenvolvida por dois cientistas, um norte-americano e um chinês, que constataram a surpreendente solubilidade dos minérios de ferro em carbonato de lítio líquido, em temperaturas ao redor de 800°C. No processo, a eletrólise dessa solução, realizada com uma corrente elétrica de alta intensidade, leva à separação dos elementos que compõem os minérios e à produção do produto desejado.
a) O artigo que relata a descoberta informa que os elementos que formam o minério são produzidos separadamente em dois compartimentos, na forma de substâncias elementares. Que substâncias são essas? Dê os nomes e as fórmulas correspondentes.
b) O processo atual de obtenção de ferro consiste na utilização de alto forno, que funciona a uma temperatura entre 1300 e 1500°C, com adição de carbono para a reação de transformação do minério. Considerando todas as informações dadas, apresente duas diferenças entre o processo atual e o novo. Explique, separadamente, como essas diferenças justificam que o novo processo seja caracterizado como “mais amigável ao meio ambiente”.
06 - (FMJ SP/2014-MOD)
Suponha que a corrente elétrica de 8 amperes produzida pela célula a combustível mais eficiente que os pesquisadores conseguiram construir seja utilizada para realizar a eletrólise de 10 litros de uma solução aquosa de sulfato de cobre (II) de concentração igual a 0,5 mol/L. Sabendo-se que a constante de Faraday é igual a 96 500 C/mol, para que todos os íons Cu2+presentes na solução sejam reduzidos a cobre metálico no cátodo, estima-se que o tempo necessário, em horas, seja de, aproximadamente igual a quanto?
07 - (UNESP SP/2014)
A hidrazina, substância com fórmula molecular N2H4, é um líquido bastante reativo na forma pura. Na forma de seu monoidrato, N2H4 · H2O, a hidrazina é bem menos reativa que na forma pura e, por isso, de manipulação mais fácil. Devido às suas propriedades físicas e químicas, além de sua utilização em vários processos industriais, a hidrazina também é utilizada como combustível de foguetes e naves espaciais, e em células de combustível.
A atuação da hidrazina como propelente de foguetes envolve a seguinte sequência de reações, iniciada com o emprego de um catalisador adequado, que rapidamente eleva a temperatura do sistema acima de 800 ºC:
3 N2H4 (L) → 4 NH3 (g) + N2 (g)
N2H4(L) + 4 NH3 (g) → 3 N2 (g) + 8 H2 (g)
Dados:
Massas molares, em g · mol—1: N = 14,0; H = 1,0
Volume molar, medido nas Condições Normais de Temperatura e Pressão (CNTP) = 22,4 L
Calcule a massa de H2 e o volume total dos gases formados, medido nas CNTP, gerados pela decomposição estequiométrica de 1,0 g de N2H4 (L).
1-Resolução
Para resolver esta questão, primeiro vamos determinar o NOX de cada elemento.
Para balancear a equação.
1º passo: Determinar uma variação de NOX para o enxofre = Δ = 6 – 4 = 2
Determinar uma variação de NOX para o iodo = Δ = 0 – 5 = 5
2º passo: Multiplicar pela atomicidade ( nº. de átomos ) o enxofre possui atomicidade igual a 1. Portanto será 2 x 1 = 2
Multiplicar pela atomicidade ( nº. de átomos ) o iodo possui atomicidade igual a 2. Portanto será 5 x 2 = 10
3º passo: Os números encontrados são múltiplos, indicando que podemos simplificar tudo por 2. Encontramos S = 1 e I = 5
4º passo: Invertemos os valore e colocamos os números para realizar o balanceamento, sendo que término do balanceamento é pelo método da tentativa.
2 IO3– + 5 HSO3– → I2 + 5 SO42– + 3 H+ + H2O
Concluímos que apenas as afirmações I e II são corretas.
2-RESOLUÇÃO
Esta questão é sobre química descritiva, onde fala sobre a produção do hidróxido de cálcio.
a) Na caiação o hidróxido de cálcio reage com o CO2 da atmosfera.
Reação : Ca(OH)2 (aq) + CO2 (g) CaCO3(s) + H2O.
b) A cal hidrata é obtida pela reação:
CaO(s) + H2O Ca(OH)2 (aq)
3-Resolução
Questão envolve termoquímica, onde é dado o valor de entalpia da substância, portanto vamos resolver utilizando ΔH = HP - HR
Dados:
ΔH = HP - HR ΔH = - 2250 – ( - 75 ) = - 2175 kJ
ΔH = - 2175 kJ
4-Resolução
Esta questão envolve cinética química. A questão fornece uma tabela, indicando que temos que determinar a equação da velocidade.

V = K [A]X [B]Y [C]Z
Para determinar os expoentes, temos que deixar duas variáveis constantes.
Para determinar o x vamos deixar o y e o z constantes. Encontramos essa situação em I e II.
Notamos que a velocidade dobra e a concentração também dobra.
V2/V1 = 2 = 2X X = 1
Para determinar o y, vamos deixar o x e o z constantes. Encontramos essa situação em I e III.
Notamos que a velocidade aumenta 4 vezes e a concentração dobra.
V3/V1 = 4 = 2y y = 2
Para determinar o z, vamos deixar o y e o x constantes. Encontramos essa situação em I e IV.
Notamos que a velocidade permanece constante e a concentração dobra.
V4/V1 = 1 = 2z z = 0
Temos a lei da velocidade igual
V = K [A]1 [B]2
- Ordem 1 em relação a A.
- Ordem 2 em relação a B.
- Ordem da reação igual a 3
5-Resolução
Esta questão é sobre Química descritiva, basicamente sobre a produção do ferro.
Considerando a hematita (Fe2O3) como o principal minério de ferro, devemos considerar a dissociação em íons:
Para o processo da eletrólise temos:

b) A temperatura no processo “amigável”, é mais baixa favorecendo o meio ambiente. Também não ocorre a formação de poluentes que prejudica o meio ambiente, pois no processo atual o ocorre a formação de gases poluentes como o CO e o CO2.
Processo atual (resumido):
6-Resolução
Questão envolvendo eletrólise ( faraday)
1F = 96500 C = 1 mol e-
Q = i. t
A questão fornece a concentração molar da solução de CuSO4 e o volume. Portanto conseguimos calcular a massa obtida.
[ ] = 0,5 mol/L V = 10 L n = ?
[ ] = n/v n = 5 mol
CuSO4 Cu+2 + SO4-2
Cu+2 + 2e- Cu0
1 mol Cu+2 ------------- 2e-
10 mol Cu+2 ----------- x
X = 10 mol e- Cu+2
PORTANTO
2 (96500) C ....... 2 mol e-
X ..................... 10 mol e-
X = 965000 C
Q = i . t
T = 965000 / 8 = 120625 segundos
1h ………… 3600 s
X ............. 120625 s
X = 33,50 h
7-RESOLUÇÃO
A partir das reações fornecidas, podemos obter uma reação global e realizar os cálculos.
Agora é determinar a massa molar das substâncias envolvidas e calcular a massa de H2, quando for decomposto 1 g de N2H4.
4 N2H4(l) → 4 N2 (g) + 8 H2 (g)
128 g --------------------- 16 g
1g ------------------------ x
X = 0,125 g de H2
Agora é determinar a o volume total dos gases e calcular o volume nas CNTP, quando for decomposto 1 g de N2H4.
4 N2H4(l) → 4 N2 (g) + 8 H2 (g)
Pela reação, temos a formação de 12 mols de gás ( 4 + 8 = 12 ).
DICA: 1 mol de gás nas CNTP = 22,4 L
1 mol gás ------------- 22,4 L
12 mol gás ------------ x
X = 268,8 L
Calcular para a decomposição de 1 gramas de N2H4.
4 N2H4(l) → 4 N2 (g) + 8 H2 (g)
128 g -------- 268,8 L (TOTAL DE GÁS )
1 g --------- x
X = 2,1 L
AULA 01
ESTEQUIOMETRIA
TERMOQUÍMICA
GASES
ELETROQUÍMICA
01 - (UFG GO/2013)
O hidróxido de alumínio é um composto químico utilizado no tratamento de águas. Uma possível rota de síntese desse composto ocorre pela reação entre o sulfato de alumínio e o hidróxido de cálcio. Nessa reação, além do hidróxido de alumínio, é formado também o sulfato de cálcio. Assumindo que no processo de síntese tenha-se misturado 30 g de sulfato de alumínio e 20 g de hidróxido de cálcio, determine a massa de hidróxido de alumínio obtida, o reagente limitante da reação e escreva a equação química balanceada da síntese. Dados: H = 1 O = 16 Al = 27 Ca = 40 S = 32
02 - (UNICAMP SP/2015)
Um importante fator natural que contribui para a formação de óxidos de nitrogênio na atmosfera são os relâmpagos. Considere um espaço determinado da atmosfera em que haja 20 % em massa de oxigênio e 80 % de nitrogênio, e que numa tempestade haja apenas formação de dióxido de nitrogênio. Supondo-se que a reação seja completa, consumindo todo o reagente limitante, pode-se concluir que, ao final do processo, a composição percentual em massa da atmosfera naquele espaço determinado será aproximadamente igual a quanto? Dados: O = 16 N = 14
03 - (FUVEST SP/2015)
A figura abaixo ilustra as estabilidades relativas das espécies que apresentam estado de oxidação +2 e +4 dos elementos da mesma família: carbono, silício, germânio, estanho e chumbo.
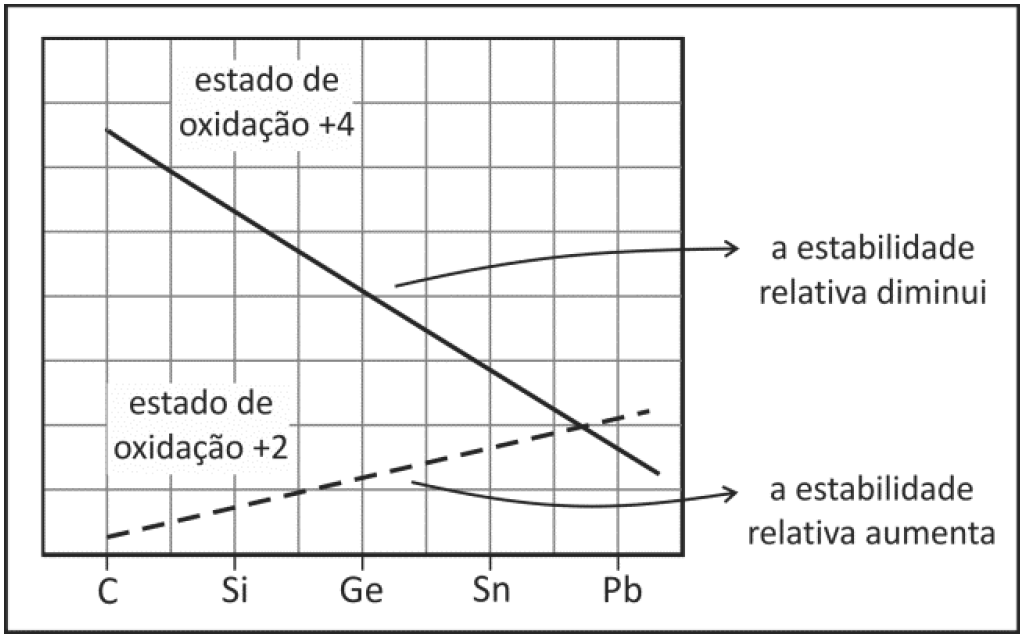
As estabilidades relativas podem ser interpretadas pela comparação entre potenciais padrão de redução das espécies +4 formando as espécies +2, como representado a seguir para os elementos chumbo (Pb), germânio (Ge) e estanho (Sn):
PbO2 + 4H+ + 2e– ![]() Pb2+ + 2H2O
Pb2+ + 2H2O ![]()
GeO2 + 2H+ + 2e– ![]() GeO + H2O
GeO + H2O ![]()
SnO2 + 4H+ + 2e– ![]() Sn2+ + 2H2O
Sn2+ + 2H2O ![]()
Os potenciais padrão de redução dessas três semirreações, ![]() ,
, ![]() e
e ![]() , foram determinados experimentalmente, obtendo‐se os valores –0,12 V, –0,094 V e 1,5 V, não necessariamente nessa ordem.
, foram determinados experimentalmente, obtendo‐se os valores –0,12 V, –0,094 V e 1,5 V, não necessariamente nessa ordem.
Sabe‐se que, quanto maior o valor do potencial padrão de redução, maior o caráter oxidante da espécie química.
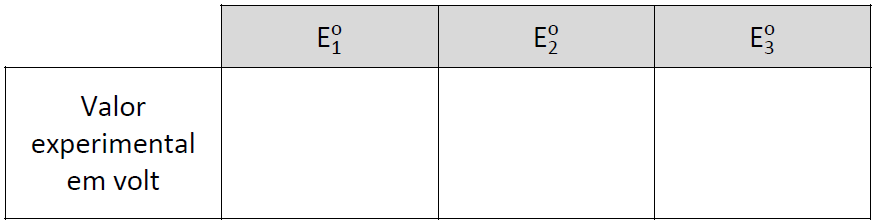
a) Considerando as informações da figura, atribua, na tabela abaixo, os valores experimentais aos potenciais padrão de redução ![]() ,
, ![]() e
e ![]() .
.
b) O elemento carbono pode formar óxidos, nos quais a proporção entre carbono e oxigênio está relacionada ao estado de oxidação do carbono. Comparando os óxidos CO e CO2, qual seria o mais estável? Explique, com base na figura apresentada acima.
04 - (UNESP SP )
Encanamentos de ferro mergulhados em água sofrem corrosão, devido principalmente à reação:
Fe(s) + 2H+(aq) Fe2+(aq) + H2(g)
Para proteger encanamentos nessas condições, costuma-se ligá-los a barras de outros metais, que são corroídos ao invés dos canos de ferro. Conhecendo os potenciais padrão de redução
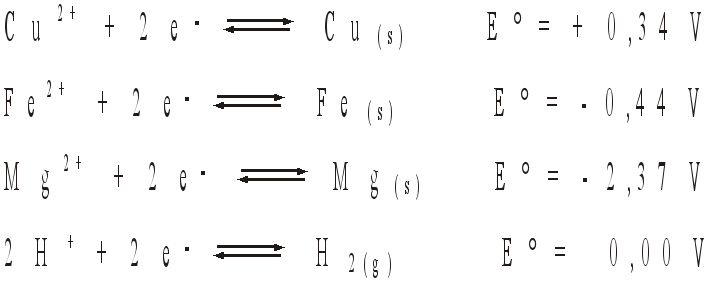
e dispondo-se de barras de magnésio e cobre, propõe-se:
a) Qual metal deve ser utilizado para proteger o encanamento? Justifique.
b) Escreva as reações que ocorrem na associação do cano de ferro com a barra metálica escolhida, indicando o agente oxidante e o agente redutor.
05 - (Fac. Santa Marcelina SP/2014-mod)
O ítrio-90 é um radioisótopo que tem sido cada vez mais utilizado no tratamento de tumores, especialmente do fígado, e apresenta meia-vida de 64 horas. No gráfico, sem escala definida, a curva mostra a atividade de certa amostra de 90Y ao longo do tempo.
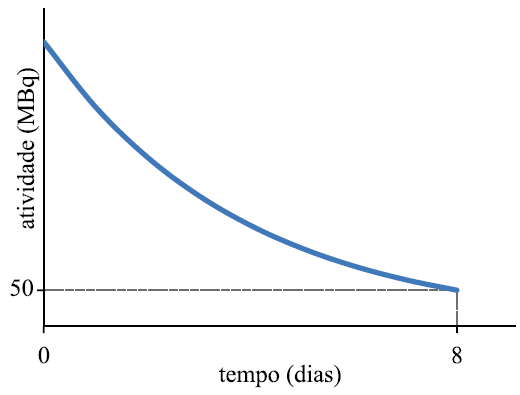
De acordo com os valores indicados no gráfico, qual o valor da atividade, em MBq, no tempo zero ?
06 - (FUVEST SP/2013)
Uma estudante de Química elaborou um experimento para investigar a reação entre cobre metálico (Cu) e ácido nítrico (HNO3(aq)). Para isso, adicionou o ácido nítrico a um tubo de ensaio (I) e, em seguida, adicionou raspas de cobre metálico a esse mesmo tubo. Observou que houve liberação de calor e de um gás marrom, e que a solução se tornou azul. A seguir, adicionou raspas de cobre a dois outros tubos (II e III), contendo, respectivamente, soluções aquosas de ácido clorídrico (HCl(aq)) e nitrato de sódio (NaNO3(aq)). Não observou qualquer mudança nos tubos II e III, ao realizar esses testes.
Sabe-se que soluções aquosas de íons Cu2+ são azuis e que o gás NO2 é marrom.
a) Escreva, as equações que representam a semirreação de oxidação e a semirreação de redução que ocorrem no tubo I.

b) Qual foi o objetivo da estudante ao realizar os testes com HCl (aq) e NaNO3(aq)? Explique.
07 - (FGV SP/2013-mod)
O molibdênio é um metal de aplicação tecnológica em compostos como MoS2 e o espinélio, MoNa2O4, que, por apresentarem sensibilidade a variações de campo elétrico e magnético, têm sido empregados em dispositivos eletrônicos.
Qual os números de oxidação do molibdênio no MoS2 e no MoNa2O4 ?
08 - (IME RJ/2014-mod)
Um hidreto gasoso tem fórmula empírica XH3 (massa molar de X = 13 g/mol) e massa específica de 6,0 g/L numa dada condição de temperatura e pressão. Sabendo-se que, nas mesmas temperatura e pressão, 1,0 L de O2 gasoso tem massa de 3,0 g, Determine a fórmula molecular do hidreto.
09 - (UEL PR/2015)
A pilha de Daniell é constituída basicamente de uma placa metálica de cobre mergulhada em uma solução de sulfato de cobre, constituindo o cátodo, e por uma placa metálica de zinco mergulhada em solução de sulfato de zinco, constituindo o ânodo. Ambos os metais são interligados por um circuito elétrico, e uma ponte salina faz a união das duas células, permitindo a migração de íons entre elas. A reação global que ocorre nessa pilha é representada por Cu2+ + Zn Cu + Zn2+, cuja diferença de potencial (Eº) da pilha formada é de 1,10 V. Um estudante resolveu testar uma nova configuração de pilha, substituindo o cobre por uma placa metálica de alumínio mergulhada em uma solução de Al2(SO4)3 e o zinco por uma placa metálica de ferro mergulhada em uma solução de FeSO4. As semirreações de redução envolvidas para a nova pilha construída são dadas a seguir.
Fe2+ + 2e → Fe Eº = –0,44 V
Al3+ + 3e– → Al Eº = –1,67 V
Com base nessas informações,
a) escreva a equação química balanceada que representa esse processo e a diferença de potencial da nova pilha construída;
b) indique o fluxo de elétrons, o agente oxidante e o agente redutor nessa nova pilha construída.
10 - (Unimontes MG/2015 MOD)
Determinadas peças de um antiquário foram submetidas a um banho de prata. Para cada grama de prata processada foram gastos R$2,10 (dois reais e dez centavos). Nesse processo, a quantidade de carga envolvida foi de 100 F.
Qual o valor gasto no processo, em reais? Dados: Ag = 108
1- RESOLUÇÃO:
O enunciado da questão fornece os reagentes e produtos. A reação é:
Al2(SO4)3 + 3 Ca(OH)2 2 Al(OH)3 + 3 CaSO4
O enunciado pede para determinar o reagente limitante.
Dica: Quando a questão fornece dois valores de massa ou de mols dos reagentes, provalvelmente algum valor está em excesso. Para determinar o reagente em excesso, vamos multiplicar em cruz e encontrar dois números. O maior número encontrado indica o reagente em excesso.
Obs: esses dois números encontrados servem apenas para indicar o reagente em excesso
Encontramos os valores 6660 e 6840. Isto indica que o reagente em excesso é o Ca(OH)2 e o limitante é o Al2(SO4)3
DICA: os cálculos são realizados com o reagente limitante.
2- RESOLUÇÃO
Dica: foi dado a porcentagem dos gases, portanto podemos dizer que a massa de cada um é de 0,8 g de N2 e 0,2 g de O2. Quando a questão fornece dois valores de massa ou de mols, provalvelmente um deles está em excesso.
Para resolver, vamos utilizar o mesmo procedimento da questão anterior.
Concluímos que o reagente em excesso é o N2 e o limitante é o O2, indicando que os cálculos são realizados com o reagente limitante.
Vamos calcular a massa de N2 que reagiu e a massa de NO2 formada.
X = 0,0875 g de N2 (aproximando: 0,09g de N2 ).
Y = 0,2875 g de NO2 ( aproximando: 0,29 g de NO2).
Calculando a quantidade N2 no final.
0,8 g inicial – 0,09 g reagiu = 0,71g = 71%
NO2 = 0,29g= 29%
Concluímos que a porcentagem é de 71% N2 e 29%
3 - RESOLUÇÃO
Verificando o gráfico, notamos que o chumbo Pb+2 é o mais estável com número de oxidação +2. Portanto o Pb+2 possui o maior E0 redução ( 1,5 v ).
O germânio é o elemento menos estável ( nox = +2 ), portanto possui o menor E0 de redução (- 0,12 v ).
Logo o estanho Sn+2 = - 0,094 v
|
VALOR EXPER EM VOLTS |
E1 |
E2 |
E3 |
|
1,5 V |
-0,12 V |
- 0,094 V |
b) Vamos determinar o nox em cada um dos óxidos dados.
C O C O2
+2 -2 +4 -2
Através do gráfico, notamos que a estabilidade do C+4 é maior que a do C+2, pelo critério o CO2 é o mais estável.
4- RESP: A
De acordo com o texto ,para proteger encanamentos de ferro, costuma-se ligá-los a barras de outros metais, que são corroídos ao invés dos canos de ferro (atuam como metal de sacrifício). Conhecendo os potenciais padrão de redução sabemos que quanto menor o potencial de redução, maior será o poder de oxidação ( será corroído antes do ferro ).
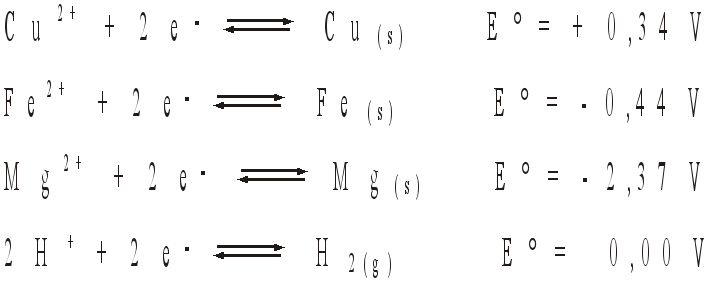
a) Verificando a tabela o metal que obedece a descrição acima é o magnésio (Mg), que possui potencial de redução – 2,37 V, menor que o ferro – 0,44 V.
5- Resolução
A questão fala sobre o ítrio-90 que é um radioisótopo que tem sido cada vez mais utilizado no tratamento de tumores, e apresenta meia-vida de 64 horas.

Segundo o gráfico foram decorridos 8 dias = 192 horas( o dia tem 24 horas).
A meia-vida é de 64 horas. Portanto temos que 192 horas = 3 meia-vida.
50 MBq -------------- 100 MBq --------------200 MBq ---------------400 MBq
(T = 8 dias ) ( t = 0 dias)
6- RESOLUÇÃO
A REAÇÃO CITADA NO TEXTO É:
a) Semi-reação de oxidação: Cu(s) → Cu2+(aq) + 2e–
Nesta reação o agente redutor é o cobre.
Na reação de redução o agente oxidante é o HNO3 (aq)
Semi-reação de redução: HNO3(aq) + H+(aq) + e– → NO2(g) + H2O(l).
b) Com o HCl ou NaNO3 não ocorreu reação. Portanto O objetivo era testar o agente oxidante do metal cobre, já que poderia ser somente o H+(aq), somente o NO![]() (aq) ou ambos. Como não ouve oxidação do cobre metálico somente com o H+(aq) ou com o NO
(aq) ou ambos. Como não ouve oxidação do cobre metálico somente com o H+(aq) ou com o NO![]() (aq), o agente que oxida o metal é o conjunto H+(aq) com NO
(aq), o agente que oxida o metal é o conjunto H+(aq) com NO![]() (aq) ou simplesmente o ácido nítrico (HNO3 (aq).
(aq) ou simplesmente o ácido nítrico (HNO3 (aq).
7- Resolução
Esta questão pede para determinar o número de oxidação molibdênio (Mo) no MoS2 e o espinélio, MoNa2O4 .
Dica: Alguns elementos apresentam nox fixo. Nesta questão temos o sódio ( Na ) que possui nox = +1, pois pertence a família 1A e o oxigênio (O ) que possui nox igual a -2, exceto nos peróxidos onde o nox do oxigênio será -1
No primeiro quadrante ( azul) colocamos o nox conhecido para cada elemento. No quadrante de baixo ( verde ) colocamos o total de cargas, onde a soma será igual a zero.
No primeiro exemplo o enxofre possui nox variável, mas como está formando um composto de fórmula MoS2, concluímos que o enxofre é -2 e o Mo é igual a +4 , pois irá formar o composto Mo2S4. Como 2 e 4 são multíplos, simplificamos e encontramos a fórmula MoS2
8- Resolução
A questão fornece dados do gás oxigênio que serão utilizados para determinar a fórmula molecular do hidreto.
Dados fornecidos: m = 3 gramas M = 32 g.mol-1 V = 1 L
Agora vamos calcular para o hireto
d = 6 g/L
Substituindo I em II
Determinação da fórmula molecular.
A questão informou que a massa de X = 13 g/mol e H = 1 g/mol
(XH3)Y = 64 ( 13 + 3 )y = 64 16 Y = 64 y = 4
A fórmula será X4H12
9- Resolução
Fe2+ + 2e → Fe Eº = –0,44 V
Al3+ + 3e– → Al Eº = –1,67 V
A questão forneceu as semirreações de redução.
Dica: A semireação com o maior potencial sofre redução. Isto indica que a outra semireação sofre oxidação e deve ser invertida
a)Para balancear a equação química ,vamos multiplicar a primeira por 3 e a segunda por 2.
O fluxo de elétrons vai do Al (ânodo) para o Fe2+ (cátodo), o agente oxidante é Fe2+ e o agente redutor é Al.
Dica: 0xidação perde elétrons aumento algébrico agente redutor.
Redução recebe elétrons diminuição algébrico agente oxidante
10- Resolução
Vamos escrever a semireação de redução ( sofre deposição ).
Ag+ + 1 e- Agº
96500 C ------ ------ 108 g
100(96500 ) C ------ X
X = 10800 gramas
Dica : 1mol e- = 1F = 96500 C
Cálculo do valor gasto.
1grama -------- R$2,10
10800 gramas ----- x
X = 22680,00 reais
AULA 03
EQUILÍBRIO QUÍMICO
TEORIA ATÔMICO MOLECULAR
RADIOATIVIDADE
GASES
ESTEQUIOMETRIA
01 - (Unievangélica GO/2014 MOD)
Segundo Avogadro, “Gases quaisquer, ocupando o mesmo volume, nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas”.
Considere os seguintes sistemas fechados contendo gases, todos com a mesma temperatura e pressão:
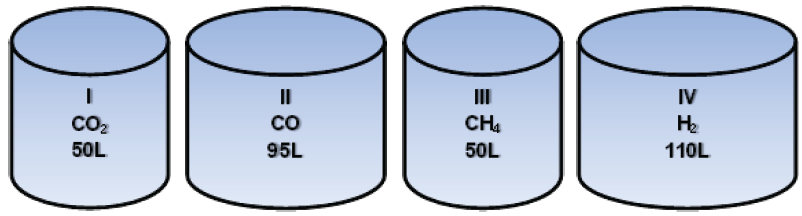
Há maior número de átomos de oxigênio e hidrogênio, respectivamente, em quais sistemas?
Dados: C = 12 O = 16 H = 1
02 - (FMJ SP/2013-MOD)
O isótopo do iodo, que apresenta número de massa 131, pode ser utilizado na medicina nuclear para avaliar o tamanho, a forma e a atividade da glândula tireoide. Uma das etapas de seu decaimento radioativo é:
![]()
Nessa reação, ![]() representa qual partícula?
representa qual partícula?
03 - (UCS RS/2013- mod)
A hemoglobina é uma metaloproteína que contém 0,35% de Fe em massa. Ela está presente nos glóbulos vermelhos e permite o transporte de oxigênio pelo sistema circulatório. Sabendo-se que a molécula de hemoglobina contém 4 átomos de Fe, qual a massa molar aproximada da hemoglobina?Dados: Fe = 56
04 - (UFG GO/2014)
A equação da lei dos gases ideais, P.V = n.R.T, é uma equação de estado que resume as relações que descrevem a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Considerando o exposto, demonstre, por meio de equações matemáticas, como a densidade de um gás qualquer varia em função da temperatura e determine a massa molar de um gás considerando os dados a seguir.
Dados: d = 0,97 g L–1; T = 210 ºC; P = 0,25 atm; R = 62,36 L.torr.mol–1.K–1; 1 atm = 760 torr.
05 - (Fac. de Ciências da Saúde de Barretos SP/2013)
Oxigênio, nitrogênio e hélio são gases utilizados em ambientes hospitalares com diversas aplicações em sistemas de manutenção da vida. Em geral, são fornecidos em cilindros, sob pressão.
Um técnico da central de gases de um hospital abasteceu dois cilindros de aço com oxigênio e hélio à temperatura de 27 ºC e alta pressão. O cilindro 1 foi abastecido com 0,96 kg de oxigênio e o cilindro 2 recebeu uma carga correspondente a 0,12 kg de hélio.
Dado: volume molar dos gases a CNTP = 22,4 L.
Para realizar o abastecimento em condições normais de temperatura e pressão, o técnico iria precisar de cilindros com capacidade igual a quanto? Dados: He = 4 O = 16
06 - (UCS RS/2013- MOD)
O BaSO4 é utilizado como contraste para a realização de exames de raios X do trato intestinal, no lugar de outros sais de bário que também refletem esse tipo de radiação. Essa preferência deve-se ao fato de ele ser pouco solúvel em água, o que minimiza a exposição do paciente ao íon Ba2+, que é tóxico.
Sabendo-se que 1 g de BaSO4 pode ser dissolvido em 400 L de água. Qual o produto de solubilidade (Kps) aproximado para esse sal ?
1-Resolução
Dica: “Quaisquer gases na mesma pressão e temperatura e ocupando o mesmo volume, possuem o mesmo número de mols”
Temos: PV = nRT V = n
2-Resolução
A questão fornece a reação nuclear, representada por:
![]()
A questão pede a partícula representada por ![]() .
.
Temos na reação a radiação gama que não possui massa e não possui carga. Verificamos que a massa permanece a mesma 131 e o número atômico aumenta uma unidade. Concluímos que a partícula que completa a reação é a beta -1 β0
3-Resolução
A hemoglobina contém 0,35% em massa de ferro. A questão informa que a molécula de hemoglobina contém 4 átomos de ferro ( a massa de Fe = 56 g/mol ).
Temos:
4 Fe --------------0,35%
224 g ------------ 0,35%
M ------------ 100 %
M = 64.000 g.mol-1
4-RESOLUÇÃO
P M = d R T , onde M = massa molar d = densidade em g/L
P = pressão R = constante T = temperatura em Kelvin .
Dados: d = 0,97 g L–1; T = 210 ºC; P = 0,25 atm; R = 62,36 L.torr.mol–1.K–1; 1 atm = 760 torr
M = dR T / P è M = 0,97 . 62,36 .483 / 190
M = 153,76 g.mol-1
DICA : Transformar a pressão (atm ) em torr.
1 atm = 760 mmHg = 760 torr
1 atm ----------- 760 torr
0,25 atm -------- x
X = 190 torr
5-Resolução
A questão indica que os gases estão nas CNTP. O volume molar ( volume de 1 mol ) é igual a 22,4 L.
Para determinar o volume dos gases, temos que calcular o número de mols de cada gás envolvido. A massa molar do gás oxigênio é 32 g.mol-1 e do hélio é igual a 4g.mol-1 .
Cálculo de volume para 960 g do gás oxigênio.
32 g O2 -------------- 22,4 L
960 g O2 ----------- X
X = 672 L
Cálculo de volume para 120 g do gás hélio.
4 g O2 -------------- 22,4 L
120 g O2 ----------- X
X = 672 L
Concluímos que a capacidade dos cilindros deve ser de 672 litros para os gases.
6-Resolução
A questão é referente a produto de solubilidade ( kps ).
1 BaSO4(S) 1Ba+2(aq) + 1 SO4-2 (aq)
Kps = [Ba+2] [SO4-2]
[ ] = concentração molar M = 233 g.mol-1 ( consultando uma tabela )
[BaSO4] = m/M. V . Portanto : [BaSO4] = 1/233. 400
[BaSO4] = 1,07 x 10-5 mol/L
Kps = [Ba+2] [SO4-2]
Kps = [1,07.10-5] [1,07.10-5] Kps = 1,14 . 10-10
AULA 02
ELETROQUÍMICA
TEORIA ATÔMICO MOLECULAR
CINÉTICA QUÍMICA
EQUILÍBRIO QUÍMICO
01 - (FUVEST SP/2014)
Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água.
Após a montagem de uma aparelhagem como a da figura abaixo, e antes de iniciar a eletrólise, a professora perguntou a seus alunos qual dos dois gases, gerados no processo, eles esperavam recolher em maior volume. Um dos alunos respondeu: “O gás oxigênio deve ocupar maior volume, pois seus átomos têm oito prótons e oito elétrons (além dos nêutrons) e, portanto, são maiores que os átomos de hidrogênio, que, em sua imensa maioria, têm apenas um próton e um elétron”.
Observou‐se, porém, que, decorridos alguns minutos, o volume de hidrogênio recolhido era o dobro do volume de oxigênio (e essa proporção se manteve no decorrer da eletrólise), de acordo com a seguinte equação química:
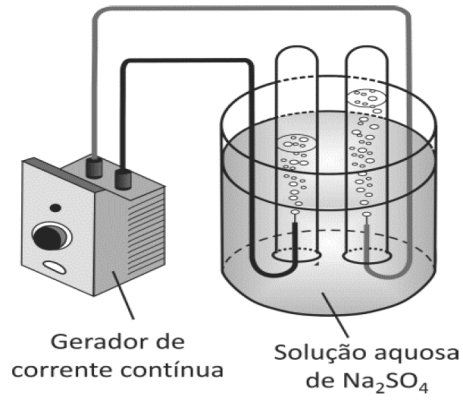
a) Considerando que a observação experimental não corresponde à expectativa do aluno, explique por que a resposta dada por ele está incorreta.
Posteriormente, o aluno perguntou à professora se a eletrólise da água ocorreria caso a solução aquosa de Na2SO4 fosse substituída por outra. Em vez de responder diretamente, a professora sugeriu que o estudante repetisse o experimento, porém substituindo a solução aquosa de Na2SO4 por uma solução aquosa de sacarose (C12H22O11).
b) O que o aluno observaria ao realizar o novo experimento sugerido pela professora? Explique.
02 - (UFG GO/2014-mod)
Um determinado volume de água foi colocado em um recipiente de formato cúbico e em seguida resfriado à 0 ºC. Após a mudança de estado físico, um analista determinou o número de moléculas presentes no cubo de água formado. Desprezando possíveis efeitos de compressão ou expansão e admitindo a aresta do cubo igual a 3 cm, qual o número aproximado de moléculas de água presentes no cubo ? Dados: H = 1 O = 16
03 - (UNESP SP/2013)
Uma forma de obter hidrogênio no laboratório é mergulhar zinco metálico em uma solução de ácido clorídrico, conforme a reação descrita pela equação apresentada a seguir.
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
Considere que uma tira de zinco metálico foi colocada em um recipiente contendo HCl em solução aquosa na concentração de 1 mol/L. Em 20 segundos a temperatura do recipiente elevou-se em 0,05 ºC e 25 mL de hidrogênio foram produzidos.
Considerando que essa reação ocorreu a 27 ºC e 1 atm, determine a velocidade da reação em mL H2/s e em mol H2/s. Dado: R = 0,082 L · atm · K–1 · mol–1
04 - (UECE/2015 MOD)
O tetróxido de dinitrogênio gasoso, utilizado como propelente de foguetes, dissocia-se em dióxido de nitrogênio, um gás irritante para os pulmões, que diminui a resistência às infecções respiratórias.
Considerando que no equilíbrio a 60 °C, a pressão parcial do tetróxido de dinitrogênio é 1,4 atm e a pressão parcial do dióxido de nitrogênio é 1,8 atm. Qual a constante de equilíbrio Kp ?
05 - (UFG GO/2014)
Em um laboratório, um analista misturou 1 L de uma solução de ácido clorídrico 0,1 mol/L com 1 L de uma solução de hidróxido de sódio 0,2 mol/L.
A partir das informações fornecidas,
a) escreva a equação química balanceada.
b) calcule a concentração molar e o valor do pH da solução resultante. Use log 5 = 0,70.
06 - (UNICAMP SP/2014)
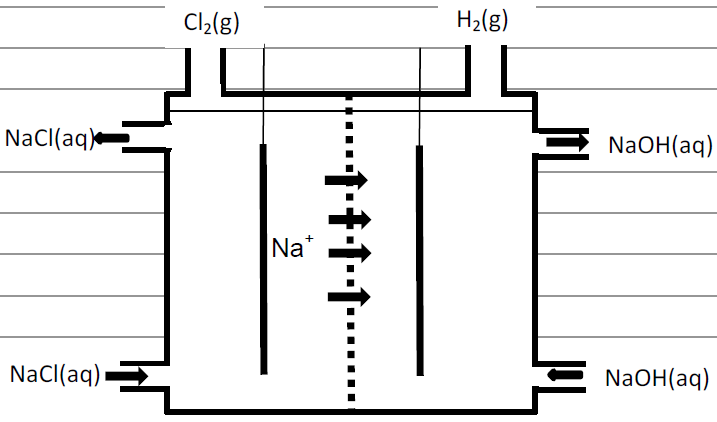
A produção mundial de gás cloro é de 60 milhões de toneladas por ano. Um processo eletroquímico moderno e menos agressivo ao meio ambiente, em que se utiliza uma membrana semipermeável, evita que toneladas de mercúrio, utilizado no processo eletroquímico convencional, sejam dispensadas anualmente na natureza. Esse processo moderno está parcialmente esquematizado na figura abaixo.
a) Se a produção anual de gás cloro fosse obtida apenas pelo processo esquematizado na figura abaixo, qual seria a produção de gás hidrogênio em milhões de toneladas?
b) Na figura, falta representar uma fonte de corrente elétrica e a formação de íons OH–. Complete o desenho com essas informações, não se esquecendo de anotar os sinais da fonte e de indicar se ela é uma fonte de corrente alternada ou de corrente contínua.
07 - (Mackenzie SP/2015 MOD)
Determine, respectivamente, o pH e a constante de ionização de uma solução aquosa de um ácido monocarboxílico 0,01 M, a 25ºC, que está 20% ionizado, após ter sido atingido o equilíbrio. Dado: log 2 = 0,3
1 – RESOLUÇÃO
Na eletrólise de uma solução aquosa de Na2SO4 a prioridade de descarga no cátodo é do H+ e no ânodo a prioridade de descarga é do OH-
PRIORIDADE DO H+ : 2 H+ + 2 e- è H2
PRIORIDADE DO OH- : 2 OH- è H2O + ½ O2 + 2 e-
a) A resposta está incorreta porque o volume ocupado por gases nas mesmas condições de temperatura e pressão, o número de mols ou moléculas será igual ao volume em litros, independendo de tamanho, massa ou composição dos átomos que formam as moléculas desse gás.
b) O aluno não observaria a liberação dos gases porque a solução aquosa de C12H22O11(molecular) não é eletrolítica, não conduz corrente elétrica e não permiti a eletrólise.
2- Resolução
A questão indica que o cubo possui aresta de 3 cm.
Vamos calcular o volume de água no cubo = 33 cm = 27 cm3 de água = 27 gramas de água, pois a densidade da água é igual a 1 g/cm3.
Calculo do número de moléculas
18 g H2O ---------------- 6,0 X 1023 moléculas
27 g H2O ---------------- X
X = 9 X 1023 moléculas
3- RESOLUÇÃO
Dada a reação: Zn (s ) + 2 HCl (aq) ZnCl2(aq) + H2(g).
A questão fornece os dados sobre o gás hidrogênio. Assim podemos calcular o número de mols obtido do H2
PV = n R T è n = 1. 0,025 / 0,082 . 300
n = 0,001 mol de H2
Cálculo da velocidade da reação em mol/s.
0,001 mol --------------- 20s
X ------------------------- 1s
X =5 x 10-5 mol/s
Cálculo da velocidade da reação em mL/s.
25 mL --------------- 20s
X ------------------------- 1s
X =1,25 mL/s
4-Resolução
Esta questão envolve equilíbrio gasoso. A partir do enunciado podemos escrever o equilíbrio: N2O4(g) ↔ 2 NO2.
Os valores de pressão foram dados no equilíbrio e podemos aplicar a fórmula direta.
5- RESOLUÇÃO
DICA: No momento que calculamos o reagente em excesso, já podemos afirmar que o pH é maior que 7, pois o excesso é de base, indicando que vamos calcular primeiro o pOH e depois o pH.
A questão fornece o log 5 = 0,70.
pOH = - log [OH-]
pOH = - log 5 x 10-2
pOH = - ( log 5 + log 10-2 )
pOH = - ( 0,7 – 2 )
pOH = - 0,7 + 2
pOH = 1,3
Temos:pH + pOH = 14
pH = 12,7
6- RESOLUÇÃO
b)
Na figura, observa-se em fundo cinza, a representação da fonte de corrente elétrica contínua, os sinais dos eletrodos (polos) e o compartimento em que são produzidos os íons OH–.
7-Resolução
Dica: Nos ácidos carboxílicos, o hidrogênio ionizável é aquele ligado ao oxigênio da carboxila.