QUESTÕES ENEM - QUÍMICA - 2015
01 - (ENEM/2015)
O aproveitamento de resíduos florestais vem se tornando cada dia mais atrativo, pois eles são uma fonte renovável de energia. A figura representa a queima de um bio-óleo extraído do resíduo de madeira, sendo ![]() a variação de entalpia devido à queima de 1 g desse bio-óleo, resultando em gás carbônico e água líquida, e
a variação de entalpia devido à queima de 1 g desse bio-óleo, resultando em gás carbônico e água líquida, e ![]() a variação de entalpia envolvida na conversão de 1 g de água no estado gasoso para o estado líquido.
a variação de entalpia envolvida na conversão de 1 g de água no estado gasoso para o estado líquido.
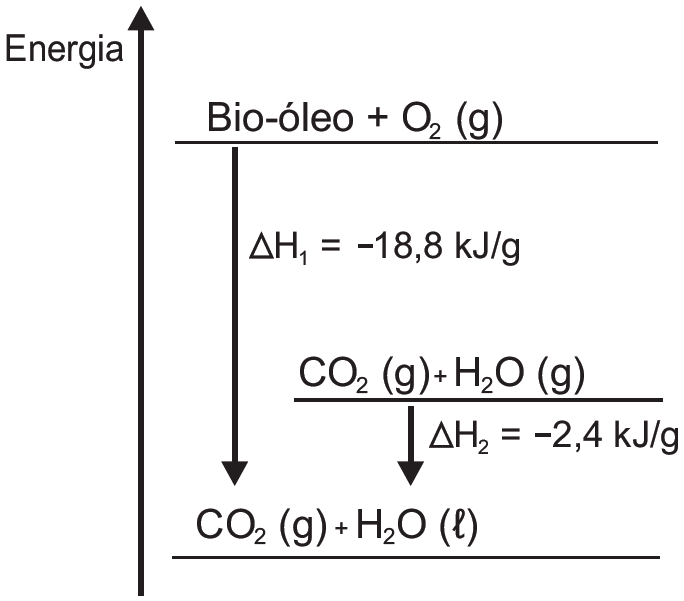
A variação de entalpia, em kJ, para a queima de 5 g desse bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:
a) –106.
b) –94,0.
c) –82,0.
d) –21,2.
e) –16,4.
02 - (ENEM/2015)
A hidroponia pode ser definida como uma técnica de produção de vegetais sem necessariamente a presença de solo. Uma das formas de implementação é manter as plantas com suas raízes suspensas em meio líquido, de onde retiram os nutrientes essenciais. Suponha que um produtor de rúcula hidropônica precise ajustar a concentração do íon nitrato (NO3–) para 0,009 mol/L em um tanque de 5 000 litros e, para tanto, tem em mãos uma solução comercial nutritiva de nitrato de cálcio 90 g/L. As massas molares dos elementos N, O e Ca são iguais a 14 g/mol, 16 g/mol e 40 g/mol, respectivamente.
Qual o valor mais próximo do volume da solução nutritiva, em litros, que o produtor deve adicionar ao tanque?
a) 26
b) 41
c) 45
d) 51
e) 82
03 - (ENEM/2015)
Hipoxia ou mal das alturas consiste na diminuição de oxigênio (O2) no sangue arterial do organismo. Por essa razão, muitos atletas apresentam mal-estar (dores de cabeça, tontura, falta de ar etc.) ao praticarem atividade física em altitudes elevadas. Nessas condições, ocorrerá uma diminuição na concentração de hemoglobina oxigenada (HbO2) em equilíbrio no sangue, conforme a relação:
Hb (aq) + O2 (aq) ![]() HbO2 (aq)
HbO2 (aq)
Mal da montanha. Disponível em: www.feng.pucrs.br.
Acesso em: 11 fev. 2015 (adaptado).
A alteração da concentração de hemoglobina oxigenada no sangue ocorre por causa do(a)
a) elevação da pressão arterial.
b) aumento da temperatura corporal.
c) redução da temperatura do ambiente.
d) queda da pressão parcial de oxigênio.
e) diminuição da quantidade de hemácias.
04 - (ENEM/2015)
Para proteger estruturas de aço da corrosão, a indústria utiliza uma técnica chamada galvanização. Um metal bastante utilizado nesse processo é o zinco, que pode ser obtido a partir de um minério denominado esfalerita (ZnS), de pureza 75%. Considere que a conversão do minério em zinco metálico tem rendimento de 80% nesta sequência de equações químicas:
2 ZnS + 3 O2 ![]() 2 ZnO + 2 SO2
2 ZnO + 2 SO2
ZnO + CO ![]() Zn + CO2
Zn + CO2
Considere as massas molares: ZnS (97 g/mol); O2 (32 g/mol); ZnO (81 g/mol); SO2 (64 g/mol); CO (28 g/mol); CO2 (44 g/mol); e Zn (65 g/mol).
Que valor mais próximo de massa de zinco metálico, em quilogramas, será produzido a partir de 100 kg de esfalerita?
a) 25
b) 33
c) 40
d) 50
e) 54
05 - (ENEM/2015)
Hidrocarbonetos podem ser obtidos em laboratório por descarboxilação oxidativa anódica, processo conhecido como eletrossíntese de Kolbe. Essa reação é utilizada na síntese de hidrocarbonetos diversos, a partir de óleos vegetais, os quais podem ser empregados como fontes alternativas de energia, em substituição aos hidrocarbonetos fósseis. O esquema ilustra simplificadamente esse processo.
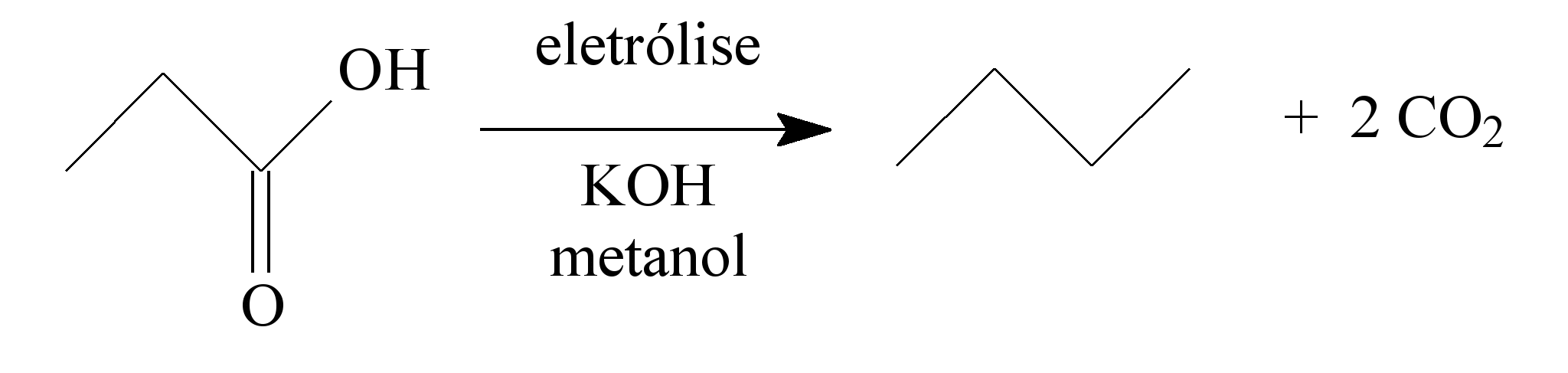
AZEVEDO, D. C.; GOULART, M. O. F. Estereosseletividade em reações eletródicas.
Química Nova, n. 2, 1997 (adaptado).
Com base nesse processo, o hidrocarboneto produzido na eletrólise do ácido 3,3-dimetil-butanoico é o
a) 2,2,7,7-tetrametil-octano.
b) 3,3,4,4-tetrametil-hexano.
c) 2,2,5,5-tetrametil-hexano.
d) 3,3,6,6-tetrametil-octano.
e) 2,2,4,4-tetrametil-hexano.
06 - (ENEM/2015)
Alimentos em conserva são frequentemente armazenados em latas metálicas seladas, fabricadas com um material chamado folha de flandres, que consiste de uma chapa de aço revestida com uma fina camada de estanho, metal brilhante e de difícil oxidação. É comum que a superfície interna seja ainda revestida por uma camada de verniz à base de epóxi, embora também existam latas sem esse revestimento, apresentando uma camada de estanho mais espessa.
SANTANA, V. M. S. A leitura e a química das substâncias. Cadernos PDE. Ivaiporã:
Secretaria de Estado da Educação do Paraná (SEED);
Universidade Estadual de Londrina, 2010 (adaptado).
Comprar uma lata de conserva amassada no supermercado é desaconselhável porque o amassado pode
a) alterar a pressão no interior da lata, promovendo a degradação acelerada do alimento.
b) romper a camada de estanho, permitindo a corrosão do ferro e alterações do alimento.
c) prejudicar o apelo visual da embalagem, apesar de não afetar as propriedades do alimento.
d) romper a camada de verniz, fazendo com que o metal tóxico estanho contamine o alimento.
e) desprender camadas de verniz, que se dissolverão no meio aquoso, contaminando o alimento.
07 - (ENEM/2015)
Uma forma de organização de um sistema biológico é a presença de sinais diversos utilizados pelos indivíduos para se comunicarem. No caso das abelhas da espécie Apis mellifera, os sinais utilizados podem ser feromônios. Para saírem e voltarem de suas colmeias, usam um feromônio que indica a trilha percorrida por elas (Composto A). Quando pressentem o perigo, expelem um feromônio de alarme (Composto B), que serve de sinal para um combate coletivo. O que diferencia cada um desses sinais utilizados pelas abelhas são as estruturas e funções orgânicas dos feromônios.
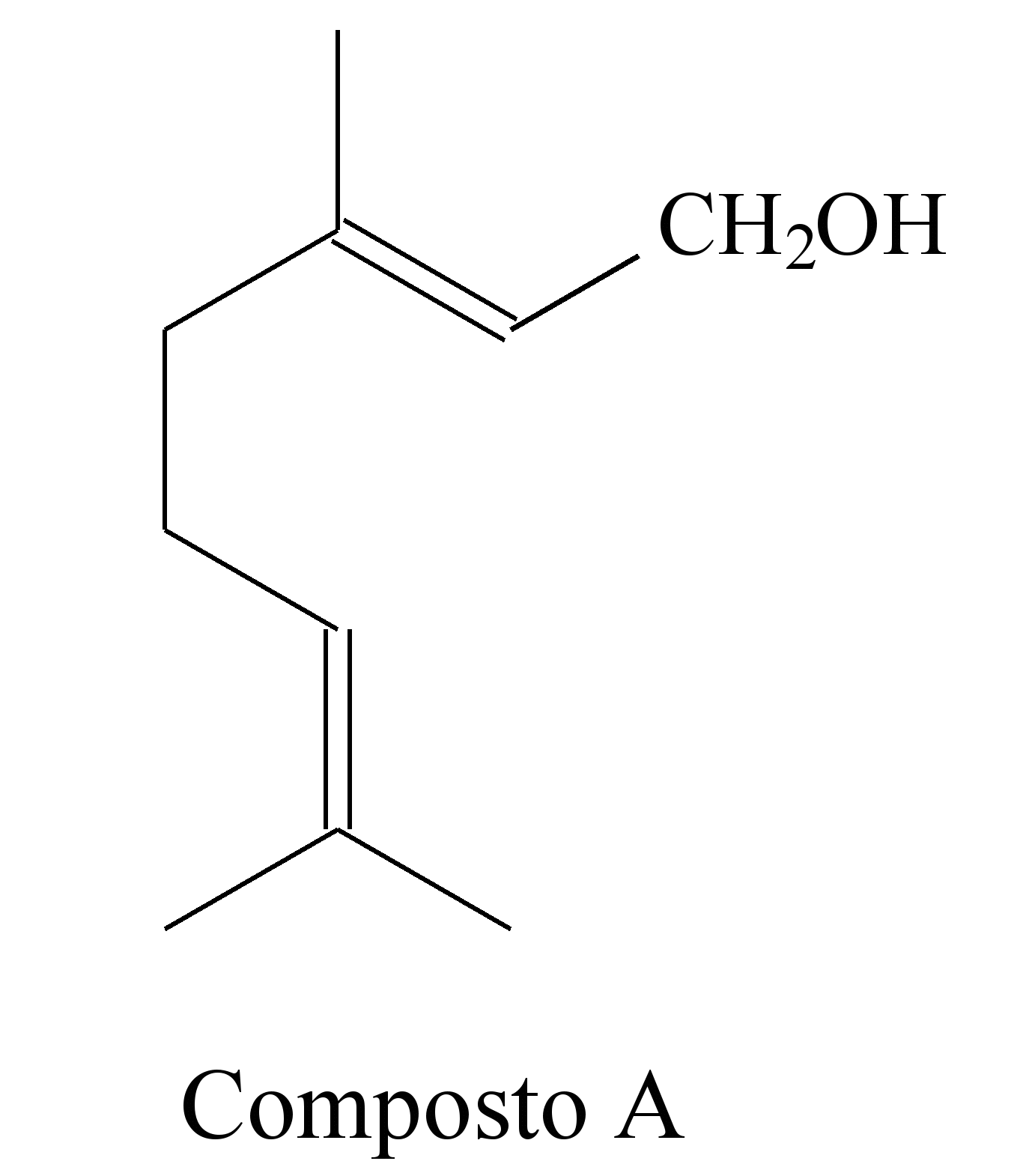
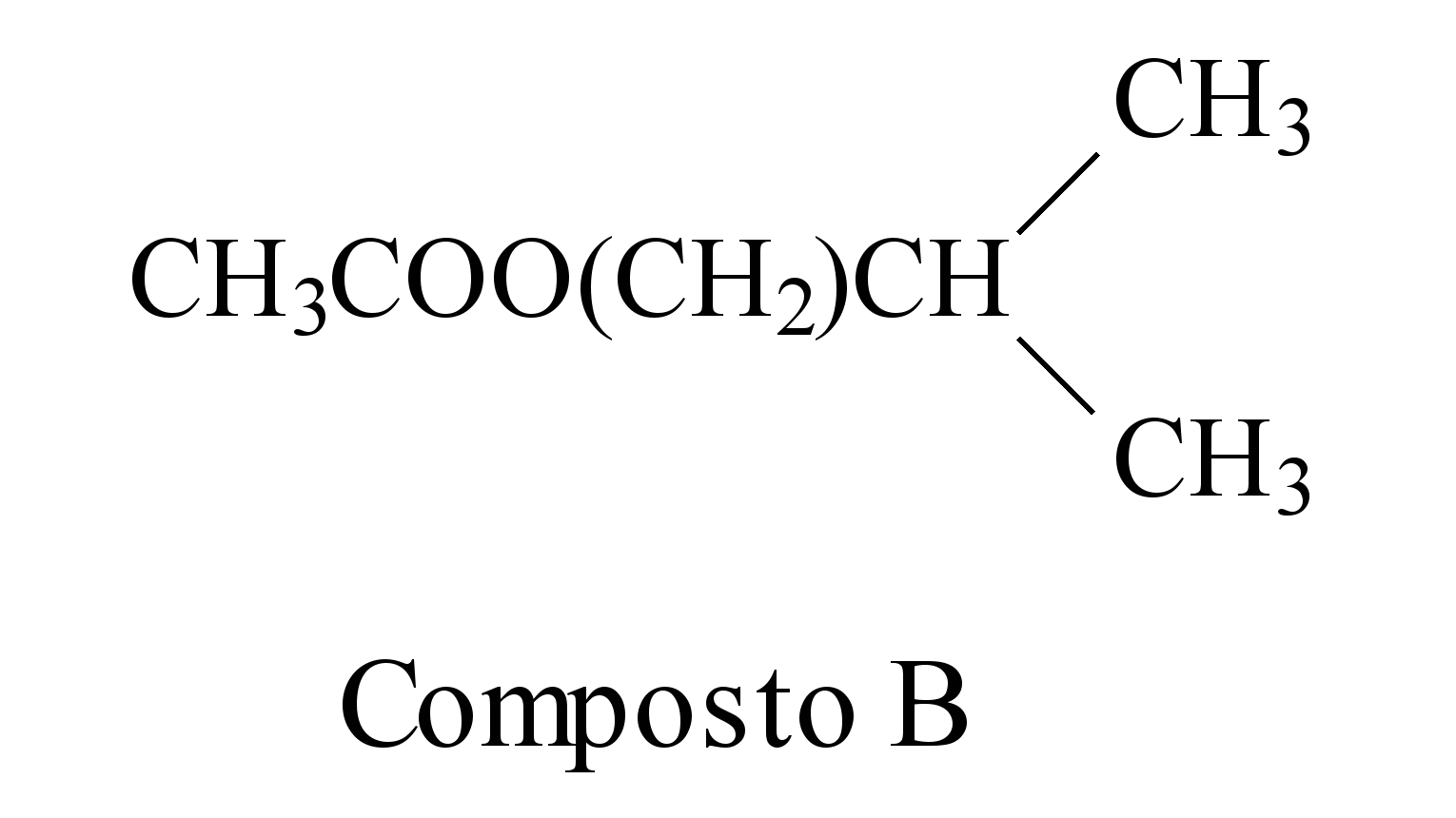
QUADROS, A. L. Os feromônios e o ensino de química.
Química Nova na Escola, n. 7, maio 1998 (adaptado).
As funções orgânicas que caracterizam os feromônios de trilha e de alarme são, respectivamente,
a) álcool e éster.
b) aldeído e cetona.
c) éter e hidrocarboneto.
d) enol e ácido carboxílico.
e) ácido carboxílico e amida.
08 - (ENEM/2015)
O permanganato de potássio (KMnO4) é um agente oxidante forte muito empregado tanto em nível laboratorial quanto industrial. Na oxidação de alcenos de cadeia normal, como o 1-fenil-1-propeno, ilustrado na figura, o KMnO4 é utilizado para a produção de ácidos carboxílicos.
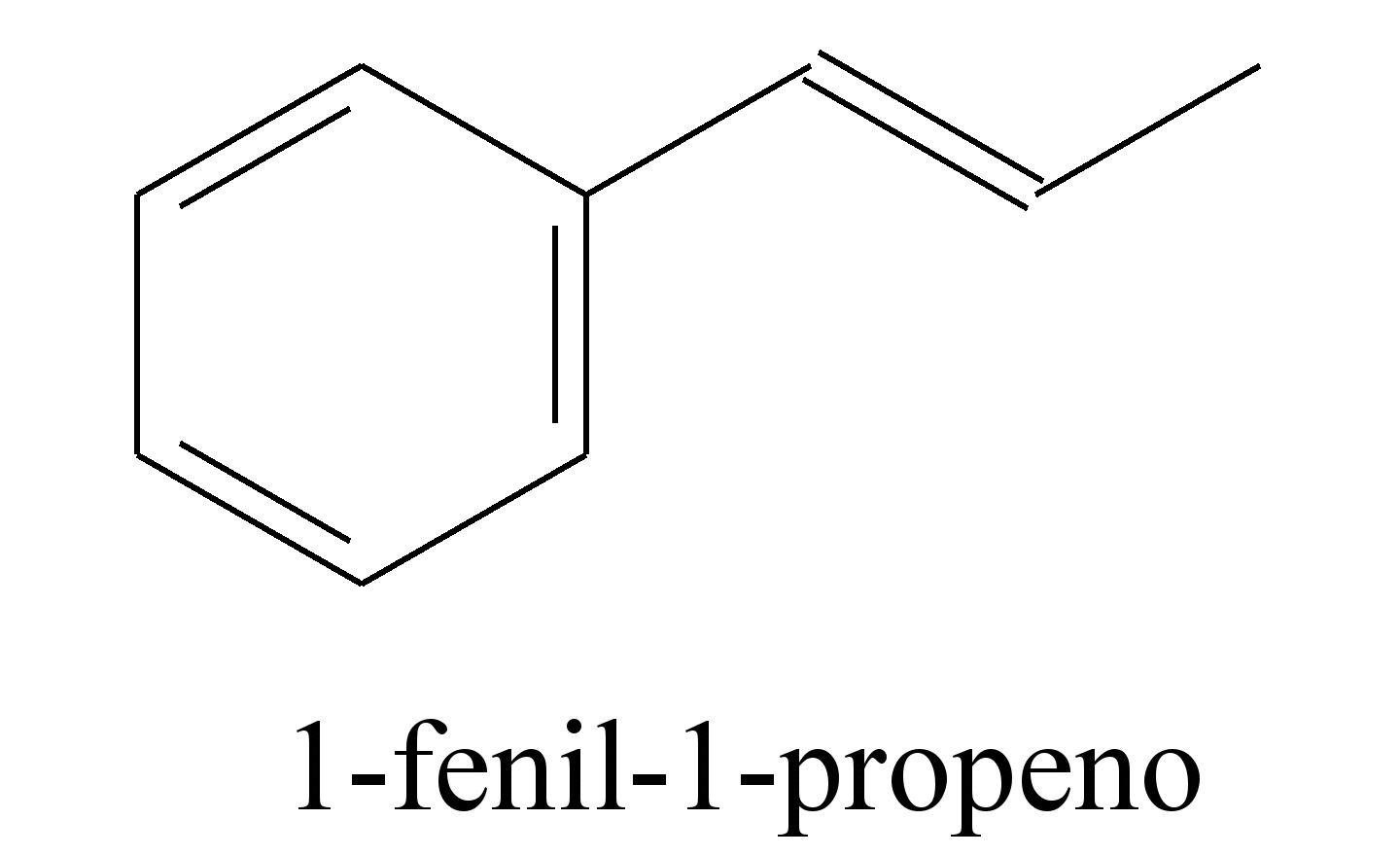
Os produtos obtidos na oxidação do alceno representado, em solução aquosa de KMnO4, são:
a) Ácido benzoico e ácido etanoico.
b) Ácido benzoico e ácido propanoico.
c) Ácido etanoico e ácido 2-feniletanoico.
d) Ácido 2-feniletanoico e ácido metanoico.
e) Ácido 2-feniletanoico e ácido propanoico.
09 - (ENEM/2015)
Um grupo de pesquisadores desenvolveu um método simples, barato e eficaz de remoção de petróleo contaminante na água, que utiliza um plástico produzido a partir do líquido da castanha de caju (LCC). A composição química do LCC é muito parecida com a do petróleo e suas moléculas, por suas características, interagem formando agregados com o petróleo. Para retirar os agregados da água, os pesquisadores misturam ao LCC nano partículas magnéticas. Novo método para remoção de petróleo usa óleo de mamona e castanha de caju.
Disponível em: www.faperj.br. Acesso em: 31 jul. 2012 (adaptado).
Essa técnica considera dois processos de separação de misturas, sendo eles, respectivamente,
a) flotação e decantação.
b) decomposição e centrifugação.
c) floculação e separação magnética.
d) destilação fracionada e peneiração.
e) dissolução fracionada e magnetização.
10 - (ENEM/2015)
Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d’água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
(I) CaCO3 (s) + CO2 (g) + H2O (l)![]() Ca2+ (aq) + 2 HCO3– (aq)
Ca2+ (aq) + 2 HCO3– (aq)
(II) HCO3– (aq)![]() H+ (aq) + CO32– (aq) K1 = 3,0
H+ (aq) + CO32– (aq) K1 = 3,0![]() 10–11
10–11
(III) CaCO3 (s)![]() Ca2+ (aq) + CO32– (aq) K2 = 6,0
Ca2+ (aq) + CO32– (aq) K2 = 6,0![]() 10–9
10–9
(IV) CO2 (g) + H2O (l)![]() H+ (aq) + HCO3– (aq) K3 = 2,5
H+ (aq) + HCO3– (aq) K3 = 2,5![]() 10–7
10–7
Com base nos valores das constantes de equilíbrio das reações II, III e IV a 25 ºC, qual é o valor numérico da constante de equilíbrio da reação I?
a) 4,5![]() 10–26
10–26
b) 5,0![]() 10–5
10–5
c) 0,8![]() 10–9
10–9
d) 0,2![]() 105
105
e) 2,2![]() 1026
1026
11 - (ENEM/2015)
A calda bordalesa é uma alternativa empregada no combate a doenças que afetam folhas de plantas. Sua produção consiste na mistura de uma solução aquosa de sulfato de cobre(II), CuSO4, com óxido de cálcio, CaO, e sua aplicação só deve ser realizada se estiver levemente básica. A avaliação rudimentar da basicidade dessa solução é realizada pela adição de três gotas sobre uma faca de ferro limpa. Após três minutos, caso surja uma mancha avermelhada no local da aplicação, afirma-se que a calda bordalesa ainda não está com a basicidade necessária. O quadro apresenta os valores de potenciais padrão de redução (Eº) para algumas semirreações de redução.

MOTTA, I. S. Calda bordalesa: utilidades e preparo. Dourados: Embrapa, 2008 (adaptado).
A equação química que representa a reação de formação da mancha avermelhada é:
a) Ca2+ (aq) + 2 Cu+ (aq) ![]() Ca (s) + 2 Cu2+ (aq).
Ca (s) + 2 Cu2+ (aq).
b) Ca2+ (aq) + 2 Fe2+ (aq) ![]() Ca (s) + 2 Fe3+ (aq).
Ca (s) + 2 Fe3+ (aq).
c) Cu2+ (aq) + 2 Fe2+ (aq) ![]() Cu (s) + 2 Fe3+ (aq).
Cu (s) + 2 Fe3+ (aq).
d) 3 Ca2+ (aq) + 2 Fe (s) ![]() 3 Ca (s) + 2 Fe3+ (aq).
3 Ca (s) + 2 Fe3+ (aq).
e) 3 Cu2+ (aq) + 2 Fe (s) ![]() 3 Cu (s) + 2 Fe3+ (aq).
3 Cu (s) + 2 Fe3+ (aq).
12 - (ENEM/2015)
A soda cáustica pode ser usada no desentupimento de encanamentos domésticos e tem, em sua composição, o hidróxido de sódio como principal componente, além de algumas impurezas. A soda normalmente é comercializada na forma sólida, mas que apresenta aspecto “derretido” quando exposta ao ar por certo período.
O fenômeno de “derretimento” decorre da
a) absorção da umidade presente no ar atmosférico.
b) fusão do hidróxido pela troca de calor com o ambiente.
c) reação das impurezas do produto com o oxigênio do ar.
d) adsorção de gases atmosféricos na superfície do sólido.
e) reação do hidróxido de sódio com o gás nitrogênio presente no ar.
13 - (ENEM/2015)
Em um experimento, colocou-se água até a metade da capacidade de um frasco de vidro e, em seguida, adicionaram-se três gotas de solução alcoólica de fenolftaleína. Adicionou-se bicarbonato de sódio comercial, em pequenas quantidades, até que a solução se tornasse rosa. Dentro do frasco, acendeu-se um palito de fósforo, o qual foi apagado assim que a cabeça terminou de queimar. Imediatamente, o frasco foi tampado. Em seguida, agitou-se o frasco tampado e observou-se o desaparecimento da cor rosa.
MATEUS, A. L. Química na cabeça. Belo Horizonte: UFMG, 2001 (adaptado).
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
a) formação de óxidos de caráter ácido.
b) evaporação do indicador fenolftaleína.
c) vaporização de parte da água do frasco.
d) vaporização dos gases de caráter alcalino.
e) aumento do pH da solução no interior do frasco.
14 - (ENEM/2015)
A bomba
reduz neutros e neutrinos, e abana-se com o leque da reação em cadeia
ANDRADE, C. D. Poesia completa e prosa.
Rio de Janeiro: Aguilar, 1973 (fragmento).
Nesse fragmento de poema, o autor refere-se à bomba atômica de urânio. Essa reação é dita “em cadeia” porque na
a) fissão do 235U ocorre liberação de grande quantidade de calor, que dá continuidade à reação.
b) fissão de 235U ocorre liberação de energia, que vai desintegrando o isótopo 238U, enriquecendo-o em mais 235U.
c) fissão do 235U ocorre uma liberação de nêutrons, que bombardearão outros núcleos.
d) fusão do 235U com 238U ocorre formação de neutrino, que bombardeará outros núcleos radioativos.
e) fusão do 235U com 238U ocorre formação de outros elementos radioativos mais pesados, que desencadeiam novos processos de fusão.
15 - (ENEM/2015)
A química verde permite o desenvolvimento tecnológico com danos reduzidos ao meio ambiente, e encontrar rotas limpas tem sido um grande desafio. Considere duas rotas diferentes utilizadas para a obtenção de ácido adípico, um insumo muito importante para a indústria têxtil e de plastificantes.
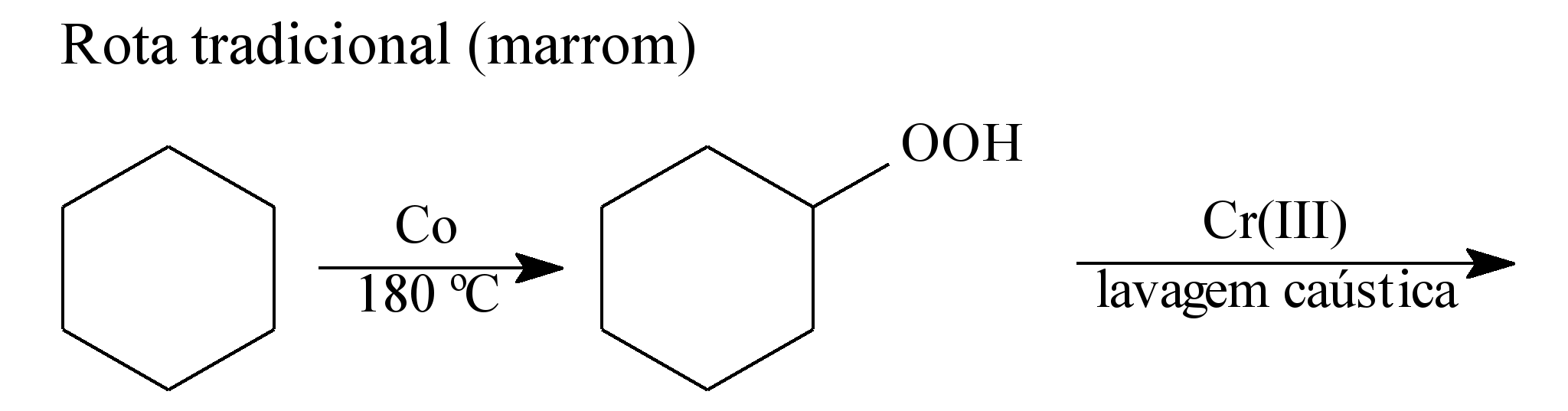
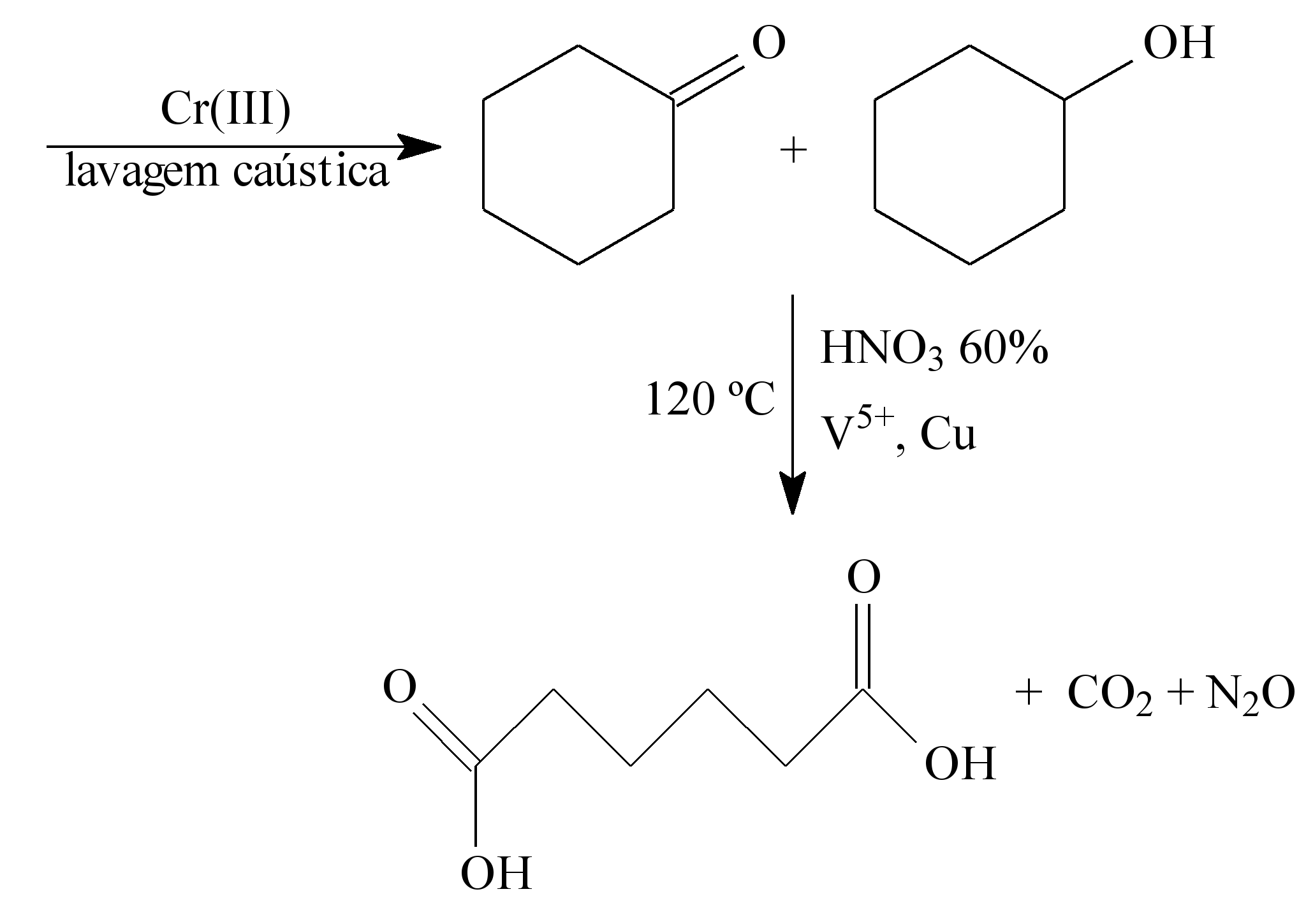
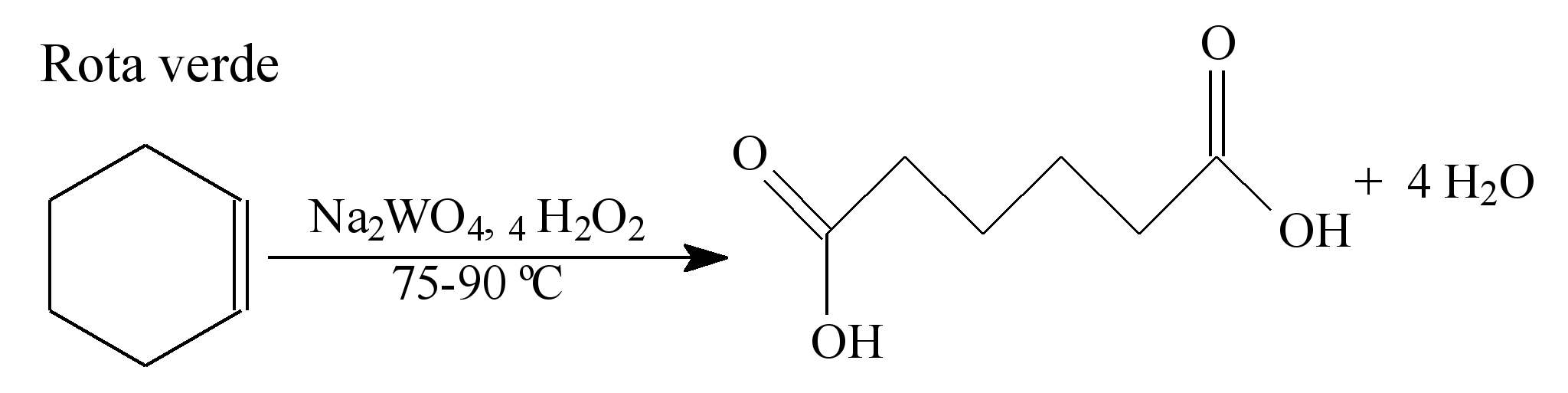
LENARDÃO, E. J. et al. Green chemistry – os 12 princípios da química verde e sua inserção nas
atividades de ensino e pesquisa. Química Nova, n. 1, 2003 (adaptado).
Que fator contribui positivamente para que a segunda rota de síntese seja verde em comparação à primeira?
a) Etapa única na síntese.
b) Obtenção do produto puro.
c) Ausência de reagentes oxidantes.
d) Ausência de elementos metálicos no processo.
e) Gasto de energia nulo na separação do produto.
GABARITO:
1- C 2-B 3-D 4-C 5-C 6-B 7-A 8-A 9-C 10-B 11-E 12-A 13-A 14-C 15-A
RESOLUÇÃO COMENTADA
1-RESP:C
Vamos calcular o ΔH total, envolvido na reação :
Bio-óleo + O2 CO2 + H2O
De acordo com o gráfico, temos:
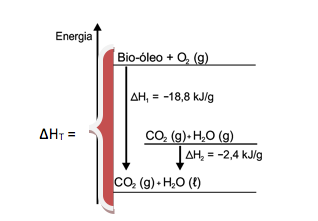
ΔHT = ΔH1 - ΔH2
ΔHT = -18,8 - (-2,4)
ΔHT = - 16,4 kJ/g bio-óleo
A questão pede para calcular a variação de entalpia para a queima de 5g do bio-óleo.

2-RESP:B
Esta é uma questão de diluição de soluções, onde temos concentração expressa em mol/L, g/L e concentração de íons.
1º passo
Vamos transformar a concentração 90g/L do nitrato de cálcio ( Ca(NO3)2) que possui massa molar igual a 164g/mol em mol/L
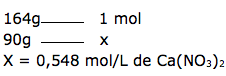
2º passo
O agricultor precisa ajustar a concentração de íons nitrato. Vamos calcular.
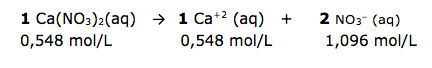
DICA: A concentração molar dos íons, obedece à proporção estequiométrica da reação.
2º passo
Agora vamos usar a diluição e calcular o volume de solução.
Temos:

3-RESP:D
Quanto maior a pressão, mais rarefeito torna-se o ar. Portanto quando o atleta pratica atividade em regiões de maior altitude, a dificuldade de respirar é maior, indicando que a saturação da oxiemoglobina diminuiu.
4-RESP:C
Esta questão, envolve cálculo estequiométrico com reações consecutivas.Portanto vamos somar as reações e obter uma reação global.Notamos que o ZnO é produto na primeira reação e reagente na segunda reação. Portanto vamos multiplicar a segunda reação por 2 para poder cortar.

DICA: Uma relação entre massas, podemos utilizar unidades diferentes. Porém para evitar erros é sempre melhor deixar tudo na mesma unidade.
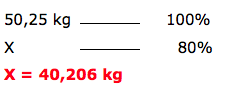
3º passo
Cálculo de acordo com o rendimento, informado no texto.
5-RESP:C
Eletrossíntese : é a síntese de compostos químicos em uma célula eletroquímica.
A questão fornece o modelo a ser seguido( muito comum nos vestibulares este tipo de questão). A representação dada, foi em forma de bastonetes, mais conseguimos notar que irá ocorrer a formação de um alcano não ramificado e gás carbônico ( de acordo com o texto...descarboxilação – retirada de CO2).
Dado o esquema

Vamos escrever o ácido 3,3-dimetil-butanoico, representando os átomos de carbono
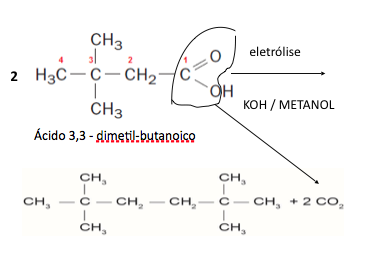
2,2,5,5-tetrametil-hexano
DICA: Temos duas moléculas que irão se unir através da ligação após a saída do carbono para formar o CO2
6-RESP:B
De acordo com o texto, a lata vem revestida com uma camada fina de estanho de difícil oxidação, evitando assim a corrosão do ferro. Portanto comprando uma lata de conserva já amassada, pode ocorrer o risco da mesma ter rompido a fina camada de estanho, deixando a mesma em contato com o alimento, podendo ocorrer alterações em suas propriedades.

7-RESP:A
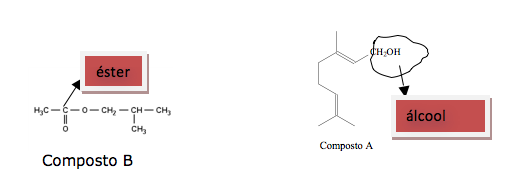
As funções orgânicas presentes são: Composto A : álcool e no composto B: éster.
8-RESP:A
A oxidação de alcenos na presença de permanganato em meio ácido, produz ácidos carboxílicos de acordo com o texto.
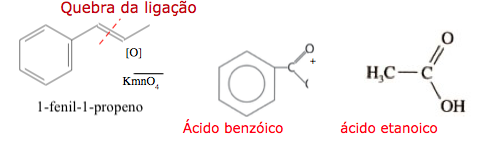
9-RESP:C
Podemos notar que o texto já informa que são monopartículas magnéticas, facilitando a resolução, pois a resposta já fica entre as alternativas C e E. Portanto já sabemos que um dos métodos é a separação magnética.
Concluímos que o outro processo é a floculação( formação de agregados com o petróleo....flóculos ), pois a dissolução apenas dissolve parte da mistura.
10-RESP:B
Para a determinação da constante de uma reação, através de outras, vamos utilizar a seguinte fórmula:

11-RESP:E
A questão informa que a calda bordalesa é uma mistura de solução aquosa de sulfato de cobre II e óxido de de cálcio. O óxido cálcio, forma o hidróxido de cálcio em contato com a água, de acordo com a reação: CaO(s) + H2O → Ca(OH)2(aq).
DICA: o óxido de cálcio quando reage com a água, forma uma base, devido ao seu caráter básico, ou seja, quando o cátion pertence a famílias 1A ou 2A o óxido tem o caráter básico.
Para verificar o caráter básico da bordalesa, será necessário adicionar três gotas de um indicador sobre uma faca (formada por ferro), se aparecer à coloração vermelha, indica que a calda bordalesa ainda não está básica. Portanto a reação de formação da macha vermelha é devida areação do ferro metálico com os íons de cobre II.
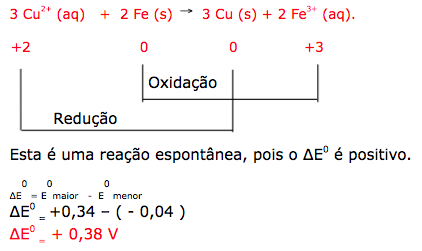
12-RESP:A
O hidróxido de sódio (NaOH), também conhecido como soda cáustica, é uma substância higroscópica, isto é, retém água da atmosfera com muita facilidade ( aspecto derretido). O hidróxido de sódio é muito usado na indústria, na fabricação de papel, tecidos, detergentes, alimentos e biodiesel e na produção de sabão. Também pode ser utilizado no desentupimento de canos, pois o mesmo reage com a gordura.
13-RESP:A
Esta questão mostra o uso do indicador fenolftaleína que no meio ácido fica incolor e no meio básico fica vermelho-róseo.
Quando se adiciona o bicarbonato de sódio na água, ocorre o processo de hidrólise salina, originando um solução com o caráter básico, aparecendo à coloração rosa.
DICA: O bicarbonato de sódio é derivado de uma base forte (NaOH) e de um ácido fraco (H2CO3).
ÁCIDO FRACO + BASE FORTE SOLUÇÃO BÁSICA
A combustão do palito de fósforo produz CO2 e SO2 que são dois óxidos com o caráter ácido. Como o recipiente foi fechado, ocorreu à reação do gás carbônico com a água.
Oxido ácido + água ácido
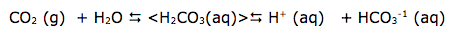
Devido à formação do ácido carbônico, o meio básico vai desaparecendo, e consequentemente a coloração rosa também desaparece.
NOTA: o ácido carbônico é considerado um ácido fraco, pois o mesmo sofre decomposição em água e gás carbônico.
14-RESP:C
A reação em cadeia é qualquer reação cujos subprodutos disparam uma sequencia de reações idênticas, que se repetem até que sua matéria-prima se esgote.
Fissão nuclear: É a reação que começa com uma molécula de urânio sendo bombardeada por um nêutron, o que faz com que seu núcleo se divida em duas partes praticamente iguais. Essa divisão libera outros nêutrons que, em seguida, reagirão com outras moléculas de urânio. Enquanto restarem núcleos desse elemento químico, eles continuarão se separando em dois.
01n + 92235U → 56142Ba + 3691Kr + 3 01n
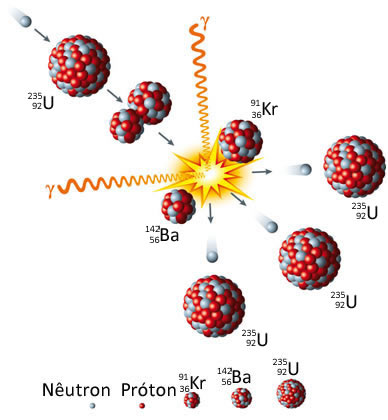
Observe que se os 3 nêutrons liberados na fissão estiverem em velocidade moderada, eles poderão reagir novamente com outros núcleos de urânio-235 que estiverem presentes e assim continua a reação em cadeia. ( fonte Brasil escola).
15-RESP:A
A QUÍMICA VERDE é um movimento caracterizado pela determinação ao enfretamento e propostas de resolução dos problemas ambientais.Portanto temos três fatores importantes que devem ser observados na QUIMICA VERDE:
1) Uso de fontes recicláveis ou renováveis.
2) Diminuir o uso ou nãoo utilizar substâncias bioacumulativas e tóxicas.
3) Produzir mais, gastando menos energia.
Analisando a questão dada, notamos que a segunda rota de síntese é verde,pois utiliza menos energia ( baixa temperatura e ocorre em uma única etapa)e o subproduto formado não é tóxico.

