CINÉTICA QUÍMICA
Estuda a velocidade e os fatores que interferem na velocidade de uma reação.
Velocidade de reação é a medida da rapidez com que são consumidos os reagentes e são formados os produtos.
Há reações lentas, rápidas e reações instantâneas.
Reação lenta: reação de um pedaço de ferro com o ar atmosférico (formação da ferrugem).
Reação rápida: reação de combustão da gasolina.
Reação instantânea: reação do gás hidrogênio com o gás oxigênio na presença de uma faísca.
Em uma reação genérica: c C + b B a A
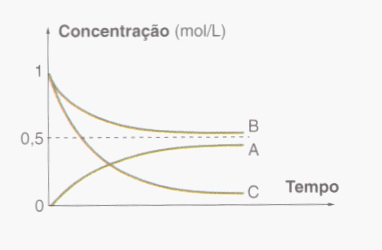
Durante uma reação, a concentração dos reagentes vai diminuindo e a concentração dos produtos vai aumentando.
VELOCIDADE MÉDIA (Vm)
A velocidade média pode ser determinada em relação aos reagentes ou produtos de uma reação e obedece a uma proporção estequiométrica.
Vm = 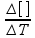 onde Δ[ ] = variação de concentração molar ΔT = variação de tempo
onde Δ[ ] = variação de concentração molar ΔT = variação de tempo
EXEMPLO: a A + b B cC + dD
Vma VmB VmC VmD
Vm REAÇÃO = VmA /a = VmB /b = VmC /c = VmD /d
Fatores que interferem na velocidade de reação:
Temperatura: O aumento da temperatura aumenta a energia cinética das moléculas, aumentando as colisões efetivas e a velocidade da reação.
Superfície de contato: Quanto maior a superfície de contato, maior será a velocidade de reação.
Exemplo: zinco em pó reage mais rapidamente (facilmente) que uma barra de zinco.
Concentração dos reagentes: Quanto maior a concentração, maior a quantidade de soluto, maior o número de colisões efetivas, maior o número de ligações quebradas e maior a velocidade de reação.
Catalisador: Acelera uma reação porque diminui a energia de ativação.
CONDIÇÕES DE OCORRÊNCIA DE UMA REAÇÃO
Afinidade entre os reagentes: não pode ser medida com exatidão.
Contato entre os reagentes: é o fato mais evidente para que ocorra uma reação química.
Energia de ativação (Ea): é a quantidade mínima de energia, dada aos reagentes para dar início a uma reação química. Quanto menor a energia de ativação ( Ea), maior será a velocidade da reação.
Colisões efetivas ou eficazes: são aquelas que ocorrem com uma geometria favorável. Quanto maior o número de colisões efetivas, maior será a velocidade de reação.

Complexo ativado ( Ca ): é o estado intermediário entre os reagentes e produtos, onde nos reagentes as ligações são quebradas e nos produtos as ligações são formadas.
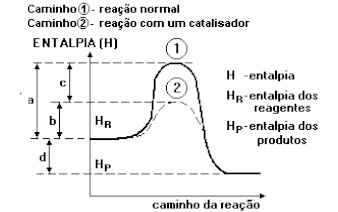
d = Variação de entalpia (ΔH ).
b = Energia de ativação na presença de catalisador.
a = Energia de ativação sem catalisador.
c = abaixamento provocado pela ação do catalisador.
1- Complexo ativado da reação sem catalisador.
2- Complexo ativado com catalisador.
LEI OU EQUAÇÃO DA VELOCIDADE
A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, elevadas a um expoente determinado experimentalmente.
Nas reações elementares ( ocorrem em uma única etapa ) o expoente é o próprio coeficiente.
Exemplo: N2(g) + 3 H2(g) 2 NH3(g)
V = k [N2]1[H2]3
V = velocidade.
K = Constante de velocidade (depende da temperatura).
[ ] = Concentração molar dos reagentes.
1 e 3 = Expoentes quando a reação for elementar.
ORDEM DA REAÇÃO
A reação é de ordem 1 em relação ao N2.
A reação é de ordem 3 em relação ao H2
A ordem da reação é igual a 4
DICAS PARA RESOLUÇÃO DE QUESTÕES DE CINÉTICA QUÍMICA
1- A velocidade da reação sempre será medida em função da etapa lenta ( vem indicando lenta ou o valor da velocidade ).
2- No início ( t = 0 ) a concentração dos reagentes é máxima e a dos produtos é mínima ( zero ).
3- Durante a reação, a concentração dos reagentes vai diminuindo e a concentração dos produtos vai aumentando.
4- Quanto menor a energia de ativação, maior a velocidade da reação.
5- Para calcular a energia de ativação: Ea = HCA – HR
6- O valor de Energia de ativação será positivo, pois a energia de ativação do complexo ativado (HCA) sempre será maior que o HR.
7- Catalisador acelera uma reação, porque diminui a energia de ativação. A energia de ativação atua como sendo uma “barreira”, ou seja, quanto menor a barreira, mais rápido é a reação.
8- A reação elementar é aquela que ocorre em uma única etapa, ou seja, temos apenas uma reação.
9- Quando a reação não for elementar, é dada uma tabela onde a reação ocorre em várias etapas, com os valores de concentração e velocidade. Neste tipo de questão não temos os expoentes. Resolva as questões e verifique a resolução comentada no site.
Cuidado!
Nas reações que não são elementares é comum encontrar uma reação devidamente balanceada, porém os expoentes não serão os coeficientes.
RESOLVA AS QUESTÕES PROPOSTAS NO SITE E SUCESSO NOS ESTUDOS

