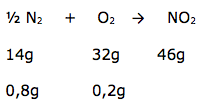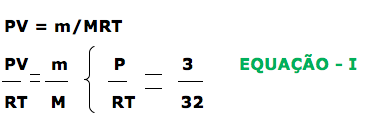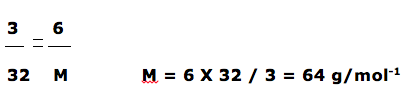AULA 01
-
ESTEQUIOMETRIA
-
TERMOQUÍMICA
-
GASES
-
ELETROQUÍMICA
01 - (UFG GO/2013)
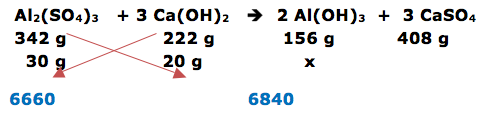
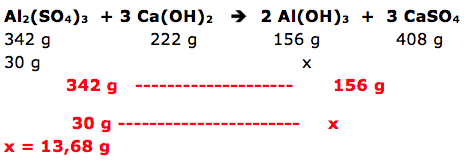
O hidróxido de alumínio é um composto químico utilizado no tratamento de águas. Uma possível rota de síntese desse composto ocorre pela reação entre o sulfato de alumínio e o hidróxido de cálcio. Nessa reação, além do hidróxido de alumínio, é formado também o sulfato de cálcio. Assumindo que no processo de síntese tenha-se misturado 30 g de sulfato de alumínio e 20 g de hidróxido de cálcio, determine a massa de hidróxido de alumínio obtida, o reagente limitante da reação e escreva a equação química balanceada da síntese. Dados: H = 1 O = 16 Al = 27 Ca = 40 S = 32
02 - (UNICAMP SP/2015)
Um importante fator natural que contribui para a formação de óxidos de nitrogênio na atmosfera são os relâmpagos. Considere um espaço determinado da atmosfera em que haja 20 % em massa de oxigênio e 80 % de nitrogênio, e que numa tempestade haja apenas formação de dióxido de nitrogênio. Supondo-se que a reação seja completa, consumindo todo o reagente limitante, pode-se concluir que, ao final do processo, a composição percentual em massa da atmosfera naquele espaço determinado será aproximadamente igual a quanto? Dados: O = 16 N = 14
03 - (FUVEST SP/2015)
A figura abaixo ilustra as estabilidades relativas das espécies que apresentam estado de oxidação +2 e +4 dos elementos da mesma família: carbono, silício, germânio, estanho e chumbo.
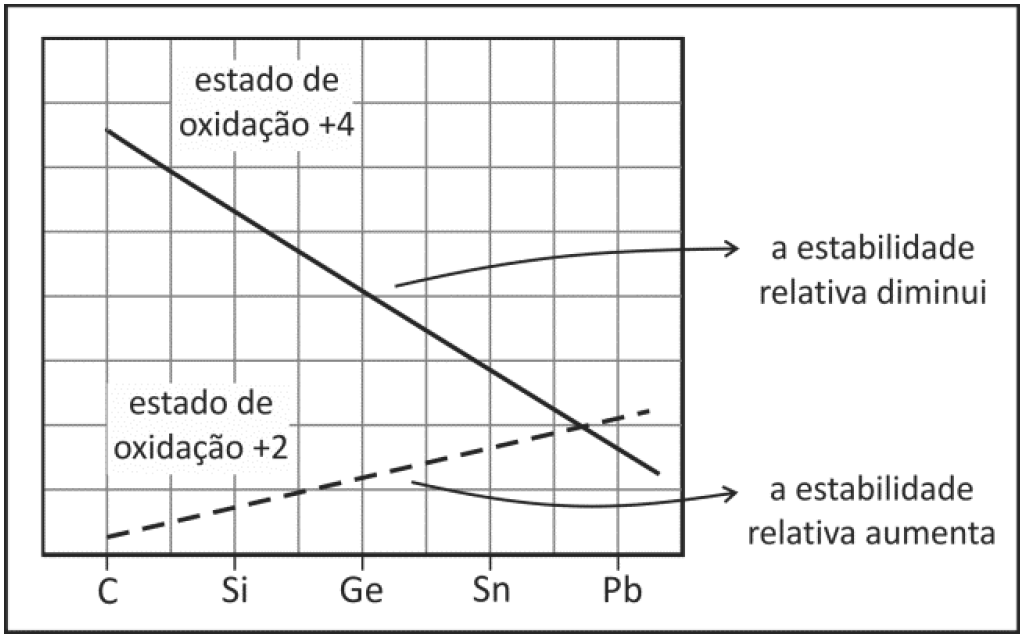
As estabilidades relativas podem ser interpretadas pela comparação entre potenciais padrão de redução das espécies +4 formando as espécies +2, como representado a seguir para os elementos chumbo (Pb), germânio (Ge) e estanho (Sn):
PbO2 + 4H+ + 2e– ![]() Pb2+ + 2H2O
Pb2+ + 2H2O ![]()
GeO2 + 2H+ + 2e– ![]() GeO + H2O
GeO + H2O ![]()
SnO2 + 4H+ + 2e– ![]() Sn2+ + 2H2O
Sn2+ + 2H2O ![]()
Os potenciais padrão de redução dessas três semirreações, ![]() ,
, ![]() e
e ![]() , foram determinados experimentalmente, obtendo‐se os valores –0,12 V, –0,094 V e 1,5 V, não necessariamente nessa ordem.
, foram determinados experimentalmente, obtendo‐se os valores –0,12 V, –0,094 V e 1,5 V, não necessariamente nessa ordem.
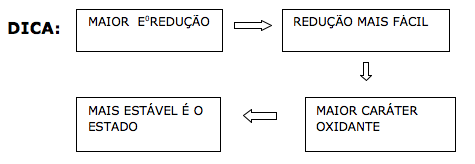
Sabe‐se que, quanto maior o valor do potencial padrão de redução, maior o caráter oxidante da espécie química.
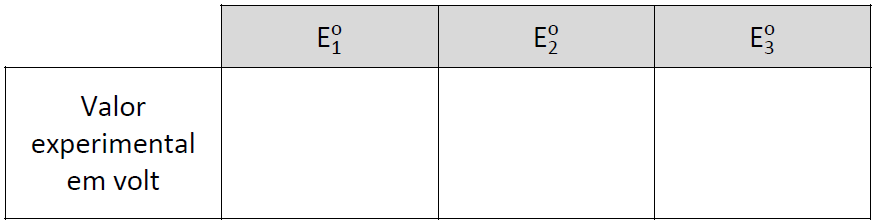
a) Considerando as informações da figura, atribua, na tabela abaixo, os valores experimentais aos potenciais padrão de redução ![]() ,
, ![]() e
e ![]() .
.
b) O elemento carbono pode formar óxidos, nos quais a proporção entre carbono e oxigênio está relacionada ao estado de oxidação do carbono. Comparando os óxidos CO e CO2, qual seria o mais estável? Explique, com base na figura apresentada acima.
04 - (UNESP SP )
Encanamentos de ferro mergulhados em água sofrem corrosão, devido principalmente à reação:
Fe(s) + 2H+(aq) Fe2+(aq) + H2(g)
Para proteger encanamentos nessas condições, costuma-se ligá-los a barras de outros metais, que são corroídos ao invés dos canos de ferro. Conhecendo os potenciais padrão de redução
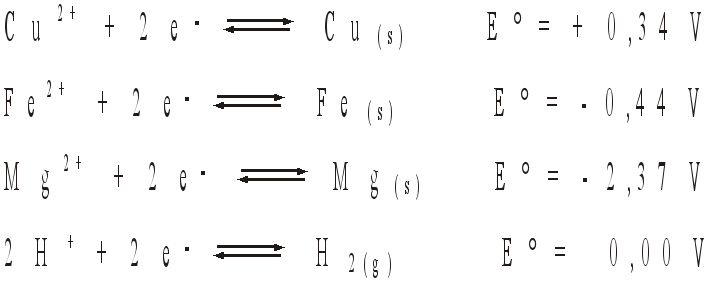
e dispondo-se de barras de magnésio e cobre, propõe-se:
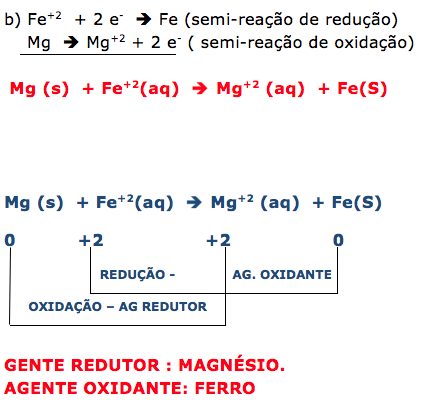
a) Qual metal deve ser utilizado para proteger o encanamento? Justifique.
b) Escreva as reações que ocorrem na associação do cano de ferro com a barra metálica escolhida, indicando o agente oxidante e o agente redutor.
05 - (Fac. Santa Marcelina SP/2014-mod)
O ítrio-90 é um radioisótopo que tem sido cada vez mais utilizado no tratamento de tumores, especialmente do fígado, e apresenta meia-vida de 64 horas. No gráfico, sem escala definida, a curva mostra a atividade de certa amostra de 90Y ao longo do tempo.
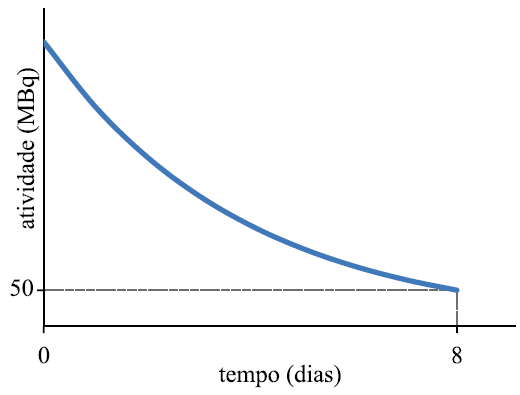
De acordo com os valores indicados no gráfico, qual o valor da atividade, em MBq, no tempo zero ?
06 - (FUVEST SP/2013)
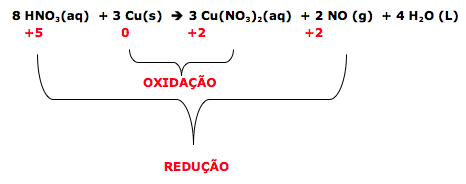
Uma estudante de Química elaborou um experimento para investigar a reação entre cobre metálico (Cu) e ácido nítrico (HNO3(aq)). Para isso, adicionou o ácido nítrico a um tubo de ensaio (I) e, em seguida, adicionou raspas de cobre metálico a esse mesmo tubo. Observou que houve liberação de calor e de um gás marrom, e que a solução se tornou azul. A seguir, adicionou raspas de cobre a dois outros tubos (II e III), contendo, respectivamente, soluções aquosas de ácido clorídrico (HCl(aq)) e nitrato de sódio (NaNO3(aq)). Não observou qualquer mudança nos tubos II e III, ao realizar esses testes.
Sabe-se que soluções aquosas de íons Cu2+ são azuis e que o gás NO2 é marrom.
a) Escreva, as equações que representam a semirreação de oxidação e a semirreação de redução que ocorrem no tubo I.

b) Qual foi o objetivo da estudante ao realizar os testes com HCl (aq) e NaNO3(aq)? Explique.
07 - (FGV SP/2013-mod)
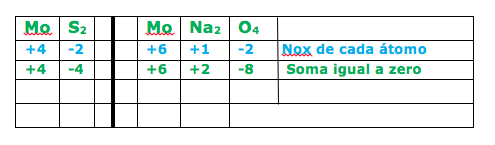
O molibdênio é um metal de aplicação tecnológica em compostos como MoS2 e o espinélio, MoNa2O4, que, por apresentarem sensibilidade a variações de campo elétrico e magnético, têm sido empregados em dispositivos eletrônicos.
Qual os números de oxidação do molibdênio no MoS2 e no MoNa2O4 ?
08 - (IME RJ/2014-mod)
Um hidreto gasoso tem fórmula empírica XH3 (massa molar de X = 13 g/mol) e massa específica de 6,0 g/L numa dada condição de temperatura e pressão. Sabendo-se que, nas mesmas temperatura e pressão, 1,0 L de O2 gasoso tem massa de 3,0 g, Determine a fórmula molecular do hidreto.
09 - (UEL PR/2015)
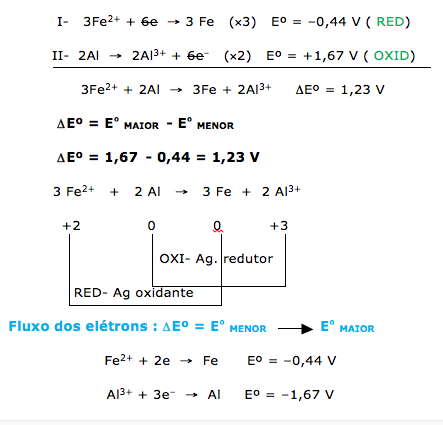
A pilha de Daniell é constituída basicamente de uma placa metálica de cobre mergulhada em uma solução de sulfato de cobre, constituindo o cátodo, e por uma placa metálica de zinco mergulhada em solução de sulfato de zinco, constituindo o ânodo. Ambos os metais são interligados por um circuito elétrico, e uma ponte salina faz a união das duas células, permitindo a migração de íons entre elas. A reação global que ocorre nessa pilha é representada por Cu2+ + Zn Cu + Zn2+, cuja diferença de potencial (Eº) da pilha formada é de 1,10 V. Um estudante resolveu testar uma nova configuração de pilha, substituindo o cobre por uma placa metálica de alumínio mergulhada em uma solução de Al2(SO4)3 e o zinco por uma placa metálica de ferro mergulhada em uma solução de FeSO4. As semirreações de redução envolvidas para a nova pilha construída são dadas a seguir.
Fe2+ + 2e → Fe Eº = –0,44 V
Al3+ + 3e– → Al Eº = –1,67 V
Com base nessas informações,
a) escreva a equação química balanceada que representa esse processo e a diferença de potencial da nova pilha construída;
b) indique o fluxo de elétrons, o agente oxidante e o agente redutor nessa nova pilha construída.
10 - (Unimontes MG/2015 MOD)
Determinadas peças de um antiquário foram submetidas a um banho de prata. Para cada grama de prata processada foram gastos R$2,10 (dois reais e dez centavos). Nesse processo, a quantidade de carga envolvida foi de 100 F.
Qual o valor gasto no processo, em reais? Dados: Ag = 108
GABARITO E RESOLUÇÃO COMENTADA – R-2 – AULA-01
ESTEQUIOMETRIA, TERMOQUÍMICA, GASES, ELETROQUÍMICA
1- RESOLUÇÃO:
O enunciado da questão fornece os reagentes e produtos. A reação é:
Al2(SO4)3 + 3 Ca(OH)2 2 Al(OH)3 + 3 CaSO4
O enunciado pede para determinar o reagente limitante.
Dica: Quando a questão fornece dois valores de massa ou de mols dos reagentes, provalvelmente algum valor está em excesso. Para determinar o reagente em excesso, vamos multiplicar em cruz e encontrar dois números. O maior número encontrado indica o reagente em excesso.
Obs: esses dois números encontrados servem apenas para indicar o reagente em excesso
Encontramos os valores 6660 e 6840. Isto indica que o reagente em excesso é o Ca(OH)2 e o limitante é o Al2(SO4)3
DICA: os cálculos são realizados com o reagente limitante.
2- RESOLUÇÃO
Dica: foi dado a porcentagem dos gases, portanto podemos dizer que a massa de cada um é de 0,8 g de N2 e 0,2 g de O2. Quando a questão fornece dois valores de massa ou de mols, provalvelmente um deles está em excesso.
Para resolver, vamos utilizar o mesmo procedimento da questão anterior.
Concluímos que o reagente em excesso é o N2 e o limitante é o O2, indicando que os cálculos são realizados com o reagente limitante.
Vamos calcular a massa de N2 que reagiu e a massa de NO2 formada.
X = 0,0875 g de N2 (aproximando: 0,09g de N2 ).
Y = 0,2875 g de NO2 ( aproximando: 0,29 g de NO2).
Calculando a quantidade N2 no final.
0,8 g inicial – 0,09 g reagiu = 0,71g = 71%
NO2 = 0,29g= 29%
Concluímos que a porcentagem é de 71% N2 e 29%
3 - RESOLUÇÃO
Verificando o gráfico, notamos que o chumbo Pb+2 é o mais estável com número de oxidação +2. Portanto o Pb+2 possui o maior E0 redução ( 1,5 v ).
O germânio é o elemento menos estável ( nox = +2 ), portanto possui o menor E0 de redução (- 0,12 v ).
Logo o estanho Sn+2 = - 0,094 v
|
VALOR EXPER EM VOLTS |
E1 |
E2 |
E3 |
|
1,5 V |
-0,12 V |
- 0,094 V |
b) Vamos determinar o nox em cada um dos óxidos dados.
C O C O2
+2 -2 +4 -2
Através do gráfico, notamos que a estabilidade do C+4 é maior que a do C+2, pelo critério o CO2 é o mais estável.
4- RESP: A
De acordo com o texto ,para proteger encanamentos de ferro, costuma-se ligá-los a barras de outros metais, que são corroídos ao invés dos canos de ferro (atuam como metal de sacrifício). Conhecendo os potenciais padrão de redução sabemos que quanto menor o potencial de redução, maior será o poder de oxidação ( será corroído antes do ferro ).
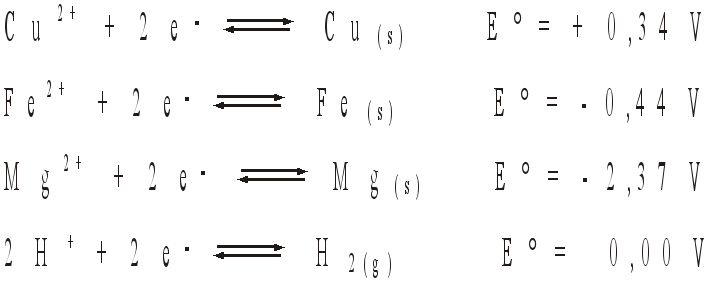
a) Verificando a tabela o metal que obedece a descrição acima é o magnésio (Mg), que possui potencial de redução – 2,37 V, menor que o ferro – 0,44 V.
5- Resolução
A questão fala sobre o ítrio-90 que é um radioisótopo que tem sido cada vez mais utilizado no tratamento de tumores, e apresenta meia-vida de 64 horas.

Segundo o gráfico foram decorridos 8 dias = 192 horas( o dia tem 24 horas).
A meia-vida é de 64 horas. Portanto temos que 192 horas = 3 meia-vida.
50 MBq -------------- 100 MBq --------------200 MBq ---------------400 MBq
(T = 8 dias ) ( t = 0 dias)
6- RESOLUÇÃO
A REAÇÃO CITADA NO TEXTO É:
a) Semi-reação de oxidação: Cu(s) → Cu2+(aq) + 2e–
Nesta reação o agente redutor é o cobre.
Na reação de redução o agente oxidante é o HNO3 (aq)
Semi-reação de redução: HNO3(aq) + H+(aq) + e– → NO2(g) + H2O(l).
b) Com o HCl ou NaNO3 não ocorreu reação. Portanto O objetivo era testar o agente oxidante do metal cobre, já que poderia ser somente o H+(aq), somente o NO![]() (aq) ou ambos. Como não ouve oxidação do cobre metálico somente com o H+(aq) ou com o NO
(aq) ou ambos. Como não ouve oxidação do cobre metálico somente com o H+(aq) ou com o NO![]() (aq), o agente que oxida o metal é o conjunto H+(aq) com NO
(aq), o agente que oxida o metal é o conjunto H+(aq) com NO![]() (aq) ou simplesmente o ácido nítrico (HNO3 (aq).
(aq) ou simplesmente o ácido nítrico (HNO3 (aq).
7- Resolução
Esta questão pede para determinar o número de oxidação molibdênio (Mo) no MoS2 e o espinélio, MoNa2O4 .
Dica: Alguns elementos apresentam nox fixo. Nesta questão temos o sódio ( Na ) que possui nox = +1, pois pertence a família 1A e o oxigênio (O ) que possui nox igual a -2, exceto nos peróxidos onde o nox do oxigênio será -1
No primeiro quadrante ( azul) colocamos o nox conhecido para cada elemento. No quadrante de baixo ( verde ) colocamos o total de cargas, onde a soma será igual a zero.
No primeiro exemplo o enxofre possui nox variável, mas como está formando um composto de fórmula MoS2, concluímos que o enxofre é -2 e o Mo é igual a +4 , pois irá formar o composto Mo2S4. Como 2 e 4 são multíplos, simplificamos e encontramos a fórmula MoS2
8- Resolução
A questão fornece dados do gás oxigênio que serão utilizados para determinar a fórmula molecular do hidreto.
Dados fornecidos: m = 3 gramas M = 32 g.mol-1 V = 1 L
Agora vamos calcular para o hireto
d = 6 g/L
Substituindo I em II
Determinação da fórmula molecular.
A questão informou que a massa de X = 13 g/mol e H = 1 g/mol
(XH3)Y = 64 ( 13 + 3 )y = 64 16 Y = 64 y = 4
A fórmula será X4H12
9- Resolução
Fe2+ + 2e → Fe Eº = –0,44 V
Al3+ + 3e– → Al Eº = –1,67 V
A questão forneceu as semirreações de redução.
Dica: A semireação com o maior potencial sofre redução. Isto indica que a outra semireação sofre oxidação e deve ser invertida
a)Para balancear a equação química ,vamos multiplicar a primeira por 3 e a segunda por 2.
O fluxo de elétrons vai do Al (ânodo) para o Fe2+ (cátodo), o agente oxidante é Fe2+ e o agente redutor é Al.
Dica: 0xidação perde elétrons aumento algébrico agente redutor.
Redução recebe elétrons diminuição algébrico agente oxidante
10- Resolução
Vamos escrever a semireação de redução ( sofre deposição ).
Ag+ + 1 e- Agº
96500 C ------ ------ 108 g
100(96500 ) C ------ X
X = 10800 gramas
Dica : 1mol e- = 1F = 96500 C
Cálculo do valor gasto.
1grama -------- R$2,10
10800 gramas ----- x
X = 22680,00 reais