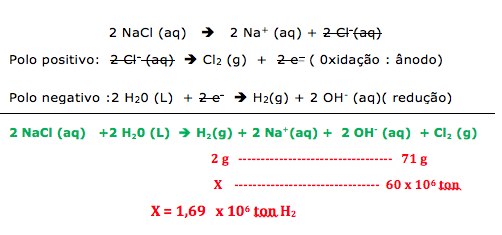AULA 02
-
ELETROQUÍMICA
-
TEORIA ATÔMICO MOLECULAR
-
CINÉTICA QUÍMICA
-
EQUILÍBRIO QUÍMICO
01 - (FUVEST SP/2014)
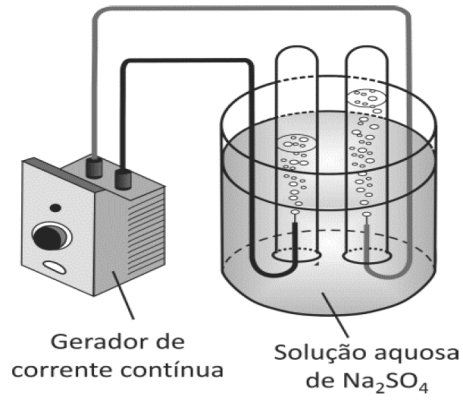
Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água.
Após a montagem de uma aparelhagem como a da figura abaixo, e antes de iniciar a eletrólise, a professora perguntou a seus alunos qual dos dois gases, gerados no processo, eles esperavam recolher em maior volume. Um dos alunos respondeu: “O gás oxigênio deve ocupar maior volume, pois seus átomos têm oito prótons e oito elétrons (além dos nêutrons) e, portanto, são maiores que os átomos de hidrogênio, que, em sua imensa maioria, têm apenas um próton e um elétron”.
Observou‐se, porém, que, decorridos alguns minutos, o volume de hidrogênio recolhido era o dobro do volume de oxigênio (e essa proporção se manteve no decorrer da eletrólise), de acordo com a seguinte equação química:
a) Considerando que a observação experimental não corresponde à expectativa do aluno, explique por que a resposta dada por ele está incorreta.
Posteriormente, o aluno perguntou à professora se a eletrólise da água ocorreria caso a solução aquosa de Na2SO4 fosse substituída por outra. Em vez de responder diretamente, a professora sugeriu que o estudante repetisse o experimento, porém substituindo a solução aquosa de Na2SO4 por uma solução aquosa de sacarose (C12H22O11).
b) O que o aluno observaria ao realizar o novo experimento sugerido pela professora? Explique.
02 - (UFG GO/2014-mod)
Um determinado volume de água foi colocado em um recipiente de formato cúbico e em seguida resfriado à 0 ºC. Após a mudança de estado físico, um analista determinou o número de moléculas presentes no cubo de água formado. Desprezando possíveis efeitos de compressão ou expansão e admitindo a aresta do cubo igual a 3 cm, qual o número aproximado de moléculas de água presentes no cubo ? Dados: H = 1 O = 16
03 - (UNESP SP/2013)
Uma forma de obter hidrogênio no laboratório é mergulhar zinco metálico em uma solução de ácido clorídrico, conforme a reação descrita pela equação apresentada a seguir.
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g)
Considere que uma tira de zinco metálico foi colocada em um recipiente contendo HCl em solução aquosa na concentração de 1 mol/L. Em 20 segundos a temperatura do recipiente elevou-se em 0,05 ºC e 25 mL de hidrogênio foram produzidos.
Considerando que essa reação ocorreu a 27 ºC e 1 atm, determine a velocidade da reação em mL H2/s e em mol H2/s. Dado: R = 0,082 L · atm · K–1 · mol–1
04 - (UECE/2015 MOD)
O tetróxido de dinitrogênio gasoso, utilizado como propelente de foguetes, dissocia-se em dióxido de nitrogênio, um gás irritante para os pulmões, que diminui a resistência às infecções respiratórias.
Considerando que no equilíbrio a 60 °C, a pressão parcial do tetróxido de dinitrogênio é 1,4 atm e a pressão parcial do dióxido de nitrogênio é 1,8 atm. Qual a constante de equilíbrio Kp ?
05 - (UFG GO/2014)
Em um laboratório, um analista misturou 1 L de uma solução de ácido clorídrico 0,1 mol/L com 1 L de uma solução de hidróxido de sódio 0,2 mol/L.
A partir das informações fornecidas,
a) escreva a equação química balanceada.
b) calcule a concentração molar e o valor do pH da solução resultante. Use log 5 = 0,70.
06 - (UNICAMP SP/2014)
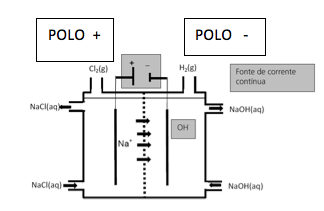
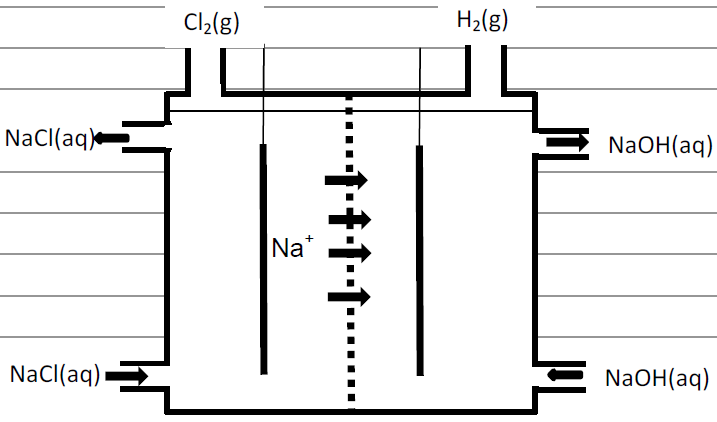
A produção mundial de gás cloro é de 60 milhões de toneladas por ano. Um processo eletroquímico moderno e menos agressivo ao meio ambiente, em que se utiliza uma membrana semipermeável, evita que toneladas de mercúrio, utilizado no processo eletroquímico convencional, sejam dispensadas anualmente na natureza. Esse processo moderno está parcialmente esquematizado na figura abaixo.
a) Se a produção anual de gás cloro fosse obtida apenas pelo processo esquematizado na figura abaixo, qual seria a produção de gás hidrogênio em milhões de toneladas?
b) Na figura, falta representar uma fonte de corrente elétrica e a formação de íons OH–. Complete o desenho com essas informações, não se esquecendo de anotar os sinais da fonte e de indicar se ela é uma fonte de corrente alternada ou de corrente contínua.
07 - (Mackenzie SP/2015 MOD)
Determine, respectivamente, o pH e a constante de ionização de uma solução aquosa de um ácido monocarboxílico 0,01 M, a 25ºC, que está 20% ionizado, após ter sido atingido o equilíbrio. Dado: log 2 = 0,3
GABARITO E RESOLUÇÃO COMENTADA – R-2 – AULA-02
EQUILÍBRIO QUÍMICO, TEORIA ATÔMICO MOLECULAR, CINÉTICA QUÍMICA, ELETROQUÍMICA
1 – RESOLUÇÃO
Na eletrólise de uma solução aquosa de Na2SO4 a prioridade de descarga no cátodo é do H+ e no ânodo a prioridade de descarga é do OH-
PRIORIDADE DO H+ : 2 H+ + 2 e- è H2
PRIORIDADE DO OH- : 2 OH- è H2O + ½ O2 + 2 e-
a) A resposta está incorreta porque o volume ocupado por gases nas mesmas condições de temperatura e pressão, o número de mols ou moléculas será igual ao volume em litros, independendo de tamanho, massa ou composição dos átomos que formam as moléculas desse gás.
b) O aluno não observaria a liberação dos gases porque a solução aquosa de C12H22O11(molecular) não é eletrolítica, não conduz corrente elétrica e não permiti a eletrólise.
2- Resolução
A questão indica que o cubo possui aresta de 3 cm.
Vamos calcular o volume de água no cubo = 33 cm = 27 cm3 de água = 27 gramas de água, pois a densidade da água é igual a 1 g/cm3.
Calculo do número de moléculas
18 g H2O ---------------- 6,0 X 1023 moléculas
27 g H2O ---------------- X
X = 9 X 1023 moléculas
3- RESOLUÇÃO
Dada a reação: Zn (s ) + 2 HCl (aq) ZnCl2(aq) + H2(g).
A questão fornece os dados sobre o gás hidrogênio. Assim podemos calcular o número de mols obtido do H2
PV = n R T è n = 1. 0,025 / 0,082 . 300
n = 0,001 mol de H2
Cálculo da velocidade da reação em mol/s.
0,001 mol --------------- 20s
X ------------------------- 1s
X =5 x 10-5 mol/s
Cálculo da velocidade da reação em mL/s.
25 mL --------------- 20s
X ------------------------- 1s
X =1,25 mL/s
4-Resolução
Esta questão envolve equilíbrio gasoso. A partir do enunciado podemos escrever o equilíbrio: N2O4(g) ↔ 2 NO2.
Os valores de pressão foram dados no equilíbrio e podemos aplicar a fórmula direta.
5- RESOLUÇÃO
DICA: No momento que calculamos o reagente em excesso, já podemos afirmar que o pH é maior que 7, pois o excesso é de base, indicando que vamos calcular primeiro o pOH e depois o pH.
A questão fornece o log 5 = 0,70.
pOH = - log [OH-]
pOH = - log 5 x 10-2
pOH = - ( log 5 + log 10-2 )
pOH = - ( 0,7 – 2 )
pOH = - 0,7 + 2
pOH = 1,3
Temos:pH + pOH = 14
pH = 12,7
6- RESOLUÇÃO
b)
Na figura, observa-se em fundo cinza, a representação da fonte de corrente elétrica contínua, os sinais dos eletrodos (polos) e o compartimento em que são produzidos os íons OH–.
7-Resolução
Dica: Nos ácidos carboxílicos, o hidrogênio ionizável é aquele ligado ao oxigênio da carboxila.