ISOMERIA
Isomeria: Fenômeno de ocorrência de isômeros.
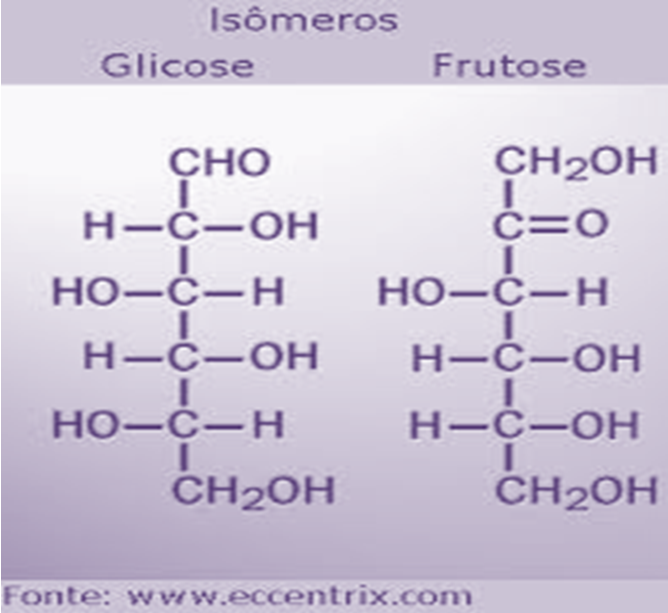
Isômeros: possuem a mesma fórmula molecular, mas diferem estruturalmente ou geometricamente.
Isomeria plana:
Verifica-se a diferença entre os isômeros através do estudo de suas fórmulas estruturais planas.
Isomeria de função: os isômeros pertencem a funções diferentes. Ex: C2H6O ( etanol e éter metílico.
Os casos principais de isomeria funcional ocorrem entre as funções:
Aldeído – cetona, álcool – éter e ácido carboxílico – éster.
Isomeria de cadeia ou núcleo: os isômeros pertencem à mesma função, mas apresentam diferentes tipos de cadeia. Ex: C4H10 (butano e metil propano).
Isomeria de posição: Pertence à mesma função, tem o mesmo tipo de cadeia, mas apresentam diferença na posição do grupo funcional, de uma ramificação ou de insaturação. Ex: C3H8O ( 1- propanol e 2- propanol ), C4H8 ( 1 – buteno e 2- buteno ).
Isomeria de compensação ou metameria: os isômeros pertencem à mesma função e apresentam o mesmo tipo de cadeia, mas apresentam diferença na posição de um heteroátomo (O, N, S entre átomos de carbono) Ex: C4H8O2 (acetato de etila e metanoato de propila).
Isomeria dinâmica ou tautomeria: esse é um caso particular de isomeria de função, no qual os isômeros coexistem em equilíbrio dinâmico em solução. Os principais casos de tautomeria( tautos: dois de si mesmo ) envolvem compostos carbonílicos.
Ao preparar uma solução de aldeído acético, uma pequena parte se transforma em etenol (enol : compostos derivados de hidrocarbonetos insaturados, substituindo o hidrogênio de um carbono da dupla ligação ( não pertencente ao anel benzênico ) por uma hidroxila ) o qual por sua vez , regenera o aldeído, estabelecendo um equilíbrio químico em que o aldeído, por ser mais estável, está presente em maior concentração.
Exemplo 1
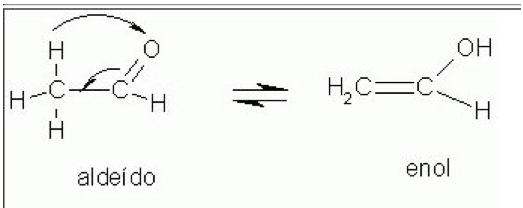
Equilíbrio aldoenólico. ocorrem entre aldeídos – enol
Após a formação do eteno,o oxigênio ( mais eletronegativo) atrai fortemente os elétrons da dupla ligação que o carbono realiza, que é uma ligação fraca e fácil de deslocar,regenerando o etanal e as duas substâncias passam a existir em equilíbrio dinâmico.
Exemplo 2
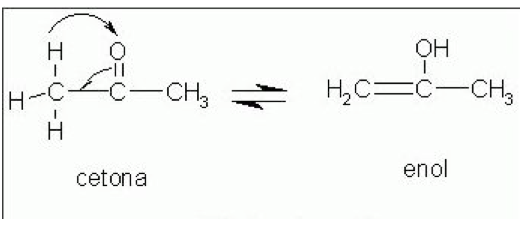
Equilíbrio cetoenólico. cetona- enol.
DICA: A isomeria dinâmica ou tautomeria é muito importante nas formações cetoenólicas da guanina , que é uma das quatro bases nitrogenadas que compõem o DNA. A guanina sempre se emparelha com a citosina, na formação da dupla-hélice do DNA.
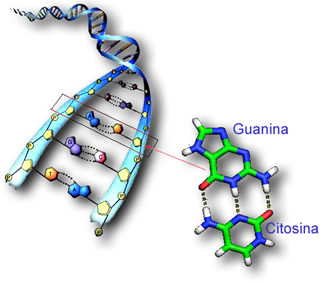
Fonte: Brasil escola
Isomeria Espacial : A diferença entre os isômeros só é perceptível pela análise da fórmula estrutural espacial
Isomeria Geométrica : CIS – TRANS ou Z – E
1) Condições de ocorrência:
a) dois carbonos ligados por dupla ligação e cada um desses carbonos tenham dois ligantes diferentes entre si.
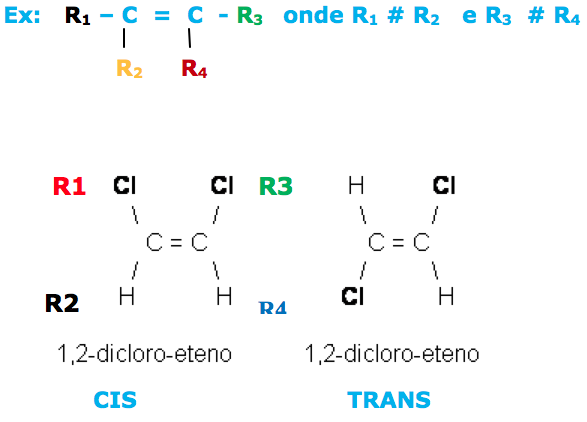
Através do exemplo acima, notamos que onde R1 # R2 e R3 # R4
Verificamos que R2 e R4 estão situados no mesmo lado do plano (CIS).
Quando R2 e R4 estão situados em lados opostos do plano (TRANS).
b) Isomeria ciclânica ou bayeriana: ocorre em compostos cíclicos e os radicais podem encontrar-se do mesmo lado ou em lados opostos, em relação ao plano do anel. Esse tipo de isomeria, ocorre sempre que existir dois radicais diferentes entre si, ligados a dois carbonos do anel.
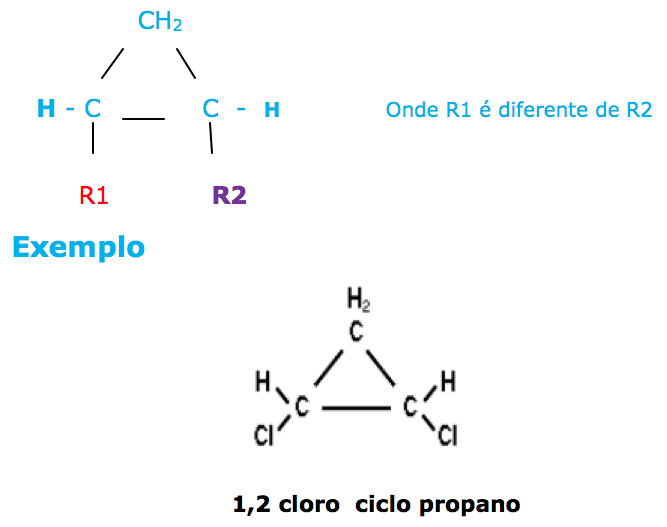
NOOOOOOOOOOOOOOSSA, SURGIU UMA DÚVIDA !!!!!!!!!!
Quando os ligantes são todos diferentes, qual será o cis e qual será o trans?
Para resolver, temos que considerar o número atômico dos ligantes. ( dados ou utilizando uma tabela periódica).
Exemplo No composto: 2-cloro-2-buteno, no primeiro carbono o ligante de maior número atômico é o Cl, e no segundo carbono o ligante de maior número atômico é o CH3. Assim, temos:

Ligantes com maior nº. atômico de mesmo lado do plano é usado para caracterizar o isômero cis, sendo o outro isômero considerado trans
As diferentes disposições espaciais dos átomos provocam alterações nas propriedades físicas desses compostos, como por exemplo no PE, devido à diferença de polaridade das moléculas.
ISOMERIA ÓPTICA
Os compostos que apresentam isomeria óptica tem a propriedade de desviar o plano da luz polarizada e são denominadas opticamente ativas .
O desvio do plano de vibração pode ocorrer em dois sentidos:
- Desvio para o lado direito : isômero destrógiro ( d ) .
- Desvio para o lado esquerdo : isômero levógiro ( l )
Isômeros opticamente ativos ( IOA) ( d ) e ( l ) que formam um par e apresentam o mesmo ângulo de desvio são denominados antípodas ópticos ou enantimorfos( formas opostas ).Sua mistura em quantidades equimolares produz uma mistura opticamente inativa ( IOI ), denominada mistura racêmica, conhecida como isômero racêmico [(dl)] ou [(r)] . A mistura racêmica não desvia o plano da luz polarizada

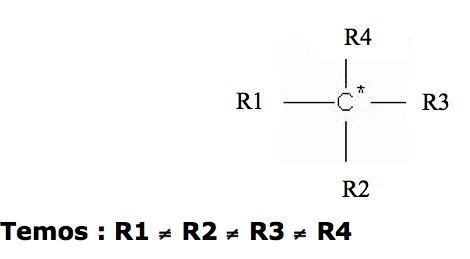
ATIVIDADE ÓPTICA: Só ocorre em moléculas assimétricas, isto é, apresentam o carbono assimétrico ( quiral). O carbonos quiral em uma molécula é aquele que apresenta quatro ligantes diferentes.

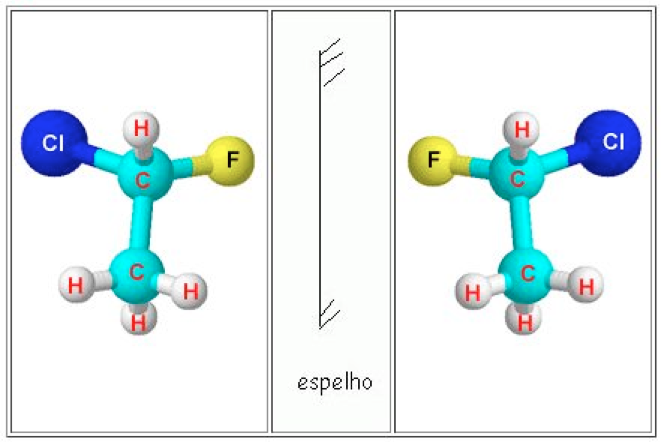
Isômeros enantioméricos: um é a imagem refletida do outro. No entanto, eles não são superponíveis. Um exemplo disso, são as mãos, direita e esquerda. Uma é a imagem da outra, mas não são superponíveis. Tente verificar este fato com suas mãos, coloque uma na frente da outra. (Uma será a imagem da outra).
Agora tente colocar uma sobre a outra. (As mãos não são superponíveis, ou seja, os dedos polegares não ficam um sobre o outro). Considere isso como um exemplo para entender o fato da assimetria molecular.
Compostos com dois carbonos assimétricos iguais:
Ocorre quando carbonos assimétricos apresentam os mesmos radicais, sendo “iguais”, cada carbono irá provocar o mesmo desvio no plano de luz polarizada. Portanto vamos ter dois isômeros com atividade óptica ( IOA), que misturados em partes iguais, eles formarão o racêmico. No entanto agora existe um isômero que por si só não tem atividade ópitica é inativo, portanto é chamado de meso ( tem um plano de simetria passando pelo meio da molécula )
A quantidade de isômeros opticamente ativos, pode ser dada a partir da quantidade de carbonos quirais em uma molécula.
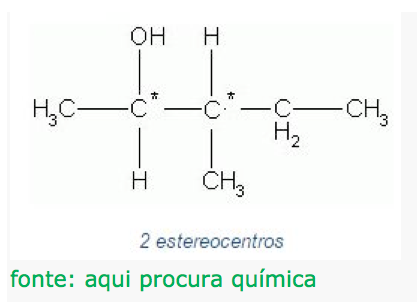
IOA- isômero oticamente ativo
IOA = 2n , sendo n o número de quirais.
Para a molécula dada, temos:
IOA = 22 = 4 , 4 isômeros ópticos ativos.
IOI- isômero oticamente inativos ( mistura racêmica)
IOI = 2 (n – 1) , sendo n o número de quirais.

