REAÇÕES ORGÂNICAS
Reação de Substituição
São reações em que ocorre a troca de um ligante. Esta reação é característica nos alcanos, ciclanos com anéis estáveis, aromáticos, entre outros compostos. Nestas reações a cadeia carbônica se mantém, não havendo aumento, nem diminuição do nº. de carbonos.
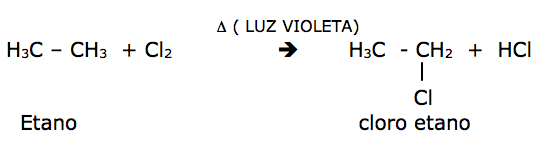
Substituição nos Alcanos
Os alcanos por serem poucos reativos ( parafinas: baixa afinidade ), são estáveis e só reagem em condições energéticas.
Halogenação: reatividade: F2 > Cl2 > Br2 > I2 . As reações que envolvem o flúor são muito violentas e as de iodo praticamente não ocorrem.
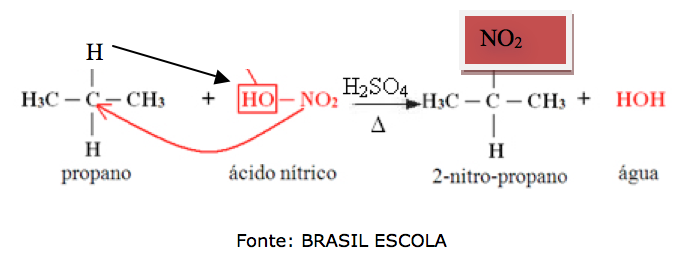
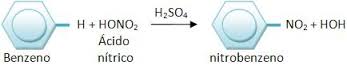
Nitração : reação com ácido nítrico ( HNO3 = HO – NO2 )
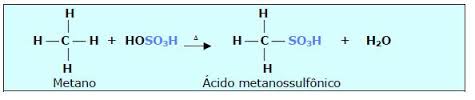
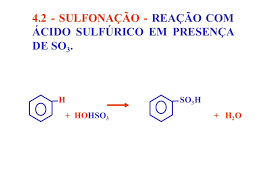
Sulfonação : reação com ácido sulfúrico ( H2SO4 = HO – SO3H )
Obs.: Em alcanos com três ou mais carbonos, o hidrogênio a ser substituído é o que se encontra no carbono menos hidrogenado. Este fato ocorre devido à influência da temperatura na formação dos produtos, e assim quanto mais baixa a temperatura maior é a produção de radicais com valência em C terciário ( mais estáveis ). Controlando as condições é possível estabelecer a composição desejada para os produtos.

Para os ciclanos, ocorre reação de substituição ( halogenação ) nos anéis com cinco ou mais carbonos.
Ciclopentano + Cl2 = clorociclopentano + HCl
Substituição em aromáticos :
Devido à estabilidade do anel aromático, as reações mais fáceis de ocorrer são as de substituição.
Halogenação : com presença de catalisadores ( FeCl3 , AlCl3 e Fe )
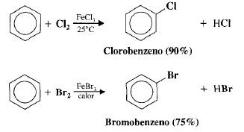
Nitração:
Sulfonação:
Alquilação: introdução de radical alquila ( formada pela retirada de um hidrogênio da cadeia de uma alcano ) no anel aromático. Esse tipo de reação usa haletos de alquila.
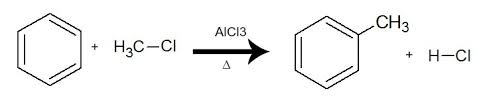
( alquilação de Friedel-crafts )
Dirigência
A entrada de um segundo radical no núcleo benzênico está condicionada ao radical preexistente, ou seja, o primeiro radical orienta a entrada do novo radical.
Se o radical ligado ao núcleo aromático for saturado ( apenas ligações simples ), o novo radical entra na posição ORTO ou PARA.
Radicais ORTO – PARA dirigentes ( - NH2 , - OH , - OCH3 , - CH3 , - Cl , - C2H5 ).
Estes radicais são também chamados radicais ativantes ou de 1º. Classe, porque a entrada de um desses radicais facilitará a entrada do 2º. Radical.
Se o radical ligado ao núcleo aromático for insaturado, apresentando dupla , tripla ligação ou ligação dativa, o novo radical entra na posição META .
Radicais META dirigentes ( - NO2 , - SO3H , - COOH , - COH , - CN )
Reações de adição.
São as reações em que duas ou mais moléculas se associam, originando uma única molécula.
Ocorrem nos hidrocarbonetos insaturados, devido à presença da ligação pi, que é mais fraca que a ligação sigma, e portanto rompe-se com maior facilidade.
Hidrogenação: Esta reação é realizada na presença de um catalisador metálico ( Ni , Pd ou Pt ) em que o pó absorve o gás hidrogênio, aumentando a superfície de contato e a velocidade de reação. O processo é denominado de reação de Sabatier – Senderens, muito empregada industrialmente na produção de alcanos.
Ex: propeno + H2 propano
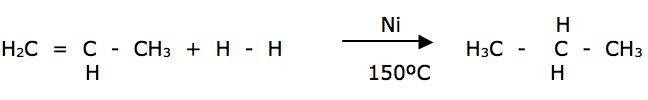
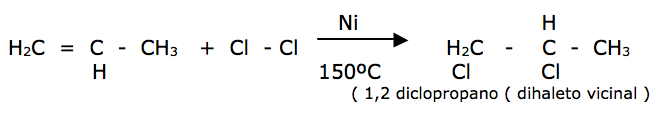
II – Halogenação de um alceno ( X2 – Cl2 ou Br2 ou HX ) produz um derivado dihalogenado vicinal ( halogênios em carbonos vizinhos ). A ordem de reatividade é Cl2 > Br2> I2
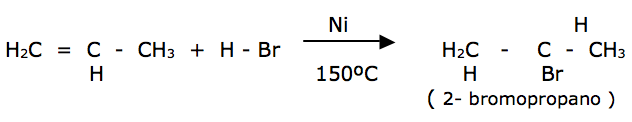
- HX ( HCl , HBr , HI ) A ligação pi adiciona, nesse caso, dois radicais diferentes. O hidrogênio irá para o carbono mais hidrogenado da dupla ligação ( regra de Markownikoff ). A ordem de reatividade é HI > HBr > HCl
- Hidratação: ocorre na presença de ácidos, originando alcoóis e também obedecem a regra de Markovnikov.
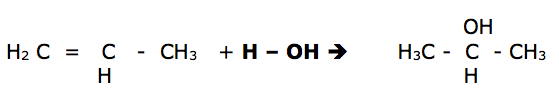
Os alcinos são mais reativos que os alcenos e fazem as mesmas reações de adição dos alcenos, podendo sofrer uma adição ou duas. ( total ou parcial )
III – Hidrogenação de um alcino. Nesses compostos há ruptura das duas ligações pi e formação de um alceno e um alcano.
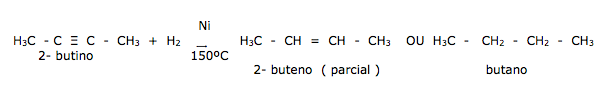
- Halogenação ( X2 ) de um alcino produz um derivado dihalogenado vicinal insaturado ou tetralogenado vicinal gêmeos

- Adição de um haleto de hidrogênio , produz um derivado monohalogenado insaturado ou um dihaleto gêmeo ( REGRA DE MARKOWNIKOFF )
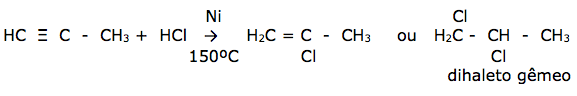
A adição de água em um alcino produz inicialmente um enol, que por tautomeria se transforma ( estabiliza) na forma de um aldeído ou cetona
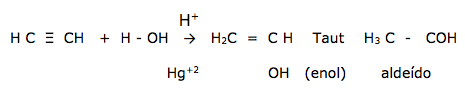
DICA: O etino ( acetileno ) é o único alcino que por hidratação fornece aldeído e não cetona.
Os ciclanos até o ciclobutano rompem a cadeia cíclica e dão reações de adição; o rompimento da cadeia do ciclopentano exige temperatura de 300 ºC.
Os ciclenos, devido à existência da ligação pi, dão reações de adição, independente do nº. de átomos de carbono no ciclo.
OZONÓLISE: Na reação com ozônio, os alcenos são transformados em ozonetos que, a seguir sofrem hidrólise, produzindo, além da água oxigenada, dois aldeídos, duas cetonas, ou um aldeído e uma cetona. Na reação emprega-se zinco para impedir a oxidação do aldeído pela água oxigenada.

Obs.: R - RADICAL
Oxidação enérgica
Ocorre devido a uma instabilidade molecular, processando-se a reação com apenas um rompimento da cadeia carbônica. É realizada com KmnO4 ou K2Cr2O7 em meio ácido.
- Forma-se ácido carboxílico no carbono sem ramificação.
- Forma-se cetona no carbono com ramificação.
- Forma-se CO2 no carbono que fica isolado
-Com a quebra da dupla ligação, forma-se inicialmente dois aldeídos, duas cetonas ou um aldeído e uma cetona
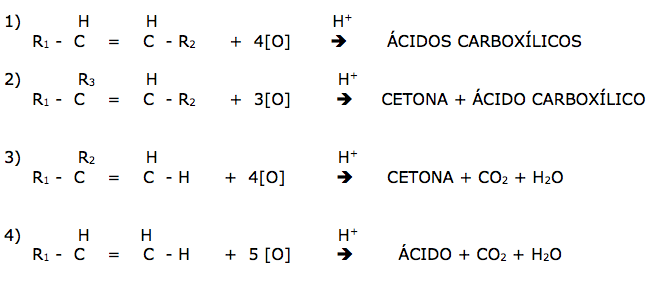
A oxidação enérgica de um alcadieno processa-se de forma similar a de um alceno.
Oxidação Branda: A reação se processa sem rompimento da cadeia carbônica. É obtida usando-se uma solução diluída, neutra ou levemente básica, de permanganato de potássio, conhecida como reativo de Baeyer. ( permite diferenciar um alceno de seu correspondente isômero ciclano, incapaz de descorar o reativo de Baeyer).
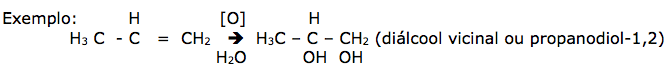
- Oxidação branda de um alceno produz diálcool ( não chega a romper à dupla, mas reage introduzindo radicais – OH na cadeia )
- A oxidação branda de um alcadieno fornece tetrálcool
- A oxidação branda de um alcino falso forma-se dicetona.
-Oxidação de um alcino verdadeiro ( tripla ligação na extremidade), forma-se aldeído - cetona.
Reação de HX em presença de peróxidos.
É também conhecida como reação de Karasch. Neste caso a orientação de adição dos radicais é exatamente contrária à regra de Markownikoff .
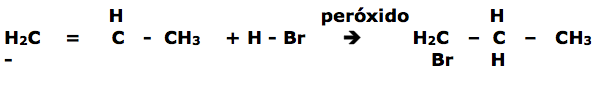
ÁLCOOL
Apresenta o radical funcional R – OH
Principais alcoóis:
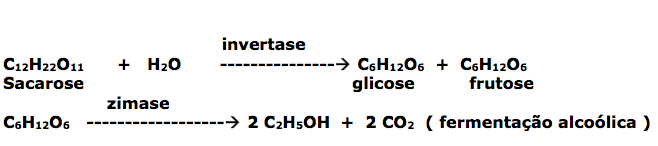
Etanol: Forma-se pela fermentação da glicose sob ação de uma enzima denominada zimase
A indústria não usa diretamente a glicose, devido ao alto custo da mesma, as matérias-primas utilizadas são o melaço de cana de açúcar, o suco de beterraba, cevada etc...
O melaço é colocado na presença de levedura em condições favoráveis a fermentação, produzindo uma enzima chamada invertase ou sucrase, que hidrolisa a sacarose originando glicose e frutose, que sob ação da zimase, fornece o álcool etílico.
Metanol: Atualmente é obtido, em escala industrial, a partir de carvão e água
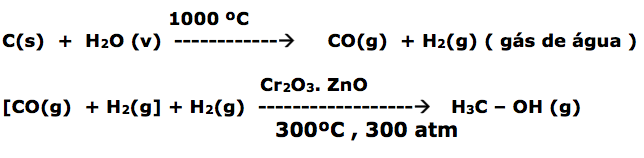
O metanol é matéria-prima para o formol, utilizado como combustível de aviões, carros de corrida etc..
O metanol é extremamente tóxico e sua ingestão pode produzir cegueira, e até a morte. A dose letal é de 0,07 g/kg de massa corpórea.
Propriedades física
Os alcoóis mais simples ( metanol, etanol e propanol ) são líquidos incolores, voláteis, de cheiro característicos e totalmente solúveis em água. Com o aumento da cadeia carbônica, os alcoóis torna-se mais viscosos, menos voláteis e menos solúveis em água, até chegarmos a alcoóis de massa molecular elevada que são sólidos e insolúveis em água.
O álcool apresenta um comportamento semelhante ao da água ( R – O – H , H – O – H ), portanto um álcool é uma substância polar, embora muito menos que a água. Essa polaridade permite que uma molécula de álcool forme pontes de hidrogênio seja com outra molécula de álcool seja com a molécula da água ou outro solvente polar, explicando a solubilidade do álcool em água.
O ponto de ebulição dos alcoóis varia de acordo com a massa molar.
Enfim sempre devemos raciocinar que:

Desidratação de alcoóis
Consiste na saída de uma molécula de água de modo intramolecular ou intermolecular.
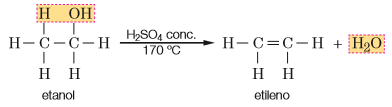
Desidratação intramolecular: Ocorre a eliminação de uma molécula de água de uma única molécula de álcool, formando um alceno ( alqueno )
1 álcool eteno + água ( catalisador H2SO4 conc a 170 ºC)
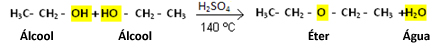
Desidratação intermolecular : ocorre a eliminação de uma molécula de água de duas moléculas de álcool, pela interação dos grupos OH , formando éter e água.
2 álcool éter + água ( catalisador H+ a 140 ºC ).
Exemplo
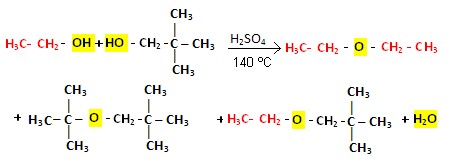
Dica: As reações de álcool primário, ocorre normalmente à desidratação intermolecular. Álcool secundário e terciário, normalmente tende a realizar desidratação intramolecular.
Quando a desidratação ocorre com uma mistura de alcoóis, os éteres formados são resultados de várias combinações entre as moléculas dos alcoóis envolvidos.
A reação orgânica de desidratação intermolecular dos alcoóis é importante porque produz éteres que são muito utilizados na purificação de fármacos (fonte: Brasil Escola )
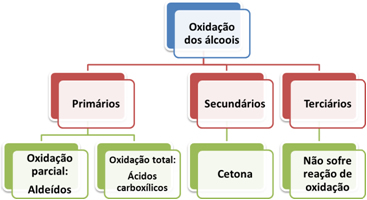
Reações de oxidação :
Álcool primário:
Oxidação Parcial: ( KmnO4 / OH_ ),irá oxidar apenas um hidrogênio do álcool primário., irá produzir um aldeído eliminando uma molécula de água.
Oxidação total: ( KmnO4/H+ ), irá oxidar os dois hidrogênios, produzindo o ácido carboxílico
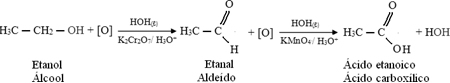
Álcool secundário: produz uma cetona com liberação de água.
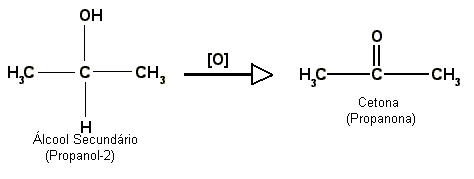
Álcool terciário : não reage
RESUMO
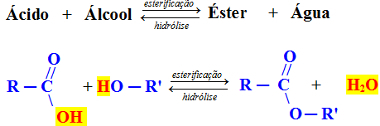
Reação de esterificação:
Na reação de ácido carboxílico com álcool primário e secundário, o H2O eliminado resulta da união do – OH do ácido com o H do álcool
Ácidos Carboxílicos.
-
A polarização da ligação O-H diminui com o aumento da cadeia carbônica. Portanto os ácidos fórmico, acético etc... são solúveis em água em todas as proporções.
-
A partir de ácidos com C5 a solubilidade da água é limitada e diminui com o aumento da cadeia carbônica.
-
A força dos ácidos carboxílicos diminui, à medida que aumenta a cadeia carbônica. ( ácido fórmico é considerado ácido semi forte, o ácido acético é fraco e os seguintes da série são cada vez mais fracos.
Ácidos Graxos: São ácidos carboxílicos com mais de 11 carbonos(cadeias longas), produzidos nos organismos dos seres vivos, Caracterizam-se por apresentarem cadeia normal, número par de carbonos e por serem saturados ou insaturados ( somente por dupla ligação ).
Lipídeos: Não se refere apenas a óleos e gorduras, mas a uma grande classe de compostos orgânicos, que variam em sua composição química e são caracterizados pela solubilidade em solventes não polares e insolubilidade em água.
Os lipídeos apresentam várias funções: fonte de energia, reserva energética,isolante térmico etc..
Os lipídeos mais abundantes nos organismos são os triglicérides ( ésteres de glicerina e ácidos graxos – mistura de ácidos superiores ).
Os triglicérides podem ser óleos ou gorduras.
Nos óleos predominam triglicérides de ácidos insaturados e nas gorduras, ácidos saturados. Quanto mais insaturado for o glicerídeo, mais baixa sua temperatura de fusão
Sabões: São sais solúveis de ácido graxo.
Quando dissolvemos o sabão na superfície da solução, a parte polar fica dentro da água e a parte apolar que não tem afinidade com a água fica fora. Essa disposição dos ânions na superfície da água provoca a diminuição da tensão superficial dela, possibilitando a formação da espuma, que remove a sujeira.
Detergente: é qualquer substância que diminui a tensão superficial de um líquido, possibilitando sua emulsificação e a formação de espuma. Por definição o sabão é um detergente, termo não muito utilizado pelas indústrias, porque no comércio os detergentes vendidos são sais orgânicos de ácidos de cadeias longas( sais de ácidos sulfônicos : R – SO3_ Na+ ).
Os sabões são de ácidos graxos constituintes de óleos e gorduras )
Saponificação: Trata-se da reação dos glicerídeos ( mistura de ésteres ) com NaOH ou KOH, produzindo glicerina e sais de ácidos superiores ( sabão : mistura de sais de ácidos graxos superiores )
Portanto : Glicerídeo + base sabão + glicerina ( ÁLCOOL )
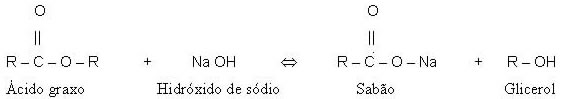
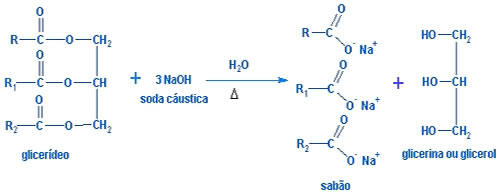
DICA: Utilizando o NaOH obtém-se sabões sólidos que também são denominados de sabões duros.
Utilizando o KOH obtém-se sabões líquidos ou pastosos e são denominados de sabões moles
Ceras : são ésteres de ácidos superiores com alcoóis superiores ( alto teor de carbono ).
Ésteres: Principais ésteres usados como flavorizantes

Reação de hidrólise.
Os ésteres hidrolisam-se na presença de água, constituindo em equilíbrio químico
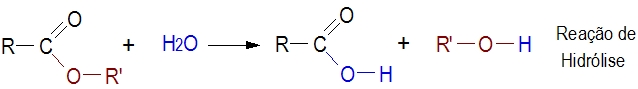
DICA: Adicionando-se uma base forte o equilíbrio desloca-se no sentido do ácido e do álcool, devido à reação da base com ácido.
Acidez e Basicidade
-
Os ácidos carboxílicos em meio aquoso sofrem ionização, originando íons H+/ H3O+.
-
À medida que a cadeia aumenta, a força do ácido diminui.
-
No entanto se a cadeia possuir algum radical de efeito indutivo negativo (-1) ele irá “atrair” os elétrons da carboxila facilitando a saída do H+ e aumentando a força do ácido.
-
Exemplo :
-
ácido monocloroacético < ácido dicloroacético < ácido tricloroacético
-
Pelo mesmo motivo, um ácido dicarboxílico, com carboxilas vizinhas, é mais forte que um ácido monocarboxílico.( ácido etanodióico – oxálico )
-
A acidez do ácido depende do grupo ligado à carboxila:
-
I – Aumentam a acidez : F, Cl, Br, i , NO2 , OH etc...
-
II – Diminuem a acidez : H3C- , C2H5- etc.
-
Os Fenóis : tem caráter ácido fraco, devido à dissociação:
DICA: Daí o nome do fenol comum ser também chamado de ácido fênico, portanto o caráter ácido dos fenóis e menor que os dos ácidos carboxílicos.
Os fenóis reagem com bases, enquanto os alcoóis não reagem(só reagem com metais da 1 A e 2 A )
Aminas
As aminas apresentam caráter básico fraco, que deriva do caráter básico do amoníaco, portanto as aminas são consideradas as bases da química orgânica.
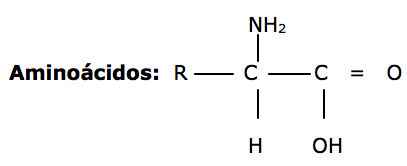
Aminoácidos:
São compostos que apresentam as funções amina ( - NH2 ) e ácido ( - COOH )
Exemplo : ac. amino etanóico ( glicina ) , ac. amino – propanóico (alanina ).
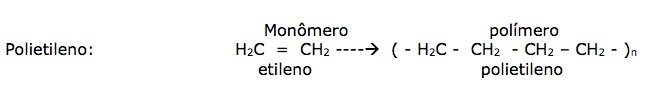
POLÍMEROS.
A palavra polímero é utilizada para designar moléculas de substâncias formadas por um número muito grande de unidades moleculares repetidas, denominadas de monômeros.
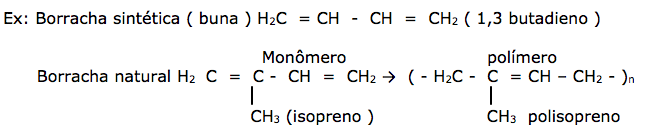
Os primeiros polímeros sintéticos resultaram da procura de substâncias que reproduzissem as propriedades encontradas nos polímeros naturais. Podemos citar por exemplo à falta da borracha natural, no período da 2º Guerra Mundial, proporcionou o aparecimento da borracha sintética e na tentativa de substituir a seda , descobriu-se a fibra de náilon.
Polímeros naturais são : a borracha (polímero de adição), os polissacarídeos ( celulose, amido e o glicogênio ) e as proteínas ( polímeros de condensação ), obtidos respectivamente a partir de monossacarídeos e aminoácidos. A sacarose é o dissacarídeo mais importante.

Polímeros artificiais: ( plásticos ) polietileno
Polímeros artificiais mais comuns.
-
Polietileno : formado por reação de adição,sendo o principal componente de sacolas e sacos.
-
Teflon ( tetrafluoretileno ): polímero praticamente insolúvel em todos os solventes, sendo muito utilizado em revestimentos antiaderentes para panelas e fita vedante.
-
PET: Apresenta o grupo funcional R – C = O , usado na produção de fitas magnéticas, garrafas plásticas de refrigerantes e recipientes de produtos de limpeza.
-
Náilon : ( copolímero – diaminas com ácidos dicarboxílicos )Forma uma fibra muito resistente à tração, devido às ligações de hidrogênio que ocorrem entre suas moléculas. Usado em, tecidos. Cordas escovas, sendo o mais comum o náilon 66 ( ác. Adípico com 1,6 diaminoexano – diácido com 6C e diamina com 6C )
-
-
Polipropileno ( poliproprino ) : assentos de cadeiras.
-
PVC ( policloreto de vinila ) isolante elétrico e na substituição de couro em estofamentos
Polimerização: é o nome dado à reação entre duas ou mais moléculas de substâncias denominadas de monômeros.
Classificação das reações dos polímeros:
a) Adição: Ocorre adições sucessivas no monômero, apresentando obrigatoriamente pelo menos uma dupla ligação entre carbonos.
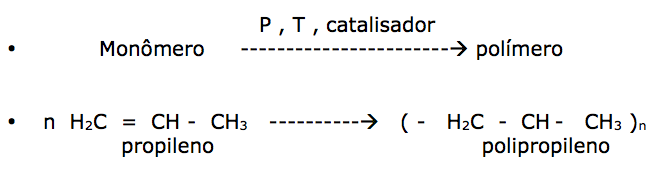
A união de várias moléculas de monossacarídeos dá origem aos polissacarídeos ( celulose é o mais abundante)
b) Condensação :Nesse tipo de reação ocorre eliminação de pequenas moléculas de água. Nessa polimerização, os monômeros não precisam apresentar duplas ligações entre carbonos, mas é necessária a existência de dois tipos de grupos funcionais diferentes.
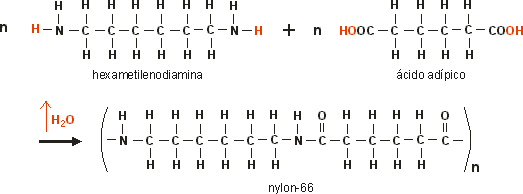
Copolímeros: Quando o polímero é obtido, através da reação de monômeros diferentes, por adição ou condensação.
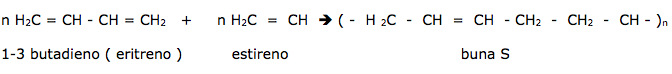
A interação responsável pela formação de proteínas ocorre entre o grupo ácido presente em uma molécula de aminoácido, e o grupo básico presente em outra molécula, com a eliminação de uma molécula de água, originando uma ligação amídica ou peptídica:
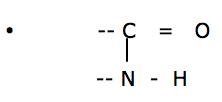
CLASSIFICAÇÃO DOS POLÍMEROS
Os polímeros podem ser classificados em três grandes grupos de acordo com suas propriedades.
a) elastômeros: Apresenta capacidade de estiramento extremamente elevada, sofrendo deformação elástica completa e reversível.
b) Plásticos: capacidade de estiramento bastante inferior à dos elastômeros.
c) Fibras: capacidade de estiramento extremamente reduzida.
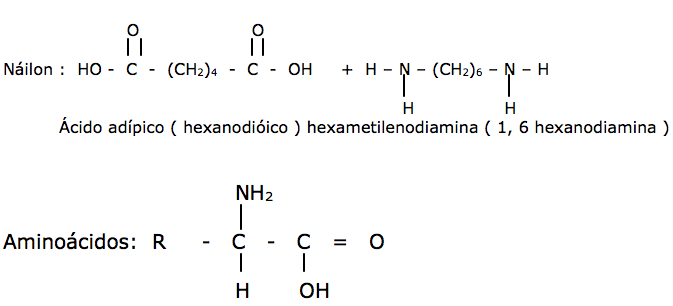
A interação responsável pela formação de proteínas ocorre entre o grupo ácido presente em uma molécula de aminoácido, e o grupo básico presente em outra molécula, com a eliminação de uma molécula de água, originando uma ligação amídica ou peptídica :