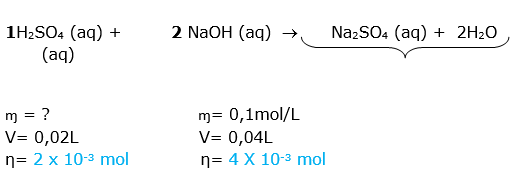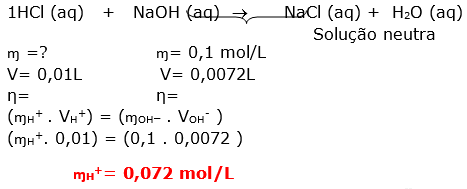Lista de exercícios–Química – prof. Raimundo. 2º. Trimestre - 2º. Ens. Médio 2019
-MISTURA DE SOLUÇÕES COM REAÇÃO QUÍMICA
-TERMOQUÍMICA ( LEI DE HESS, CÁLCULO DE ENTALPIA COM ESTEQUIOMETRIA)
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Se = 79
Resolução comentada no final da lista
01 - (PUC Camp SP/2019)
O veneno de formiga contém o ácido metanoico, HCOOH. Para neutralizar 1,0 mL de solução 0,1 mol/L desse ácido, é necessário utilizar um volume de solução de NaOH 0,02 mol/L igual a
a) 5 mL.
b) 10 mL.
c) 15 mL.
d) 20 mL.
e) 25 mL.
02 - (UFGD MS/2019)
Atualmente, a grande produção de lixo tornou-se um problema mundial, pois o tratamento inadequado pode acarretar sérios problemas na área da saúde pública, em virtude de facilitar o ressurgimento de diferentes epidemias a partir do contato humano com materiais contaminados. Visando a diminuir esse contato com o lixo, um dos métodos de tratamento pode ser o aterro sanitário. Os gases produzidos em um aterro sanitário podem ser reutilizados como fonte de energia (biogás), diminuindo assim o consumo de fontes de energias não renováveis. Sabendo que o metano é o principal componente do biogás e que sua reação de combustão é dada pela equação:
CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(l),
CO2(g) + 2H2O(l),
na qual as entalpias de formação padrão para:
CH4(g) = –17,9 kcal/mol,
CO2(g) = –94,1 kcal/mol e
H2O(l) = –68,3 kcal/mol.
Assinale a alternativa que corresponde à variação da entalpia ![]() para a combustão total de metano.
para a combustão total de metano.
a) –144,5 kcal
b) –180,3 kcal
c) +318,4 kcal
d) –212,8 kcal
e) –348,6 kcal
03 - (UERJ/2019)
Café quentinho a qualquer hora: chegou ao Brasil o café hot when you want, que, em português, significa “quente quando você quiser”. Basta apertar um botão no fundo da lata, esperar três minutos e pronto! Café quentinho por 20 minutos !
Adaptado de www1.folha.uol.com.br, 15/02/2002.
Para garantir o aquecimento, as latas desse produto possuem um compartimento com óxido de cálcio e outro com água. Ao pressionar o botão, essas duas substâncias se misturam, gerando energia e esquentando o café rapidamente.
Escreva a equação química que representa a reação entre o óxido de cálcio e a água, nomeando o produto formado.
Classifique, ainda, a reação química ocorrida quanto ao calor envolvido.
04 - (UNITAU SP/2018)
O gás acetileno é muito utilizado em operações de soldagem de metais, devido a sua natureza inflamável. A combustão completa do gás acetileno com oxigênio libera 650 kJ de calor para 1,0 mol de CO2 formado. A equação de combustão é
C2H2(g) + O2(g) ![]() CO2(g) + H2O(g) + calor
CO2(g) + H2O(g) + calor
A quantidade de calor liberada pela combustão de 104 g de acetileno é de
a) 4550 kJ
b) 3900 kJ
c) 3250 kJ
d) 5200 kJ
e) 2600 kJ
05 - (FUVEST SP/2018)
A energia liberada na combustão do etanol de cana-de-açúcar pode ser considerada advinda da energia solar, uma vez que a primeira etapa para a produção do etanol é a fotossíntese. As transformações envolvidas na produção e no uso do etanol combustível são representadas pelas seguintes equações químicas:
6 CO2 (g) + 6 H2O (g) ![]() C6H12O6 (aq) + 6 O2 (g) ΔH = ?
C6H12O6 (aq) + 6 O2 (g) ΔH = ?
C6H12O6 (aq) ![]() 2 C2H5OH (l) + 2 CO2 (g)
2 C2H5OH (l) + 2 CO2 (g) ![]() = –70 kJ/mol
= –70 kJ/mol
C2H5OH (l) +3O2 (g) ![]() 2CO2 (g) + 3H2O(g)
2CO2 (g) + 3H2O(g)![]() = –1.235 kJ/mol
= –1.235 kJ/mol
Com base nessas informações, podemos afirmar que o valor de ![]() para a reação de fotossíntese é
para a reação de fotossíntese é
a) –1.305 kJ/mol.
b) +1.305 kJ/mol.
c) +2.400 kJ/mol.
d) –2.540 kJ/mol.
e) +2.540 kJ/mol.
06 - (UNESP SP/2018)
Analise os três diagramas de entalpia.
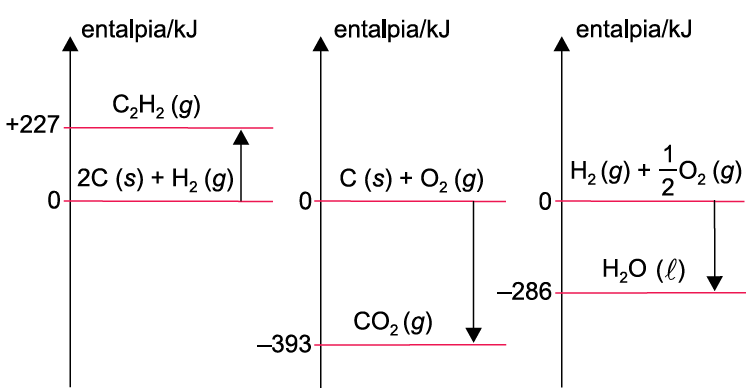
O ![]() da combustão completa de 1 mol de acetileno, C2H2 (g), produzindo CO2 (g) e H2O (l) é
da combustão completa de 1 mol de acetileno, C2H2 (g), produzindo CO2 (g) e H2O (l) é
a) + 1 140 kJ.
b) + 820 kJ.
c) – 1 299 kJ.
d) – 510 kJ.
e) – 635 kJ.
7 - (FPS PE/2017)
O monóxido de carbono (CO) é um gás incolor, inodoro, insípido que é ligeiramente menos denso do que o ar. Ele é tóxico para os animais hemoglóbicos (incluindo seres humanos), quando encontrado em concentrações acima de 35 ppm (partes por milhão). Este gás pode ser produzido pela combustão de combustíveis fósseis, principalmente nos grandes centros urbanos. Determine a entalpia de formação do CO (reação (1)), a partir das entalpias das reações (2) e (3), a 20ºC e 1 atm, que estão indicadas nas equações termoquímicas a seguir:
1. 2 C(s) + O2(g) ![]() 2 CO(g)
2 CO(g) ![]()
2. C(s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = –394 kJ.mol–1
= –394 kJ.mol–1
3. 2 CO(g) + O2(g) ![]() 2 CO2(g)
2 CO2(g) ![]() = –283 kJ.mol–1
= –283 kJ.mol–1
a) –505 kJ.mol–1
b) –172 kJ.mol–1
c) –111 kJ.mol–1
d) +172 kJ.mol–1
e) +505 kJ.mol–1
8 - (UniRV GO/2017)
A titulação pode ser definida como a técnica para determinar a concentração de uma solução (de concentração desconhecida) através da reação com uma solução de concentração conhecida. Assim, num laboratório realizou-se a titulação de 25,0 mL de hidróxido de potássio com concentração desconhecida, sendo gastos 32,0 mL de ácido nítrico com concentração de 0,20 mol.L–1. Considerando o volume final da solução formada igual a 57,0 mL, qual a concentração da solução de hidróxido de potássio ?
9 - (UEFS BA/2017)
Os cervejeiros aprenderam logo a induzir a fermentação, mas demoraram séculos para identificar os agentes que transformavam o açúcar em álcool e gás carbônico. As leveduras, fungos microscópicos, só foram identificadas no século 19. O tipo de fermentação divide as cervejas em dois grandes grupos: lager (que fermenta entre 8 e 16 ºC) e ale (que fermenta entre 14 e 25 ºC).
As equações do processo de fermentação alcoólica da sacarose estão representadas a seguir.
I. ![]()
II. ![]()
Considere as seguintes entalpias padrão de formação:
1- C(s) + O2(g) ![]() CO2(g);
CO2(g); ![]() kJ/mol
kJ/mol
2- 6C(s) + 6H2(g) + 3O2(g) ![]() C6H12O6(s) ;
C6H12O6(s) ; ![]() kJ/mol
kJ/mol
3- 2C(s) + 3H2(g) + ![]() O2(g)
O2(g) ![]() C2H6O(l);
C2H6O(l); ![]() kJ/mol
kJ/mol
Para a reação representada na equação II, a variação de entalpia, calculada com base nos dados fornecidos, corresponde a
a) –2 617 kJ/mol.
b) –604 kJ/mol.
c) –67 kJ/mol.
d) +604 kJ/mol.
e) +67 kJ/mol.
10 - (FATEC SP/2018)
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c>
Acesso em: 13.11.2017. Adaptado.
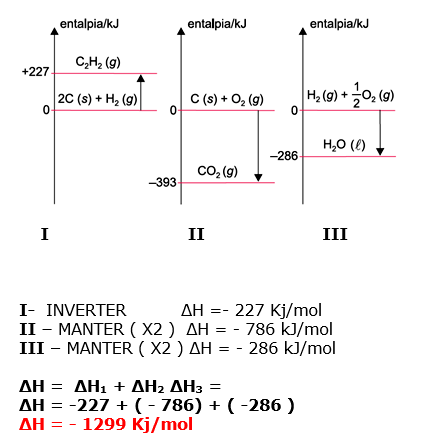
A entalpia de combustão do benzeno pode ser determinada conhecendo-se os valores das entalpias de formação do gás carbônico, assim como da água e do benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de algumas substâncias nas condições padrão.
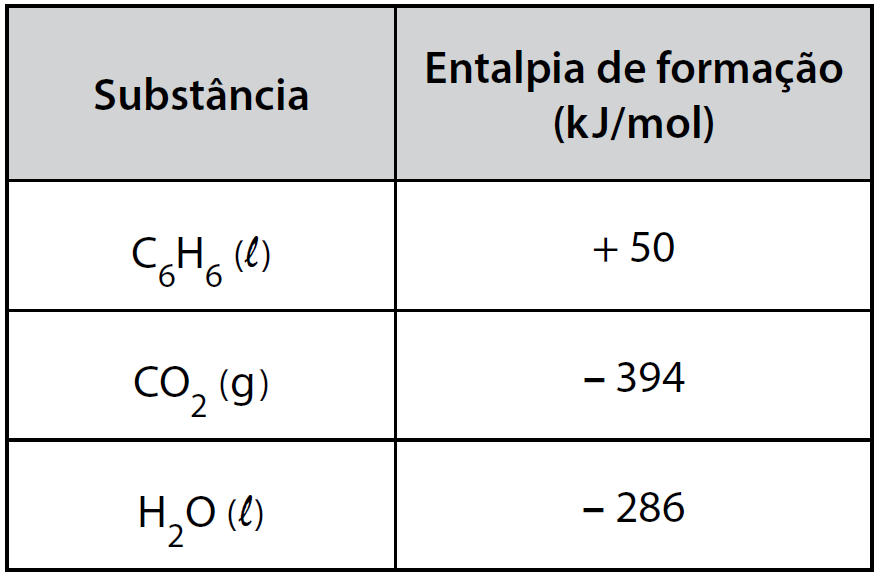
A entalpia de combustão completa do benzeno, em kJ/mol, é
b)–3 172
c)–2 122
d)+2 364
e)+3 272
11- (UniCESUMAR SP/2017)
Uma amostra de 5,0 g de soda cáustica foi titulada utilizando-se uma solução aquosa de ácido sulfúrico de concentração 0,80 mol.L–1.
Considerando que foram necessários 50 mL da solução ácida para neutralizar completamente essa amostra e que nenhuma das impurezas presentes reage com ácido sulfúrico, pode-se concluir que o teor de hidróxido de sódio na soda cáustica analisada é de
a)32 %.
b)48 %.
c)64 %.
d)80 %.
e)90 %.
12 - (UNIUBE MG/2016)
A titulação é muito utilizada no estudo de reações ácido-base e tem por principal característica determinar a concentração de uma solução problema. Em um laboratório, um grupo de alunos pipetou uma amostra de 20,0 mL de ácido sulfúrico (H2SO4) de concentração desconhecida e adicionou 3 gotas do indicador fenolftaleína. Essa solução foi titulada com hidróxido de sódio 0,1 Molar. Após a viragem do indicador, o volume gasto de NaOH foi de 40 mL.
Qual a concentração molar do ácido
13 - (UEFS BA/2017)
Um motociclista foi de Salvador-BA para Feira de Santana-BA, percorrendo no total 110,0 km. Para percorrer o trajeto, sua motocicleta flex consumiu 5 litros de etanol (C2H5OH, d = 0,8 g.cm–3), tendo um consumo médio de 22,0 km/L.
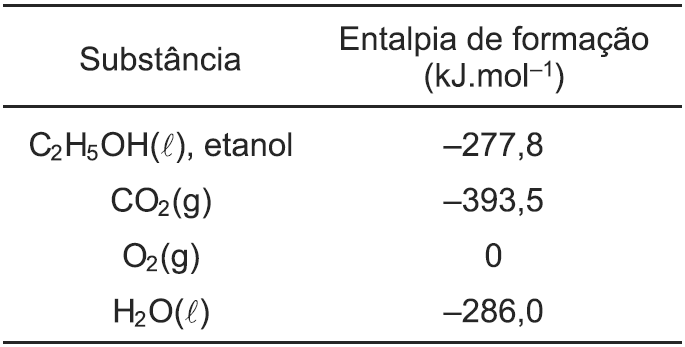
Com base nos dados de entalpia de formação de algumas substâncias, o calor envolvido na combustão completa por litro de etanol foi, em kJ, aproximadamente,
a)–1367
b)+1367
c)–18200
d)+10936
e)–23780
14 - (Mackenzie SP/2016)
Considerando a reação de combustão completa de 1 mol de gás butano no estado-padrão e as informações existentes da tabela abaixo, calcule a variação de entalpia de combustão do butano.

15 –(Fac. Israelita de C. da Saúde Albert Einstein SP/2016-MOD)
Para determinar a pureza de uma amostra de ácido sulfúrico , uma analista dissolveu certa massa do ácido em água até obter uma solução. A analista separou 10,0 mL dessa solução e realizou a titulação, utilizando fenolftaleína como indicador. A neutralização dessa alíquota foi obtida após a adição de 40,0 mL de uma solução aquosa de hidróxido de potássio de concentração 0,5 mol.L–1. Determine a concentração em mol.L-1 do ácido analisado.
16 - (UNIFOR CE/2016)
O sabor azedo característico do vinagre deve-se à presença do ácido acético, CH3COOH, um ácido fraco, produzido principalmente pela fermentação do vinho. Para quantificar a presença deste ácido, 10,0 mL de uma amostra de vinagre foram neutralizados com 25,0 mL de uma solução de NaOH 0,1 mol/L. A concentração do ácido acético no vinagre, em gramas por litro, será aproximadamente igual a quanto?
17 - (Fac. Direito de Sorocaba SP/2016)
Uma solução de ácido acético (CH3COOH; massa molar 60 g) encontra-se sem titulação. Sabe-se que para a neutralização total de 150 mL dessa solução são necessários 100 mL de NaOH (1mol/L).
Segue a equação da reação de neutralização.
CH3COOH + NaOH ![]() Na+ + CH3COO– + H2O
Na+ + CH3COO– + H2O
Qual a concentração em g.L-1 para essa solução de ácido acético ?
18 - (UNESP SP/2015)
Chama-se titulação a operação de laboratório realizada com a finalidade de determinar a concentração de uma substância em determinada solução, por meio do uso de outra solução de concentração conhecida. Para tanto, adiciona-se uma solução-padrão, gota a gota, a uma solução-problema (solução contendo uma substância a ser analisada) até o término da reação, evidenciada, por exemplo, com uma substância indicadora. Uma estudante realizou uma titulação ácido-base típica, titulando 25,0 mL de uma solução aquosa de hidróxido de cálcio e gastando 20,0 mL de uma solução padrão de ácido nítrico de concentração igual a 0,10 mol · L–1.
Utilizando os dados do texto,calcule a concentração da solução de Ca(OH)2.
19 –(PUC RJ)
Neutraliza-se 50 mL de solução aquosa de hidróxido de sódio 0,10 mol L–1 com 50 mL de solução aquosa de ácido sulfúrico. Nessa reação, há formação de sal e água.
Admitindo como desprezível a expansão de volume como resultado dessa reação, calcule a concentração em mol.L-1 do ácido utilizado nesta titulação.
20 – (MACK SP)
Na neutralização de 30 mL de uma solução de soda cáustica (hidróxido de sódio comercial), foram gastos 20 mL de uma solução 0,5 mol/L de ácido sulfúrico, até a mudança de coloração de um indicador ácido-base adequado para a faixa de pH do ponto de viragem desse processo. Determine a concentração em mol/L da soda cáustica.
21 – (UNIFOR CE)
Gás natural veicular (GNV) é um combustível disponibilizado na forma gasosa, a cada dia mais utilizado em automóveis como alternativa à gasolina e ao álcool. O GNV diferencia-se do gás liquefeito de petróleo (GLP) por ser constituído por hidrocarbonetos na faixa do metano e do etano, enquanto o GLP possui em sua formação hidrocarbonetos na faixa do propano e do butano.
Usando os dados fornecidos, e sabendo que é um tanque típico de GNV ( formado exclusivamente por metano ( CH4 ), calcule a variação de entalpia (ΔH ) produzido na queima total de um tanque de GNV (CH4) ? Dados: CH4 = - 75 kJ/mol , CO2 = - 394 kJ/mol , H2O = - 286 Kj/mol
22 - (Unicastelo SP)
No laboratório de um hospital, uma amostra de 10,0 mL de suco gástrico, obtida 8 horas após um paciente ter ingerido caldo de legumes, foi titulada com NaOH 0,1 mol/L, consumindo 7,2 mL da solução básica até a completa neutralização, que ocorre segundo a equação
HCl(aq) + NaCl(aq) NaCl(aq) + H2O(l)
Afirma-se que a concentração de ácido, em mol/L, na amostra de suco gástrico analisada é de
a)0,1. b)0,36. c)0,072. d)0,036. e)0,0072.
23 - (UDESC SC)
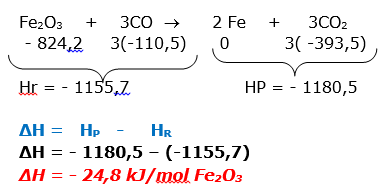
A indústria siderúrgica utiliza-se da redução de minério de ferro para obter o ferro fundido, que é empregado na obtenção de aço. A reação de obtenção do ferro fundido é representada pela reação:
Fe2O3 + 3CO 2 Fe + 3CO2
Dados: Entalpia de formação (Hof) a 25ºC, kJ/mol.
![]()
A entalpia de reação (ΔHor) a 25ºC é:
a)24,8 kJ/mol b)–24,8 kJ/mol c)541,2 kJ/mol d)–541,2 kJ/mol e) 1328,2 kJ/mol
24 - (FATEC SP/2016)
O éster acetato de etila é utilizado na indústria química como solvente e como flavorizante, para conferir sabor artificial de maçã ou pera aos alimentos.
Este composto também pode ser preparado a partir de uma reação de esterificação:
CH3–CH2–OH (l)+CH3–COOH (l) ![]() CH3–COOCH2–CH3(l) +H2O (l)
CH3–COOCH2–CH3(l) +H2O (l)
Para calcularmos a variação de entalpia da reação, ![]() , podemos aplicar a lei de Hess às equações de combustão dos compostos orgânicos presentes na reação de esterificação, apresentadas a seguir.
, podemos aplicar a lei de Hess às equações de combustão dos compostos orgânicos presentes na reação de esterificação, apresentadas a seguir.
I. CH3–CH2–OH (l) + 3 O2 (g) ![]() 2 CO2 (g) + 3 H2O (l)
2 CO2 (g) + 3 H2O (l) ![]() = –1 368 kJ
= –1 368 kJ
II. CH3COOH (l) + 2 O2 (g) ![]() 2 CO2 (g) + 2 H2O (l)
2 CO2 (g) + 2 H2O (l) ![]() = –875 kJ
= –875 kJ
III. CH3COOCH2CH3 (l) + 5 O2 (g) ![]() 4 CO2 (g) + 4 H2O (l)
4 CO2 (g) + 4 H2O (l) ![]() = –2 231 kJ
= –2 231 kJ
Aplicando a lei mencionada, a variação de entalpia da reação de esterificação descrita será, em kJ, igual a
a) –12.
b) +12.
c) –1 738.
d) +4 474.
e) –4 474.
25 - (UFG GO)
A variação de entalpia (H) é uma grandeza relacionada à variação de energia que depende apenas dos estados inicial e final de uma reação. Analise as seguintes equações químicas:
1)C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(l) Hº = –2.220 kJ
2)C(grafite) + O2(g) CO2(g) Hº = –394 kJ
3)H2(g) + ½ O2(g) H2O(l) Hº = –286 kJ
Ante o exposto, determine o valor da variação de entalpia do processo:
3 C(grafite) + 4 H2(g) C3H8(g)
26 - (UEL PR/2015)
Um dos maiores problemas do homem, desde os tempos pré-históricos, é encontrar uma maneira de obter energia para aquecê-lo nos rigores do inverno, acionar e desenvolver seus artefatos, transportá-lo de um canto a outro e para a manutenção de sua vida e lazer. A reação de combustão é uma maneira simples de se obter energia na forma de calor. Sobre a obtenção de calor, considere as equações a seguir.
I-C(grafite) + O2(g) CO2(g) H = –94,1 kcal
II-H2O(l) H2(g) + ![]() O2(g) H = +68,3 kcal
O2(g) H = +68,3 kcal
III-C(grafite) + 2H2(g) CH4(g) H = –17,9 kcal
Assinale a alternativa que apresenta, corretamente, o valor do calor de combustão (H) do metano (CH4) na equação a seguir.
CH4(g)+ 2O2(g) CO2(g)+ 2H2O(l)
a) –212,8 kcal
b) –144,5 kcal
c) –43,7 kcal
d) +144,5 kcal
e) +212,8 kcal
27 - (UEFS BA)
I. H2(g) + ![]() O2(g) H2O(l) Hº = –286kJmol–1
O2(g) H2O(l) Hº = –286kJmol–1
II. C(graf.) + O2(g) CO2(g) Hº = –394kJmol–1
III. CH4(g) + 2O2 CO2(g) + 2H2O(l) Hº = –891kJmol–1
Utilizando-se a Lei de Hess, é possível calcular a variação de entalpia de uma reação química a partir das entalpias de outras reações que apresentem substâncias comuns à reação desejada
Assim, considerando-se as equações termoquímicas de combustão representadas em I, II e III e aplicando a Lei de Hess, calcule a variação de entalpia(ΔH) para a formação do metano.
GABARITO:
1) A 2) D3) CaO + H2O ![]() Ca (OH)2 Produto: hidróxido de cálcio. Reação: exotérmica.
Ca (OH)2 Produto: hidróxido de cálcio. Reação: exotérmica.
4) D 5) E 6) C
7) A 8) 0,26 mol/L 9) C 10) A 11) C 12) 0,1 mol/L 13) E 14) – 2877,3 kJ 15) 1 mol/L 16) 15g/L 17)40 g/L 18) 0,04 mol/L 19) 0,05 mol/L20) 0,66 mol/L 21) – 891 kJ/mol22) C 23) B 24) A 25) – 106 Kj 26) A 27) – 75Kj
RESOLUÇÃO COMENTADA
1- RESP: A
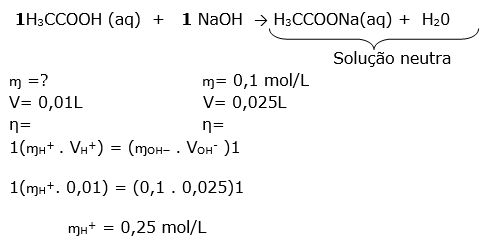
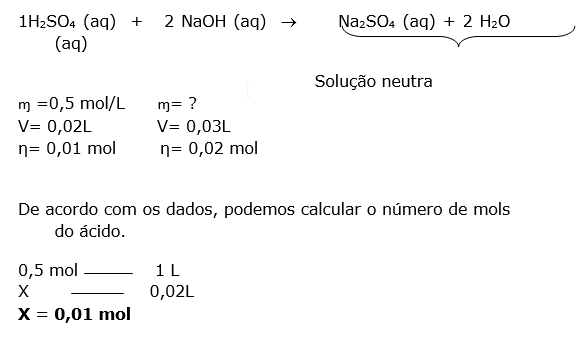
Esta questão envolve mistura de soluções com reação química e a questão informa que ocorreu a neutralização ( titulação),insto indica que o número de mols dos reagentes obedecem uma proporção.
1HCOOH (aq) + 1NaOH (aq) 1HCOONa (aq) + 1 H2O (aq)
ɱ =0,1 mol/L ɱ= 0,02 mol/L
V= 0,01L V= ?
η=0,001 mol η= 0,001 mol
Para resolver , podemos utilizar a fórmula ou a regra de três.
0,02 mol............... 1L
0,001 mol ............. x
X = 0,05 L = 50 mL
V = 0,05L = 50 mL
DICA:Primeiro calculamos o número de mols do ácidoe com esse número calculamos o volume da base, pois sabemos que o número de mols do ácido é igual ao da base, devido a proporção ser 1:1
2- RESP: D
Questão envolvendo calculo de variação de entalpia de combustão. A questão forneceu a reação devidamente balanceada e os valores de entalpia.
3- RESOLUÇÃO
CaO + H2O ![]() Ca (OH)2 Produto: hidróxido de cálcio. Reação: exotérmica.
Ca (OH)2 Produto: hidróxido de cálcio. Reação: exotérmica.
Dica: de acordo com a questão, após a mistura dessas substâncias, ocorre a liberação de energia esquentando o café.
4- RESP: D
Esta questão envolve variação de entalpia com estequiometria.
C2H2(g) + O2(g) ![]() CO2(g) + 2H2O(l) + calor ΔH = - 650 kJ
CO2(g) + 2H2O(l) + calor ΔH = - 650 kJ
A questão informa que a quantidade de calor liberada é para 1 mol de CO2. Portanto notamos que a reação não está balanceada e concluímos que o ΔH da reação corresponde a 1300 kJ/mol de C2H2 .
C2H2(g) + O2(g)![]() 2CO2(g) + 2H2O(l) + calor ΔH = - 1300 kJ
2CO2(g) + 2H2O(l) + calor ΔH = - 1300 kJ
26 g de C2H2 .......... 1300 kj liberados
104 g C2H2 ............. X
X = 5200 kJ liberados
5- RESP: E
Questão envolvendo a Lei de Hess
DICA: verificar mais detalhes sobre a resolução na questão 7
6 CO2 (g) + 6 H2O (g) ![]() C6H12O6 (aq) + 6 O2 (g) ΔH = ?
C6H12O6 (aq) + 6 O2 (g) ΔH = ?
I- C6H12O6 (aq) ![]() 2 C2H5OH (l) + 2 CO2 (g)
2 C2H5OH (l) + 2 CO2 (g) ![]() = –70 kJ/mol
= –70 kJ/mol
II- C2H5OH (l) +3O2 (g) ![]() 2CO2 (g) + 3H2O(g)
2CO2 (g) + 3H2O(g) ![]() = –1.235 kJ/mol
= –1.235 kJ/mol
2- INVERTER (x2) ΔH =+ 2470 Kj/mol
1- INVERTER (x2) ΔH =+ 70 Kj/mol
ΔH = ΔH1 + ΔH2 =
ΔH = 2470 + 70
ΔH = + 2540 Kj/mol
6- RESP: C
Questão envolvendo Lei de Hess. Nesta questão ele forneceu o gráfico e pede a variação de entalpia para a combustão total do acetileno.
1º.passo
Equacionar a reação de combustão do acetileno.
C2H2(g) + O2(g)![]() 2CO2(g) + 2H2O(l) + calor ΔH = ?
2CO2(g) + 2H2O(l) + calor ΔH = ?
Dica: A ponta da seta sempre em direção aos produtos.
“vamos seguir as orientações da questão 7 “
7- RESP: A
A questão fornece duas reações com o valor de ΔH, indicando que envolve a LEI DE HESS. Também foi dada a reação principal (1) para a qual deve ser calculada a variação de entalpia.
Dadas as reações:
1. 2 C(s) + O2(g) ![]() 2 CO(g)
2 CO(g) ![]()
2. C(s) + O2(g) ![]() CO2(g)
CO2(g) ![]() = –394 kJ.mol–1
= –394 kJ.mol–1
3. 2CO(g) +O2(g)![]() 2CO2(g)
2CO2(g) ![]() =–283 kJ.mol–1
=–283 kJ.mol–1
2 – MANTER ( X2 ) ΔH = - 788 kJ/mol
3- INVERTER ΔH =+ 283 Kj/mol
ΔH = ΔH2 + ΔH3 =
ΔH = -788 + 283
ΔH = - 505 Kj/mol
DICA: Quem “ comanda tudo” é areação principal. A reação 2 foi multiplicada por 2, pois temos2 mols de carbono (C).
A reação 3 foi invertida pois na reação principal o CO é produto e na reação 3 ele é reagente ( é necessário ficar do mesmo lado).
OBS:Não utlizamos o O2 porque ele aparece em mais que uma reação. ( apareceu nas duas)
Não esqueça
Quando inverte a reação, invertemos o sinal de ΔH.
Você pode obter maiores detalhes na resolução do exercício 30
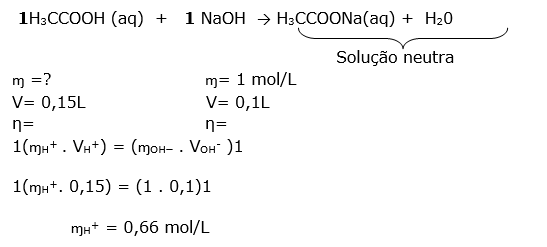
8-RESOLUÇÃO
1HNO3 (aq) + 1 KOH (aq) 1 KNO3 (aq) + 1 H2O (aq)
ɱ =0,2 mol/L ɱ= ? mol/L
V= 0,032L V= 0,025L
η=0,0064 mol η= 0,0064 mol
(ɱH+. VH+) = (ɱOH_ . VOH- )
(0,2. 0,032) = (ɱ0H-. 0,0025 )
ɱbase= 0,256 mol/L (0,26 mol/L)
DICA:o número de mols sempre obedece a proporção
9-RESP: C
I. ![]()
II. ![]()
Considere as seguintes entalpias padrão de formação:
1- C(s) + O2(g) ![]() CO2(g)
CO2(g) ![]() kJ/mol
kJ/mol
2- 6C(s) + 6H2(g) + 3O2(g) ![]() C6H12O6(s)
C6H12O6(s) ![]() kJ/mol
kJ/mol
3- 2C(s) + 3H2(g) + ![]() O2(g)
O2(g) ![]() C2H6O(l)
C2H6O(l) ![]() kJ/mol
kJ/mol
A questão pede para calvular avariação de entalpia da reação(2). Mais detalhes naresolução da questão 7
2- inverter ΔH = + 1275kJ/mol
3- manter ( x 2 ) ΔH = - 554kJ/mol
1- manter ( x 2 ) ΔH = - 788kJ/mol
ΔH = ΔH1 + ΔH2 + ΔH3 =
ΔH = 1275 +(-554) + (- 788)
ΔH = - 67 kJ
10-RESP: A
11-RESP: C
1º passo
Vamos calcular a quantidade de mols de ácido sulfúrico que foram utilizados para neutralizar a base.
Equacionar a reação de neutralização total
Calculando o numero de mols do ácido
0,8mol------------ 1 L
X ----------------- 0,05 L
X = 0,04 mol de ácido
Na questão, a proporção é de 1:2 e concluímos que o número de mols da base será o dobro.
Calculando a massa de base
40g NaOH ------- 1 mol
X ----------------- 0,08mol
X = 3,2g de NaOH gasto na titulação
Para calcular a pureza da base temos
5g NaOH ----- 100%
3,2g NaOH ---- X
X = 64%
12-RESP: A
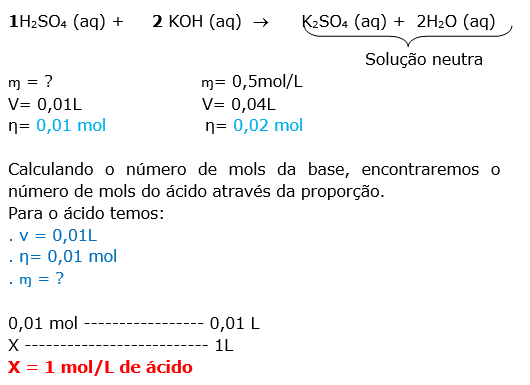
A questão envolve mistura de soluções com reação química e o caráter ( ácido, basíco ou neutro)da solução será determinado após calcular o número de mols do reagente.
Calculando o número de mols da base, encontraremos o número de mols do ácido através da proporção.
Para o ácido temos:
. v = 0,02L
. η= 2 x 10-3 mol
. ɱ = ?
2 x 10-3 mol ----------------- 0,02 L
X -------------------------- 1L
X = 0,1 mol/L de ácido
Dica: A fenolftaleína é um indicador de ácido-base, que adquire coloração róseo-avermelhado em meio básico e incolor no meio ácido
13-RESP: E
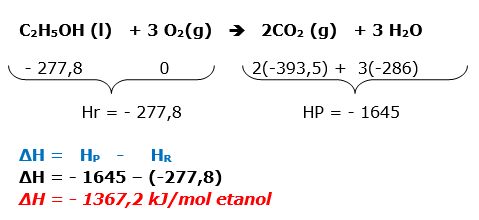
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do etanol.
Obs: Lendo atentamente o enunciado, notamos que foram consumidos 5 litros de etanol que possui densidade igual a 0,8g/cm3 = 800g/L ) e a questão quer o resultado para a queima de 1litro de etanol.
Através do enunciado,já sabemos que em 1L de etanol, temos 800g
Encontramos o valor de entalpia para 1 mol (46g) de etanol
46g etanol --------1367,2 Kj liberados
800g etanol -------- x
X = - 23777,4 kJ
Dica: Na combustão o valor de variação de entalpia, sempre será negativo, devido à liberação de calor.
A substância simples possui entalpia igual à zero no estado padrão.
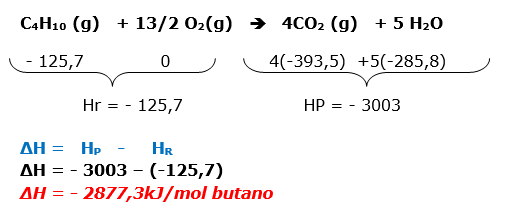
14-Resolução
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do butano.
15-Resolução
16-RESOLUÇÃO
1º PASSO
Equacionar a realização de neutralização total entre o ácido e a base.
2º PASSO
Vamos utilizar a relação abaixo, para transformar em g/L
C = ɱ.
C = 0,25.60
C = 15 g/L
Dica: Nos ácidos carboxílicos, o hidrogênio ionizável é aquele ligado ao carbono da carboxila. Portanto a proporção é de 1:1
17-RESOLUÇÃO
1º PASSO
Equacionar a realização de neutralização total entre o ácido e a base, calculando a concentração molar do ácido.
2º PASSO
Vamos utilizar a relação abaixo, para transformar em g/L
C = ɱ.
C = 0,666 . 60
C = 39,96 g/L
18-RESOLUÇÃO
A questão envolve mistura de soluções com reação química e a solução resultante será neutra, pois se trata de uma titulação.
19- RESOLUÇÃO
A questão envolve mistura de soluções com reação química e a solução resultante será neutra de acordo com a informação no texto.
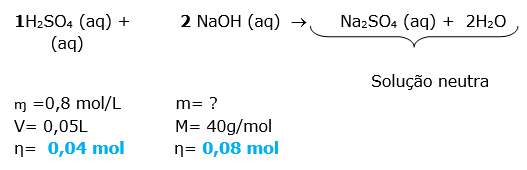
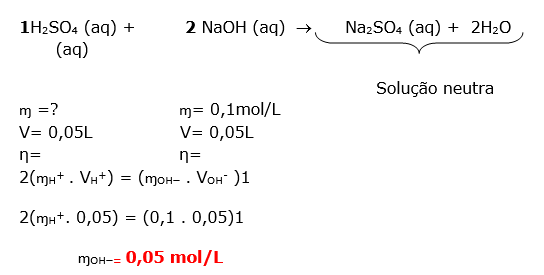
20- RESOLUÇÃO
Esta questão é envolve mistura de soluções com reação química ( titulação). O texto informa que ocorreu a neutralização.
O primeiro passo é equacionar a reação de neutralização total entre o ácido e a base. Lembrando que na neutralização total o sal formado é neutro, portanto o número de H+ é igual à quantidade de OH-
H2SO4 (aq) +2 NaOH (aq) Na2SO4 (aq) + 2 H2O (aq)
De acordo com o enunciado a solução resultante será neutra.
Dica: A solução resultante será neutra quando o número de mols dos reagentes obedecer a uma proporção.
Obs.: O sal formado na reação é neutro, mas nós estamos falando de uma solução.
Primeiro vamos determinar o número de mols dos reagentes.
Através do balanceamento da equação, notamos que a proporção é de 1:2
Com esta informação podemos calcular o número de mols da base e logo em seguida determinar a concentração molar desta solução.
Dica: prestar atenção na resolução, pois devido a um descuido você pode estar aplicando distributiva devido à presença do parênteses. Quando o correto é apenas a multiplicação.
21- RESOLUÇÃO
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do metano.
Dica: Na combustão o valor de variação de entalpia, sempre será negativo, devido à liberação de calor.
A substância simples possui entalpia igual à zero no estado padrão.
22- RESP: C
A questão indica que ocorreu uma titulação.Podemos concluir que a solução resultante é neutra e o número de mols dos reagentes obedece a uma proporção
23- RESP: B
24- RESP: A
25- RESOLUÇÃO
Dada a reação: 3 C(grafite) + 4 H2(g) C3H8(g)
1)C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(l) Hº = –2.220 kJ
2) C(grafite) + O2(g) CO2(g) Hº = –394 kJ
3) H2(g) + ½ O2(g) H2O(l) Hº = –286 kJ
II – MANTER(X3) ΔH = - 1182 kJ
III- MANTER(X4) ΔH = - 1144 kJ
I-INVERTER ΔH =+ 2220 kJ
ΔH = ΔH1 + ΔH2 + ΔH3 =
ΔH = -1182 + (-1144) + 2220
ΔH = - 106 kJ
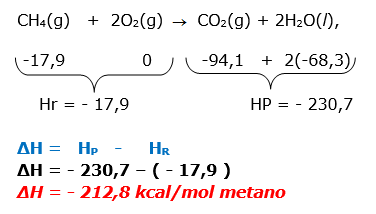
26- RESP: A
A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS. Também foi dada a reação principal, que é a combustão total do metano.
CH4(g)+ 2O2(g) CO2(g)+ 2H2O(l) ΔH = ?
Dadas as reações:
I-C(grafite) + O2(g) CO2(g) H = –94,1 kcal
II-H2O(l) H2(g) + ![]() O2(g) H = +68,3 kcal
O2(g) H = +68,3 kcal
III-C(grafite) + 2H2(g) CH4(g) H = –17,9 kcal
III – INVERTER ΔH = 17,9 kcal
I- MANTER ΔH = - 94,1 kcal
II- INVERTER (X2) ΔH =2 (-68,3) kcal = - 136,6 kcal
ΔH = ΔH1 + ΔH2 + ΔH3 =
ΔH = 17,9 + (-94,1) + (-136,6)
ΔH = - 212,8 kcal
27- RESP: - 75kJ
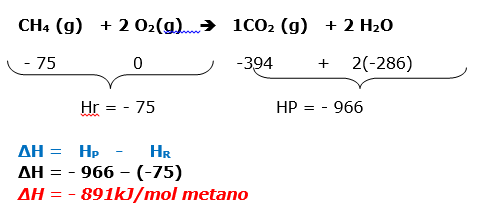
A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS. Também foi citado que a reação principal, que é a formação do metano.
Equação de formação do metano
C(grafite) + 2H2(g) CH4(g) H = ?
Dadas as reações:
I. H2(g) + ![]() O2(g) H2O(l) Hº = –286kJmol–1
O2(g) H2O(l) Hº = –286kJmol–1
II. C(graf.) + O2(g) CO2(g) Hº = –394kJmol–1
III. CH4(g) + 2O2 CO2(g) + 2H2O(l) Hº = –891kJmol–1
II – MANTER ΔH = –394kJ
I- MANTER (X2) ΔH = 2(-286kJ)= -572 kJ
III- INVERTER ΔH =+891kJmol–1
ΔH = ΔH1 + ΔH2 + ΔH3 =
ΔH = -394 + (-572) + 891
ΔH = - 75 kJ