TERMOQUÍMICA
É um ramo da termodinâmica que estuda as trocas de calor entre o sistema e o meio ambiente (e o possível aproveitamento desse calor na realização de trabalho) desenvolvidos durante uma reação química.

Reação exotérmica: são aquelas que liberam energia na forma de calor.
A + B → AB + CALOR

Reação endotérmica: são aquelas que absorvem energia na forma de calor
A + B + CALOR → AB
A unidade de energia no sistema internacional é o JOULE ( J ). Outra unidade usual é a CALORIAS, equivalente a 4,186 J.
Frequentemente nos cálculos utilizamos a quilocaloria ( kcal ) e o quilojoule ( Kj ).
ENTALPIA DE REAÇÃO
A entalpia (H ) é o conteúdo energético que cada substância possui. Em uma reação química, conseguimos calcular a variação de entalpia (ΔH ).
ΔH = HP - HR
HP = Entalpia dos produtos
HR = Entalpia dos Reagentes
∆H>0 = Endotérmica ∆H<0 = exotérmica
OBS: As substâncias simples e a forma alotrópica mais estável possui entalpia igual à zero no estado padrão ( 1 atm e 25 ºC )
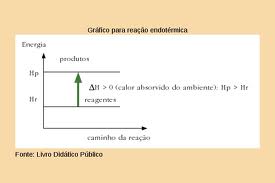
VARIAÇÃO ENDOTÉRMICA:
A ENTALPIA DOS PRODUTOS É MAIOR QUE A ENTALPIA DOS REAGENTES
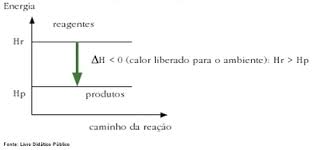
VARIAÇÃO EXOTÉRMICA:
A ENTALPIA DOS REAGENTES É MAIOR QUE A ENTALPIA DOS PRODUTOS
ENTALPIA DE FORMAÇÃO
Sempre vai formar um mol da substância, a partir de suas substancias simples.
Exemplo: H2 (g) + 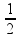 O2 ( g) 1 H2O (ℓ ) ΔH = - 68,3 kcal/mol
O2 ( g) 1 H2O (ℓ ) ΔH = - 68,3 kcal/mol
ENTALPIA DE COMBUSTÃO
É a quantidade de calor liberada na combustão de 1 mol de uma substância no estado padrão.
C6H6 (ℓ) + 15/2 O2(g) 6 CO2 (g) + 3 H2O (ℓ ) ΔH = - 782 kcal/mol
LEI DE HESS
O valor de ∆H de um processo não depende do número de etapas, nem do tipo de cada etapa do processo. Este fato permite calcular o ∆H de uma determinada reação X pela soma de reações de ∆H conhecidos, cujo resultado seja a reação X.
ENERGIA DE LIGAÇÃO
Energia necessária pra romper um mol de ligações entre dois átomos, de modo a obter esses átomos na fase gasosa.
Nos reagentes as ligações são quebradas e nos produtos as ligações são formadas.
DICAS PARA RESOLUÇÃO DE QUESTÕES DE TERMOQUÍMICA
-
Os valores de entalpia sempre serão dados, exceto a entalpia das substâncias simples que será igual à zero no estado padrão ( 1 atm e 25ºC ).
OBS: substâncias simples são moléculas constituídas de átomos iguais. Ex: H2, O2, He, etc...
-
As reações de combustão, sempre liberam calor, indicando que o valor de ΔH < 0 ( SINAL NEGATIVO ). Para resolver a questão, basta utilizar a fórmula ΔH = HP - HR
-
Para identificar as questões envolvendo a lei de Hess, basta verificar os dados.
-
A questão fornece no mínimo duas ( 02 ) reações com o valor de ΔH.
-
Na maioria das questões é dado uma reação principal que “comanda tudo”, onde será calculado ΔH da mesma. Quando a reação principal não é dada diretamente, a questão fornece condições para equacionar a mesma.
-
Todas os reagentes e produtos da principal, estão presentes nos dados ( reações ).
-
Somando as reações dadas encontramos a principal.
-
Lembrando que algumas vezes será necessário manter, inverter, dividir ou multiplicar as reações dadas.
-
INVERTER: quando a substância na principal for reagente e nos dados for produto ou vice-versa.
-
MANTER: quando a substância na principal está na mesma posição ( reagente ou produto ) da reação dada.
-
MULTIPLICAR OU DIVIDIR: quando a quantidade de mols da substância na principal for diferente da quantidade de mols da reação dada.
-
Quando inverte a reação, o valor de ΔH ,inverte o sinal.
-
Quando multiplicar ou dividir a equação, o mesmo deve ser feito com o ΔH.
-
O ΔH final será somatória dos valores de ΔH das reações.
-
ΔHf = ΔH1 + ΔH2 + ΔH3 + ΔH4 + .....
-
Nas questões envolvendo energia de ligação, nos dados temos o valor de energia para cada mol de ligação.
-
Nos reagentes a entalpia possui sinal positivo.
-
Nos produtos a entalpia possui sinal negativo.
-
O ΔH final será somatória dos valores de entalpia (H) das ligações.
-
ΔH = H1 + H2 + H3 + H4 + .....
5- Na representação gráfica, a ponta da seta está sempre em direção ao HP. Seta para cima indica que a reação é endotérmica, seta para baixo, indica que a reação é exotérmica.
RESOLVA AS QUESTÕES PROPOSTAS NO SITE E SUCESSO NOS ESTUDOS

