QUÍMICA ORGÂNICA
É a parte da Química que estuda os compostos do carbono.
Atualmente os compostos do carbono são estudados separadamente, devido a vários fatores.
1) Grande regularidade nas propriedades física, s químicas e fisiológicas dessas substancias.
2) Importância desses compostos nos organismos vivos.
3) Elevado número de substancias orgânicas conhecidas.

ÁTOMO DE CARBONO
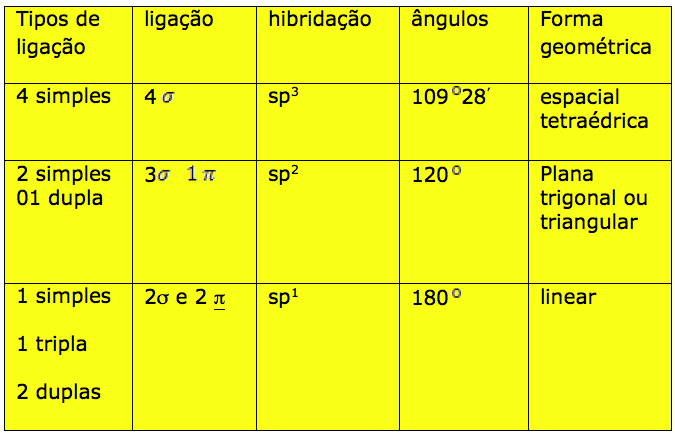
Tetravalênica: o carbono forma ligações covalentes, apresentando valência quatro.

Cada átomo pode ligar-se a um outro átomo de carbono por intermédio de um, dois ou três pares covalentes, formando o que denominamos de ligação simples, ligação dupla e ligação tripla.
TIPOS DE LIGAÇÃO DO CARBONO
-
TIPOS DE LIGAÇÃO
CLASSIFICAÇÃO DOS CARBONOS:
a) Carbono primário: ligado a apenas a um outro átomo de carbono.
b) Carbono secundário: ligado a dois outros átomos de carbono.
c) Carbono terciário: ligado a três outros átomos de carbono.
d) Carbono quaternário: ligado a quatro outros átomos de carbono.
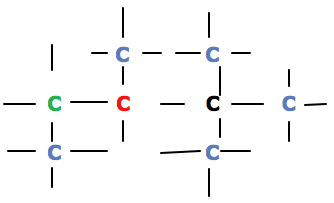
AZUL = Carbono primário.
VERDE = Carbono secundário.
VERMELHO = Carbono terciário.
PRETO = Carbono quaternário
CADEIAS CARBÔNICAS
Os átomos de carbono tem a capacidade (propriedade de ligarem-se uns aos outros, formando cadeias carbônicas.
Cadeias abertas ou acíclicas possuem no mínimo duas extremidades.
a) SATURADA: Possui apenas ligações simples entre carbonos.
b) INSATURADA: Possui pelo menos uma ligação dupla ou tripla entre carbonos.
c) NORMAL: Apresenta apenas carbono primário e secundário.
d) RAMIFICADA: Apresenta pelo menos um carbono terciário ou quaternário.
e) HOMOGÊNEA: Não possui heteroátomo.
f) HETEROGÊNEA: Apresenta o heteroátomo.
Cadeias fechadas ou cíclicas não possuem extremidades.
a) SATURADA: Possui apenas ligações simples entre carbonos.
b) INSATURADA: Possui pelo menos uma ligação dupla ou tripla entre carbonos.
c) NORMAL: Apresenta apenas carbono secundário.
d) RAMIFICADA: Apresenta pelo menos um carbono terciário.
e) HOMOGÊNEA: Não possui heteroátomo.
f) HETEROGÊNEA: Apresenta o heteroátomo.
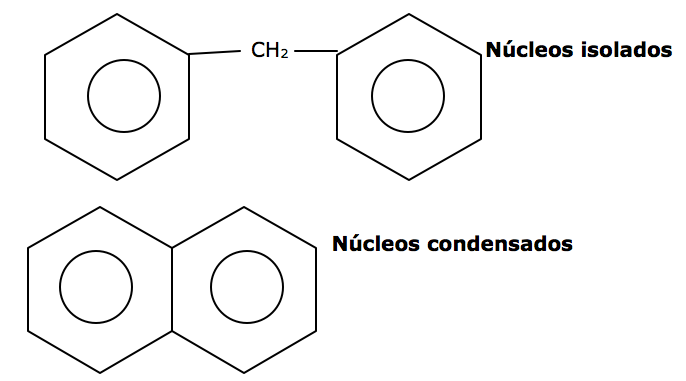
Aromáticas: Possuem no mínimo um núcleo (anel aromático) com seis carbonos ligados por simples e duplas intercaladas.
a) Aromática mononuclear: apenas um núcleo aromático.
b) Polinuclear: apresenta núcleos isolados ou condensados
OBSERVAÇÕES:
. CADEIAS MISTAS: possuem uma parte cíclica ou aromática e uma parte acíclica.
. COMPOSTOS ALIFÁTICOS: São todos os compostos excluindo os aromáticos e heterocíclicos.
. COMPOSTOS HETEROCÍCLICOS: Apresenta cadeias carbônicas heterocíclicas ou parte dela.
HIDROCARBONETO: São compostos que possuem carbono e hidrogênio.
PETRÓLEO: é um líquido oleoso e escuro, constituído por uma mistura de compostos orgânicos, onde predomina os hidrocarbonetos (compostos binários formados exclusivamente por carbono e hidrogênio).
O petróleo formou-se pela decomposição de animais e vegetais marinhos e sofreram inúmeras decomposições químicas pela ação de bactérias em ausência de oxigênio, de calor e pressão, e outros fatores.
Nas jazidas, além de petróleo, obtêm-se gases, sendo metano o principal gás e água salgada.
Após a extração o petróleo sofre destilação fracionada nas torres ou colunas de destilação ou fracionamento.
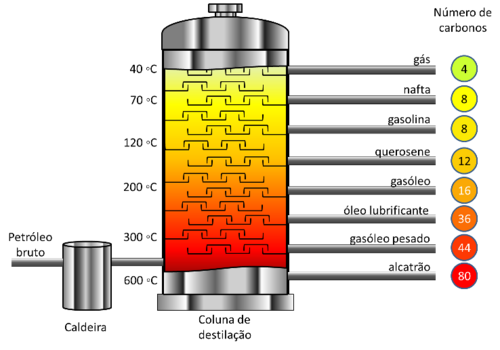
CRACKING OU CRAQUEAMENTO: É um processo em que as moléculas são quebradas, produzindo moléculas menores. Usando-se catalisadores e submetendo-as a aquecimento acima de 450ºC, as moléculas que compõem as frações querosene (11 e 12), diesel (13 a 17) e óleo lubrificantes (25 a 35) são transformadas em constituintes da gasolina (6 a 10 carbonos), Portanto o craqueamento é um processo importante, pois aumenta entre 20% e 30% a quantidade de gasolina obtida a partir do petróleo.
A medida da resistência à explosão por compressão: atribuem-se a dois constituintes da gasolina, um de baixa resistência e outro de alta, dois valores arbitrários (0 e 100), a escala estabelecida se denominou octanagem ou números de octanas. Ex: heptano : octanagem zero , 2,2,4 trimetilpentano (isoctano) 100 octanas.
- Alcano: Possui apenas ligações simples (CnH2n + 2).
- Alceno: Apresenta uma dupla ligação entre carbonos (CnH2n).
- Alcino : Possui uma tripla ligação entre carbonos (CnH2n – 2)
- Alcadieno: Apresenta duas ligações duplas entre carbonos (CnH2n – 2)
- n = nº. qualquer
ALCANOS : São hidrocarbonetos alifáticos saturados, também pode ser chamado de hidrocarboneto parafínicos pois apresentam baixa reatividade química.
Os alcanos são compostos apolares, bastante solúveis em benzeno , éter, acetona, e insolúvel em água (solventes polares). A solubilidade diminui gradativamente com o aumento da quantidade de carbono. Já os PF , PE e densidade crescem com o aumento da massa molar, mesmo assim todos os alcanos têm densidade menor que a água.
O metano é o principal constituinte do gás natural e do biogás (sendo conhecido como gás dos pântanos ou gás do lixo).
ALCENOS : São hidrocarbonetos alifáticos e insaturados, também chamados alquenos, hidrocarbonetos olefínicos (originam líquidos oleosos em presença de halogênios) . O eteno ou etileno é um dos mais importantes, o mesmo já foi utilizado como anestésico, é usado no amadurecimento artificial de frutas e na indústria petroquímica é utilizado como matéria-prima para a obtenção do polietileno, um dos plásticos mais importantes do mundo, além de outros produtos como PVC , poliestireno, óxido de etileno).
ALCINOS : São hidrocarbonetos alifáticos e insaturados. Sendo também chamados alquinos, hidrocarbonetos acetilênicos (deriva do etino, acetileno). Os alcinos que apresentam tripla ligação na extremidade da cadeia são denominados verdadeiros, os que apresentam insaturação entre os demais átomos de carbono são chamados falsos.
ALCADIENOS: São hidrocarbonetos alifáticos com duas duplas ligações.
CICLOALCANOS: Também chamados de ciclanos, apresentam cadeia fechada (cíclica) com ligações simples (CnH2n).
CICLOALCENOS: Também chamados de ciclenos, apresentam cadeia cíclica com ligações duplas (CnH2n – 2).
AROMÁTICOS: São hidrocarbonetos cíclicos com pelo menos, um núcleo benzênico que é chamado de anel aromático, onde os núcleos podem ser condensados ou isolados, onde o composto aromático mais simples é o benzeno (C6H6).
RADICAIS ORGÂNICOS
Radical é um átomo ou grupo de átomos com pelo menos uma valência livre propiciando ligação química. Os radicais monovalentes saturados podem chamados de alquil.
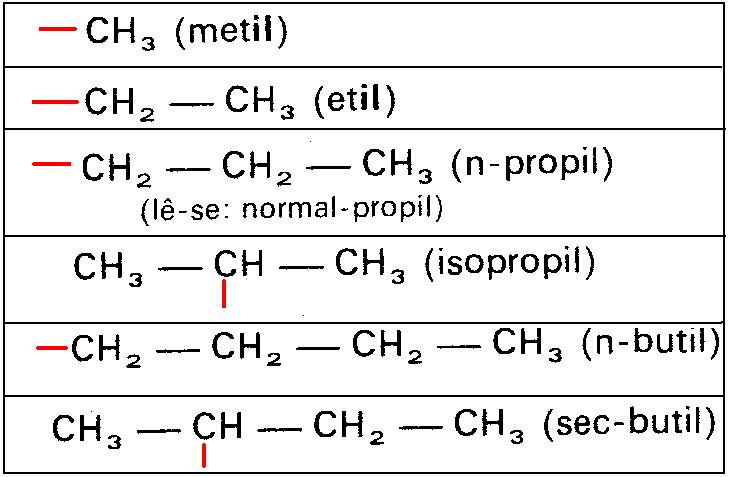
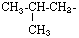 ISO - BUTIL
ISO - BUTIL
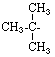 TERC – BUTIL
TERC – BUTIL
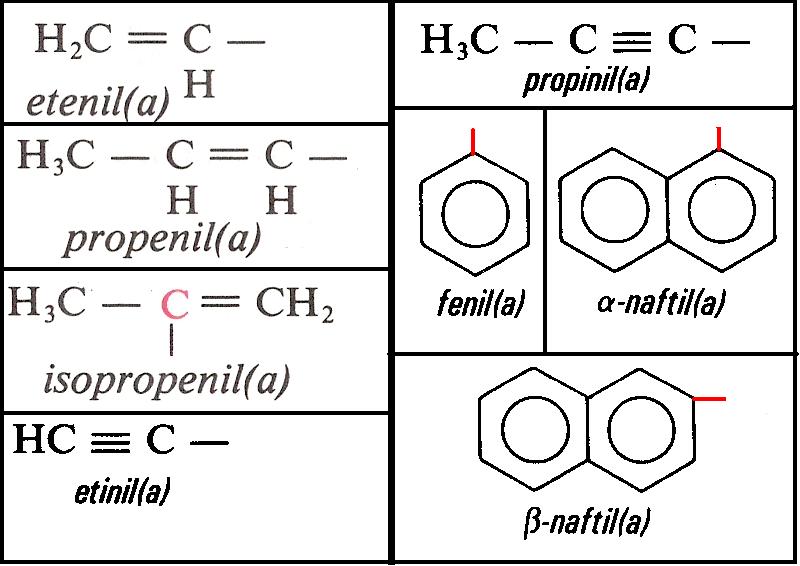
São importantes os radicais bivalentes em átomos de carbono de núcleos benzênicos. Existe três posições possíveis para as duas valências livres : orto, meta e para.
Numerando os átomos da cadeia a partir de qualquer um, teremos:
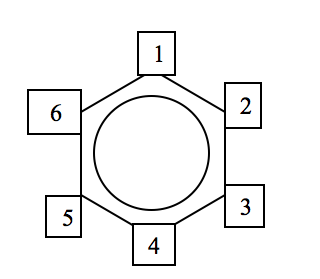
Posição orto : valências em carbonos vizinhos (posição 1,2)
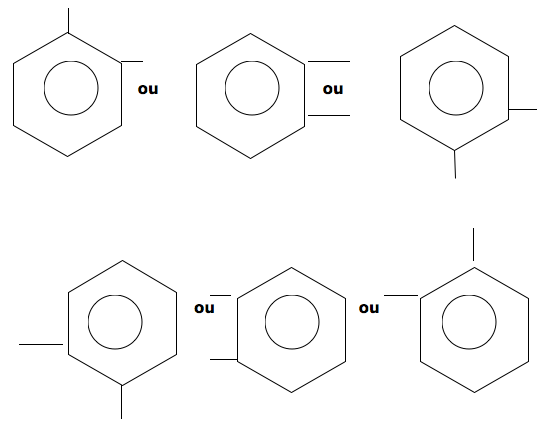
Posição meta : As valências livres estão na posição 1,3. Há um átomo de carbono entre as duas valências.
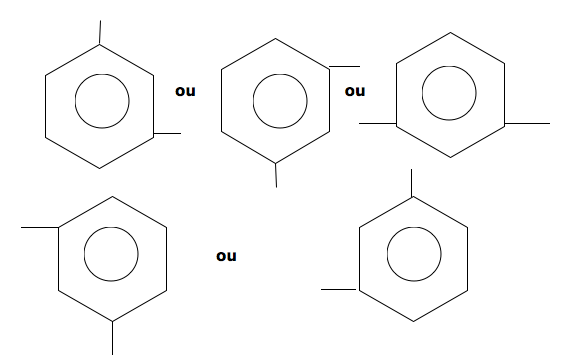
Posição para: As valências livres estão na posição 1,4. Há dois átomos de carbono entre as duas valências.
NOÇÃO DE NOMENCLATURA
Cada composto possui um nome oficial dado pela Iupac (União Internacional de Química Pura e Aplicada). Porém na química orgânica é comum encontrar uma outra nomenclatura além da oficial, denominada de nomenclatura usual. Portanto vários compostos possuem uma nomenclatura oficial e outra usual. Pode-se dividir o nome oficial em três partes: prefixo, infixo e sufixo, onde cada uma dessas partes nos dá uma informação a respeito do composto orgânico.
Exemplo: BUTANO
O prefixo BUT indica que temos quatro (04) carbonos.
O infixo AN indica que temos apenas ligação simples.
O sufixo O indica que é um hidrocarboneto.
Fórmula: H3C – CH2 – CH2 – CH3
|
Número de átomos de carbono |
Prefixo |
|
01 |
MET |
|
02 |
ET |
|
03 |
PROP |
|
04 |
BUT |
|
05 |
PENT |
|
06 |
HEX |
|
07 |
HEPT |
|
08 |
OCT |
|
09 |
NON |
|
10 |
DEC |
|
11 |
UNDEC |
|
12 |
DUODEC |
|
....... |
....... |
|
....... |
....... |
FUNÇÕES ORGÂNICAS
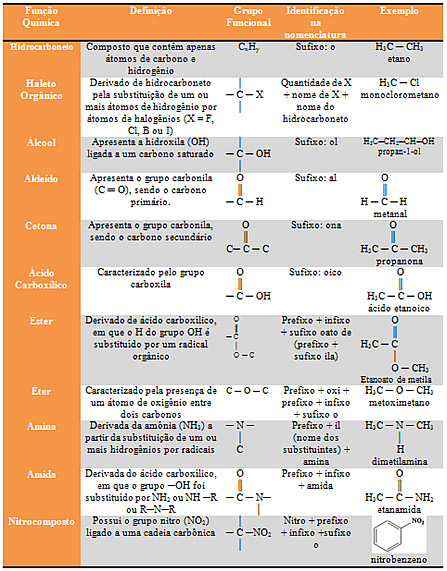
ÁCIDOS CARBOXÍLICOS
Nomenclatura oficial
Utiliza-se a terminação óico ao nome da cadeia carbônica principal (cadeia mais longa que possui o radical funcional) que deve ser precedido da palavra ácido, dos nomes e posições das ramificações.
Ácidos carboxílicos: São todos os compostos orgânicos que apresentam o radical funcional, denominado de carboxila.
Ácido metanoico: é extraído por destilação com vapor de água das formigas vermelhas, também pode ser encontrado nas abelhas e nas urtigas. A dor que se sente da picada de formigas e abelhas, é devida a injeção do ácido nos tecidos celulares. Dentre outras utilidades o ácido metanoico é empregado na indústria, como fixador de corantes em tecidos, na medicina é usado no tratamento de reumatismo e ainda como germicida.
Ácido acético: é o principal constituinte do vinagre, sendo utilizado na preparação de corantes e perfumes.
Ácido benzoico: é usado como antisséptico e também como diurético (aumenta o fluxo de urina).
ÁLCOÓIS
Apresentam o grupo funcional oxidrila (- OH) ligado a carbono saturado. A solubilidade do álcool em água diminui com o aumento de sua cadeia carbônica e aumenta com o número de grupos–OH.
Etanol ou álcool etílico: é o mais importante dos alcoóis. Pode ser preparado pela fermentação de cereais ou do melaço de cana-de-açúcar, ou obtido a partir do etileno, que por sua vez vem do petróleo. Apresenta uso variado como combustível, solvente nas indústrias de bebidas e de perfumes.

Cana-de-açúcar

Álcool primário: - OH ligado a carbono primário.
Álcool secundário: - OH ligado a carbono secundário.
Álcool terciário: - OH ligado a carbono terciário.
ALDEIDOS


Acetaldeído ou aldeído acético, tem a nomenclatura oficial denominada de etanal. Usado nas indústrias de corantes, perfumes e plásticos; produz inúmeros outros compostos e o mesmo pode ser obtido através da oxidação parcial do álcool etílico.

CETONAS

“interior” da cadeia, ou seja, entre átomos de carbono.
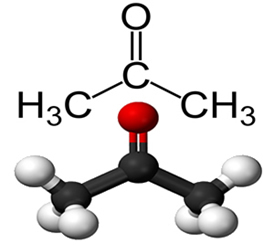
Propanona ou dimetilcetona ou acetona comum, usada na indústria de explosivos e na indústria farmacêutica, além de ser matéria-prima de inúmeros outros compostos e um ótimo solvente.


ÉSTERES:
São obtidos pela substituição do hidrogênio da carboxila por um radical orgânico, os mesmos são provenientes da reação entre um ácido e um álcool, chamada reação de esterificação.
São abundantes na natureza, e aqueles derivados de ácidos e alcoóis inferiores e médios (até doze átomos de carbono) são classificados como essências de frutas e são os responsáveis pelo sabor e aroma das frutas.

Exemplo: acetato de etila (essência de maça), acetato de isobutila (morango), acetato de n-octila (laranja).
Obs.: Os compostos artificiais que dão sabor e aroma não são necessariamente ésteres, por exemplo, a vanilina (baunilha) e o citral (sabor limão).

ÉTERES
São compostos que apresentam um átomo de oxigênio ligado a dois radicais orgânicos.
Éter comum (éter etílico) é bastante usado na indústria como solvente de óleos, gorduras, resinas e outras substâncias e na preparação da seda artificial Na medicina é usado como anestésico local, pois sua evaporação é altamente endotérmica, o que provoca um resfriamento no local onde é aplicado.

Nomenclatura: A nomenclatura oficial manda escrever o nome do menor radical, seguido do nome do hidrocarboneto correspondente ao outro radical ligado ao oxigênio.
A nomenclatura usual manda escrever a palavra éter seguida dos nomes dos radicais ligados ao oxigênio, em ordem de complexidade, e da terminação ico.
AMINAS:
São compostos orgânicos derivados da amônia (NH3).
Trimetilamina: é responsável pelo cheiro de peixe podre, após mexer com peixe é recomendável lavar as mãos com limão ou vinagre que, por conter ácidos, reagem com a amina, que tem caráter básico.

Maresia é o cheiro do mar proveniente de odores carregados de amônia, que são exalados pelos animais marinhos

 .
.

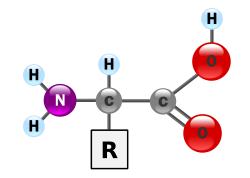
AMINOÁCIDO: é uma substância que apresenta duas funções: amina e ácido. Unidades fundamentais das proteínas.
Exemplo: NH2 – H2C – COOH (ácido aminoetanóico (glicina)
AMIDAS
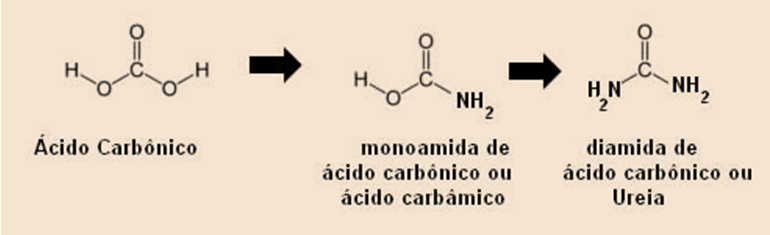
São compostos derivados da amônia, pela substituição de um ou mais átomos de hidrogênio por igual número de radicais acila.
A uréia é uma amida; é uma das substâncias excretadas na urina. Industrialmente é usada para preparar cremes umectantes e hidratantes, dentre outros produtos.


A ureia é um composto orgânico (sólido branco, cristalino e solúvel em água), pertencente ao grupo funcional das amidas. Por ser uma diamida, ela possui o caráter um pouco mais básico que as amidas comuns.
Haletos orgânicos: São derivados halogenados dos hidrocarbonetos, são compostos que apresentam um ou mais átomos de halogênio, substituindo igual nº. De hidrogênios de um hidrocarboneto. Para estes compostos temos que considerar a nomenclatura oficial e não oficial (usual). Ex: NO = bromo etano NU = brometo de etila.
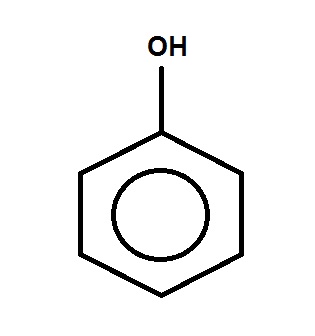
FENÓIS
Compostos derivados de hidrocarbonetos, pela substituição de um ou mais hidrogênios do carbono de núcleo aromático por igual nº. de hidroxilas.

FORÇAS INTERMOLECULARES NOS COMPOSTOS ORGÃNICOS
São as forças de atração entre as moléculas.
Quanto mais intensas forem as forças intermoleculares, mais altos serão o ponto de fusão e ponto de ebulição.
Essas forças, aparecem, devido a diferença de polaridade das moléculas e são diferentes para molécular apolares e polares.
As moléculas apolares interagem pelas forças de London ou forças de Van der Waals que são as mais fracas de todas. Portanto são substâncias que possuem os menores PF e PE entre os compostos orgânicos. Porém, quanto maior a cadeia carbônica, maior a molécula e maior a interação entre elas, indicando que quanto maior a cadeia, maior o PE e PF.
As moléculas polares podem interagir através de dois tipos de forças:as pontes de hidrogênio ( ligações do hidrogênio) e dipolos permanentes.


