Pilhas e Eletrólise
PILHAS E ELETRÓLISE
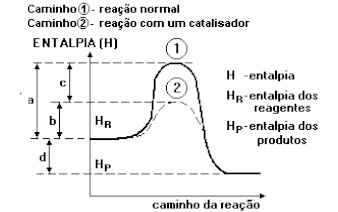
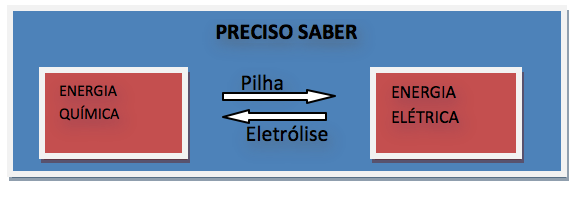
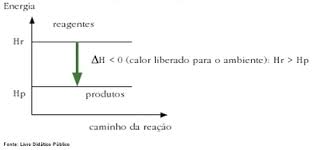
Pilhas: É uma reação espontânea de oxirredução, onde ocorre a transformação de energia química em energia elétrica.
Eletrodo: é o metal com a solução aquosa de seus íons.
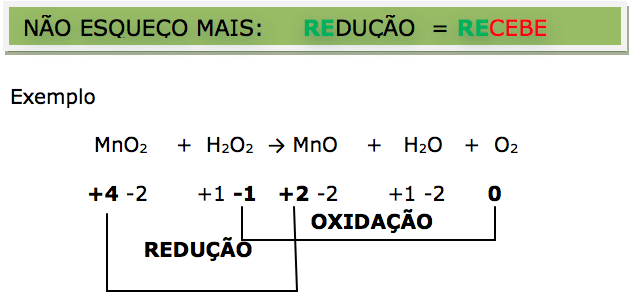
Ânodo: é o eletrodo por onde os elétrons são emitidos e nele ocorre a oxidação.
Cátodo: é o eletrodo que recebe elétrons e nele ocorre redução.
Ponte salina: é o nome dado ao tubo que contém uma solução salina, que tem a função de manter constante a concentração de íons positivos e negativos, durante o funcionamento da pilha. Portanto a ponte salina permite a migração dos íons.
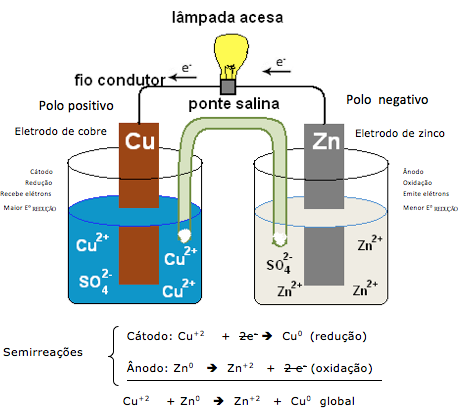
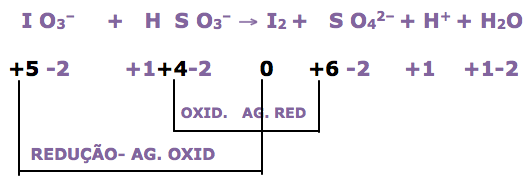
Dica: Para obter a reação global, sempre vamos cortar os elétrons. Portanto a quantidade tem que ser a mesma.
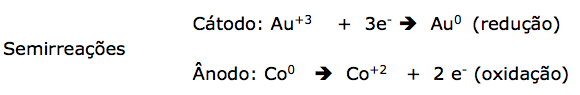
Percebemos que o número de elétrons é diferente, isto indica que temos que igualar o número de elétrons para obter a reação global. Portanto
temos que multiplicar a 1º. reação por 2 e a 2º. reação por 3.

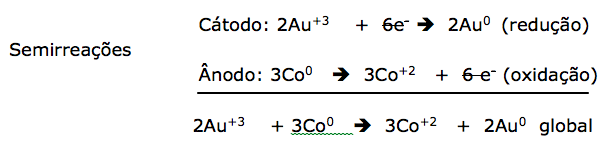

RESUMO


ELETRÓLISE
É a transformação de energia elétrica em energia química.
Podemos citar vários exemplos de utilização da eletrólise, tais como:
Proteger o ferro ou o aço por uma película de zinco para protegê-los da corrosão, deixar uma peça metálica mais brilhante, mais valiosa ou até mesmo mais resistente. Este processo é denominado deeletrodeposição.
Assim podemos dizer que a eletrodeposição ou galvanização é nada mais que a aplicação da eletrólise.

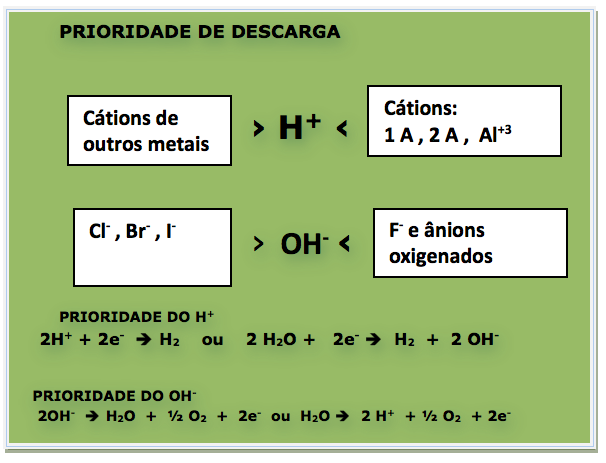
Eletrólise aquosa: é o nome de uma reação provocada pela passagem de corrente elétrica por meio de uma solução aquosa de um eletrólito.
Exemplos
a) Eletrólise de uma solução aquosa de cloreto de sódio ( NaCl(aq) ).


b) Eletrólise de uma solução aquosa de sulfato de sódio (Na2SO4(aq)).

c) Eletrólise de uma solução aquosa de cloreto de cobre II ( CuCl2(aq) ).

Eletrólise ígnea: é o nome que se dá a uma reação química que ocorre na ausência de água. Portanto a corrente elétrica passa por um composto iônico fundido.
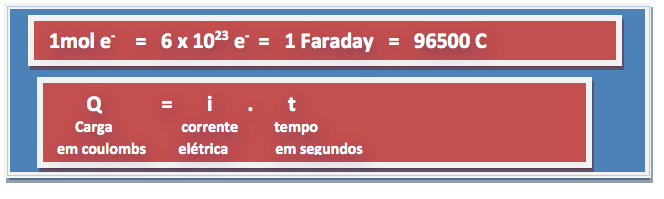
Estequiometria da eletrólise ( Lei de Faraday )
Estabelece as relações estequiométricas entre quantidade de elétrons doados ou recebidos e quantidade de produtos formado no cátodo e no ânodo.
Exemplo

RESOLUÇÃO:
1º PASSO
A questão pede a massa depositada, isto indica que é uma reação de redução.
2º PASSO
Temos os valores de tempo(t) e corrente ( i ), isto indica que podemos calcular a quantidade de carga (Q).
I = 1,50 A , t = 15 . 60 = 900 segundos Q = ?
Q = i . t Q = 1,5 . 900 = 1350 C
3º PASSO
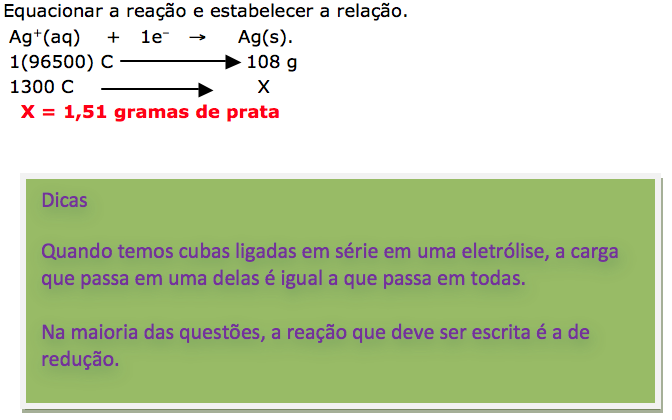









 O
O