Química Descritiva
QUÍMICA DESCRITIVA
Principais gases

Os principais gases encontrados na atmosfera são: gás nitrogênio ( 78 % ) e gás oxigênio ( 21 % ). Estes gases são obtidos através da liquefação fracionada do ar, seguida de uma destilação fracionada, onde o gás nitrogênio é o primeiro a ser destilado ( PE = - 196 ºC ) e depois vem o oxigênio com PE = - 183 ºC.
O gás nitrogênio é incolor, inodoro, pouco solúvel em água.
Devido a sua inércia química pode ser utilizado nas embalagens para conservação de alimentos.
Também é utilizado na produção de amônia e de ácido nítrico, No laboratório pode ser obtido pela decomposição térmica do nitrito de amônio ( N2 + H2O ).
O oxigênio é um gás incolor, inodoro, pouco solúvel em água, não combustível, porém um excelente comburente.
O gás oxigênio é empregado nos maçaricos, respiração artificial, inalações etc.
N o laboratório pode ser obtido pela decomposição térmica do clorato de potássio ou pela eletrólise da água.
O oxigênio sofre o fenômeno da alotropia.
Ozônio : é um gás levemente azulado, de odor aliáceo, pouco solúvel em água, não combustível e muito irritante se inalado. É encontrado na atmosfera em concentrações variadas, atingindo valores máximos a uma altura média que varia entre 10 km e 30 km. Na atmosfera o ozônio nos protege da radiação ultravioleta. Mas, aqui na superfície é um poluente muito perigoso, pois causa sérios problemas respiratórios.
A formação de ozônio é devida a decomposição do gás oxigênio, provocada pela radiação UV proveniente do Sol.
-
O2 < O (g) > + < O (g) > ( átomos isolados ) cat. UV.
-
< O (g) > + O2 O3 (g) ( reação dos átomos instáveis com outras moléculas de O2.
-
O3 O2 + < O (g) > ( O gás ozônio nos protege da radiação UV, porque sofre decomposição).
Monóxido de carbono: Não possui cheiro, é incolor e extremamente tóxico, pois se combina facilmente com a hemoglobina do sangue, formando carboxi-hemoglobina, diminuindo a taxa de transporte de oxigênio para todas as partes do nosso corpo. É produzido pela combustão incompleta ( parcial ), da gasolina, óleo diesel e etanol.
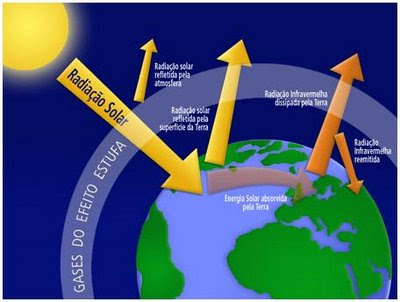
GASES RESPONSÁVEIS PELO EFEITO ESTUFA
CO2 ( ciclo do carbono e em atividades humanas ), CH4 (atividades bacterianas, plantações de arroz etc.. ), N2O ( atividade bacteriana no solo e queimadas ), CFCs ( compostos sintéticos usados em spray, isolante térmico, refrigeração, espumas sintéticas etc...).
O efeito estufa natural é importante na manutenção da temperatura média do planeta, cerca de 15ºC. O aumento da quantidade de CO2 intensifica o efeito estufa. Assim, a temperatura média do planeta tende a aumentar.

ALGUNS METAIS
A grande maioria dos metais encontra-se em compostos sólidos chamados minerais, que passam a ser denominados de minérios quando permitem bom aproveitamento industrial.
É rara a ocorrência de um elemento na forma nativa, isto é na forma de substância simples. Os casos mais importantes são os dos metais nobres, tais como (ouro, prata, mercúrio e cobre e do enxofre, muito comum nas regiões vulcânicas). Os demais são encontrados na forma de substâncias compostas ou em misturas de soluções.
Comportamento dos metais em presença do ar.
Os metais alcalinos e alcalinos terrosos, combinam-se espontaneamente com oxigênio do ar, formando óxidos. Os metais alcalinos reagem mais rapidamente com o oxigênio, portando devem ser guardados em recipientes contendo querosene.
4 Na( s) + O2 2 Na2O
Os metais alcalinos reagem com água, de maneira violenta e explosiva.
2 Na ( s) + 2 H20 (l) 2 NaOH (aq) + H2 ( g)

Ferro A principal riqueza mineral brasileira é constituída pelos minérios de ferro, dos quais a hematita é o mais importante. Há milhares de anos o homem conseguiu obter o ferro por aquecimento do minério, realizado com o uso de madeiras, posteriormente substituída por carvão e depois por coque (resíduo carbônico consistente e poroso, obtido na destilação da hulha ( carvão mineral, rico em carbono 80% )
O processo mais empregado é o do alto- forno, onde ocorre a redução da hematita a ferro ( ferro- gusa ) pela utilização do coque ou do monóxido de carbono.
Reação: Fe2O3 + 3 CO 2 Fe + 3 CO2
Ferro-gusa é o ferro que sai diretamente do alto-forno e contém cerca de 5% de carbono e é muito quebradiço.
Aço comum é obtido a partir do ferro-gusa e possui cerca de 1,5% de carbono.

Ferro doce, é obtido pela reação com gás oxigênio, que retira o carbono e forma o gás carbônico, portanto o ferro doce é praticamente puro.
Ouro: É um metal amarelo, encontrado na natureza na forma de grãos, denominados pepitas. É um metal quimicamente inerte, resiste à oxidação e outras mudanças que diminuem o brilho de outros metais. O ouro 18 quilates, ou ouro 750 é a liga mais utilizada na produção de joias.
Devido à sua boa condutividade elétrica, resistência à corrosão e uma boa combinação de propriedades físicas e químicas, apresenta diversas aplicações industriais( computadores, comunicações, naves espaciais, motores de reação na aviação, e em diversos outros produtos).

Cobre: O cobre é um metal relativamente raro, empregado das mais diversas formas. Foi o primeiro metal a ser usadas pelo homem como substituto da pedra, na confecção de armas, ferramentas de trabalho etc.
O cobre, em sua forma metálica, apresenta alta durabilidade, boa resistência à corrosão, boa maleabilidade e ductilidade. Essas duas últimas propriedades fazem dele um metal diferenciado, pois, normalmente, os metais resistentes não são maleáveis. Já o cobre pode ser transformado em fios, lâminas, bastões etc.
Essas características (propriedades) são as responsáveis pela larga utilização do cobre, usado em praticamente todas as etapas da evolução humana. Atualmente, o metal se converteu em elemento de primeira necessidade, pois, além de múltiplas aplicações, é o material mais empregado na área da eletricidade.
Existem alguns processos de obtenção do cobre na sua forma metálica, mas, geralmente, o minério contém sulfetos na sua composição ( Cu2S )e depois de extraído, britado e moído, passa por um processo que permitirá, ao final, obter o cobre metálico ( Ustulação ). ![]()
Alumínio: é bem maleável, leve (densidade abaixo de 5g/cm3) e muito resistente à corrosão. É um dos metais mais versáteis, pois, a partir dele, pode-se confeccionar, além de panelas, o papel-alumínio (que, por ser atóxico, é utilizado para proteger alimentos), painéis coletores de energia solar e muitas outras coisas . O alumínio apresenta outra boa característica: é resistente à corrosão. Essa resistência se explica devido ao fato de esse metal, quando exposto ao ar, ou seja, interagindo com o gás oxigênio, formar uma película protetora denominada óxido de alumínio (Al2O3). É preparado industrialmente por meio da eletrólise ígnea da bauxita. 2 Al2O3 4 Al (s) + 3 O2 (g ) .
Mercúrio é um metal de cor prateada que possui a característica ímpar de ser o único elemento do grupo metálico a apresentar-se em condições naturais de temperatura e pressão sob forma líquida.
Na indústria, as utilizações mais comuns do metal estão na fabricação de termômetros, barômetros, amálgama dentário, e em vários outros equipamentos científicos. Já o mercúrio-cromo e o mercurobutol são empregados como anti-séptico em ferimentos. Dissolve facilmente o ouro, prata, chumbo e metais alcalinos formando ligas relativamente consistentes denominadas amálgamas.
Devido exatamente a esta propriedade de dissolver ouro e prata, o mercúrio é amplamente utilizado na atividade de mineradores e garimpeiros, que utilizam o metal para separar o ouro de outros elementos.
Formação de ligas metálicas.
São materiais com propriedades metálicas que contém dois ou mais elementos, sendo pelo menos um deles metal.

1) Ouro 18 quilates : contém 75% de ouro, 12,5% de cobre e 12,5% de prata.
2) Amálgama: contém mercúrio, prata e estanho, usados em obturações.
3) Bronze : liga de Cu + Sn, usada na produção de sinos, moedas, medalhas, estátuas etc...
4) Aço inox : ( Fe + C + Cr + Ni), usada em talheres, peças de carro, brocas etc...
5) Latão: liga de Cu + Zn ) usada na produção de tubos, armas, torneiras, instrumentos musicais etc... Quando a porcentagem de zinco for abaixo de 25%, o latão fica com uma cor, semelhante à do ouro, sendo muito utilizado em bijuterias

