GABARITO:
1) E 2) D 3) A 4) D 5) A 6) E
7) HNO3(aq) + H2O(l) H3O+(aq) + NO–3(aq) ou HNO3(aq) H+(aq) + NO–3(aq)
Volume da solução concentrada: 1,29 mL pH = 1
8) Kps = [ Ag+] [ I-] , 9 x 10-9 mol/L 9) 13 10) azul 11) 0,25
12) E 13) E 14) C 15) C 16) A 17) A 18) D
19)a) HCl (aq) + NaOH (aq) ® NaCl (aq) + H2O (aq)
b) Concentração molar: 5x10–2 mol/L pH = 12,70 20) A 21) 30 mL 22) E 23) D
24) E 25) B 26) B 27) B 28) D
29) a) A fonte é o sangue. O íon ferro nele contido (presente na hemoglobina), ao ser posto em contato com a solução de luminol e água oxigenada em meio básico, promoverá uma reação na qual se nota a emissão de uma luz azul, observável em ambientes com essa contaminação e com pouca iluminação.
b)De acordo com o texto, a solução de água oxigenada e luminol deve ser básica. Entre as substâncias fornecidas, apenas o Na2CO3 deixa o meio básico, devido à hidrólise do íon carbonato, de acordo com equação a seguir: + H2O(l) + OH-(aq)
30) C 31) C 32) A 33) A 34) B
35) a) o valor da solubilidade é: 7 x 10–3 g/L.
b) Com a adição de Na2CO3 a solubilidade diminui em função do efeito do íon comum.
36)C 37) a) b)
RESOLUÇÃO COMENTADA
1- RESP:E
A questão é sobre hidrólise salina, onde em cada tubo é colocado uma solução.
No tubo A foi colocado foi colocado ácido acético, indicando que temos uma solução ácida que em contato com a solução indicadora de ácido-base de acordo com a tabela, no inicio tem coloração roxa e no final é vermelha.
No tubo B foi colocado foi colocado soda cáustica (hidróxido de sódio), indicando que temos uma solução básica que em contato com a solução indicadora de ácido-base e de acordo com a tabela, no inicio tem coloração roxa e no final é verde.
No tubo C foi colocado foi colocado sal para churrasco (cloreto de sódio), indicando que temos uma solução neutra que em contato com a solução indicadora de ácido-base e de acordo com a tabela, no inicio tem coloração roxa e no final permanece roxa.
DICA:O cloreto de sódio é resultado da reação do ácido clorídrico(forte) com hidróxido de sódio(forte), portanto não ocorre hidrólise e a solução é neutra pH = 7.
Resolução:
O estudante colocou no tubo A uma solução de KOH que é uma solução com o caráter básico e de acordo com o primeiro experimento a coloração no meio básico será verde.
No tubo B ele adicionou HNO3 que é uma solução ácida e de acordo com o primeiro experimento, em meio ácido a coloração é vermelha.
No tubo C ele adicionou KNO3 que é uma solução neutra e de acordo com o primeiro experimento, em meio neutro a coloração é roxa.
2- RESP:D
Questão sobre hidrólise salina, onde temos vários sais e temos identificar aquele que possui o pH = 7, ou seja, não sofre hidrólise.
Resolução:
a) NaHCO3 (ácido fraco e base forte – pH >7 ).
b) (NH4)2SO4 ( ácido forte e base fraca – pH <7 )
c) KCN ( ácido fraco e base forte – pH >7 )
d) NaCl ( ácido forte e base forte – pH =7 )
e) Na2CO3 ( ácido fraco e base forte – pH >7 )
3- RESP:A
Utilizando as dicas do exercício anterior, temos a reação que foi dada:
H2SO4(aq) + Zn(OH)2(aq) ZnSO4(aq) + 2 H2O(L).
Ácído forte + base fraca = solução ácida pH<7
4- RESP:D
Questão referente a produto de solubilidade do nitrato de cálcio ( Ca(NO3)2. A concentração dada é igual a 2 x 10-3 mol/L.
Resolução:
Vamos escrever a dissociação deste sal
Dica:é necessário escrever a dissociação, pois a partir dela iremos ter o expoente na equação de equilíbrio que são os próprios coeficientes ( em negrito).
O produto de solubilidade é igual ao produto da concentração molar dos íons.
5- RESP:A
Resolução
O enunciado indica que foi preparada uma solução de nitrato de prata ( ácido forte + base fraca ), isto nos permite dizer que o pH é menor que 7, pois prevalece o mais forte. Para chegar à resposta, precisamos calcular a concentração molar, ou seja, a concentração em quantidade de matéria( mol/L).
6- RESP:E
A tabela fornece o valor de KpS de várias substâncias, porém pede a concentração apenas de íons cálcio no carbonato de cálcio ( CaCO3 )
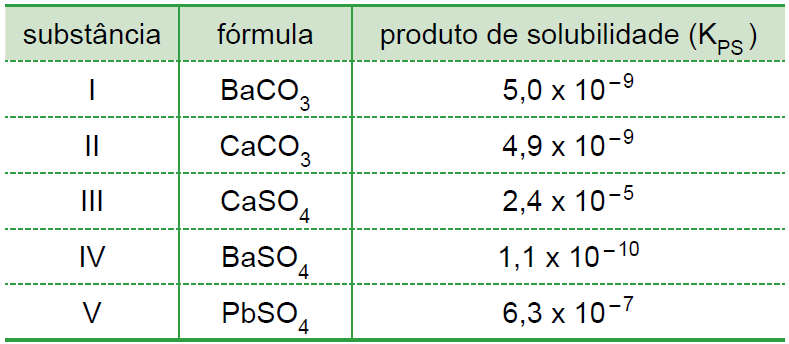
Vamos escrever a dissociação deste sal.
7- RESOLUÇÃO
Vamos calcular a concentração molar da solução utilizada para preparar os 200 mL de solução padrão de HNO3 0,1 mol/L.
Agora vamos calcular o volume da solução inicial, utilizado para preparar a solução padrão.
8- RESOLUÇÃO
Vamos escrever a dissociação deste sal.
9- RESOLUÇÃO
Para determinar o pH da solução da solução resultante, temos que calcular o número de mols dos reagentes e descobrir se a solução resultante é ácida, básica ou neutra.
Dica: A solução resultante será neutra quando o número de mols dos reagentes obedecer a uma proporção.
10- RESOLUÇÃO
Analisando as condições que a questão fornece, concluímos que:
I – No solo ácido PH<7 as flores são azuis.
II- Ao adicionar NaNO3 (nitrato de sódio)( ácido forte e base forte= solução neutra ), Não ocorreu mudança na coloração das flores, permanecendo azul.
III- Ao adicionar o CaCO3 (carbonato de cálcio – base forte e ácido fraco = solução básica pH >7), a coloração das flores passou a ser rosada.
Concluímos que as flores em um solo de pH mais ácido que o de pH 5,6 a coloração será azul.
11- RESOLUÇÃO
12- RESP:E
A questão fornece o equilíbrio, o número de mols e o volume.
3ºpasso.
No produto , a questão já fornece a concentração em mol/L.
AB(g) = 0,1 mol/L , no equilíbrio.
Analisando as afirmações:
I – CORRETA. O valor de Kc = 4
II- No equilíbrio( em negrito na tabela), a concentração de A2 é igual o 0,05 mol/L.
III- O aumento de temperatura desloca o equilíbrio no sentido endotérmico. O equilíbrio é endotérmico para a direita e exotérmica para a esquerda conforme o ΔH > 0 fornecido. Portanto o equilíbrio será deslocado para a direita que é o sentido direto da reação.
13- RESP:E
O método utilizado nesta resolução, segue o procedimento da questão 01
3º passo.
No produto , a questão já fornece a concentração em mol/L.
NH3(g) = 0,3 mol/L , no equilíbrio.
4º passo
Montar e preencher a tabela.
Dica: Vamos montar a tabela, porque os valores de concentração dos reagentes não estão em equilíbrio.
Para calcular o Kc, os valores de concentração devem ser do equilíbrio.
14-RESP: C
A reação citada na questão,é uma reação reversível chamada de reação de esterificação no sentido direto e hidrólise de éster no sentido inverso.
Dica: Sentido direto: da esquerda para a direita
15-RESP: C
O sistema possui uma mistura gasosa, onde as pressões parciais estão em equilíbrio. Portanto precisamos apenas colocar os valores na fórmula e calcular o valor de Kp.
Dica : Kp é apenas para gases.
N2(g) + 3H2(g) ![]() 2 NH3(g)
2 NH3(g)
Foi dada a pressão parcial de cada gás:
N2(g) = 0,5 atm H2(g)= 0,1 atm NH3(g)=0,01 atm
Calcular o valor de Kp
16-RESP: A
O método utilizado nesta resolução, segue o procedimento:
1º passo
Vamos determinar a concentração molar, utilizando os valores de mols fornecidos na questão.
Reagentes:
H2S(g) = 0,10 mol
Volume do recipiente = 10L
17-RESP: A
A questão fornece o equilíbrio e também o gráfico onde encontramos os valores de concentração no equilíbrio.
18-RESP: D
A questão informa que os valores de concentração estão no equilíbrio. Portanto não precisamos montar a tabela . Agora é apenas substituir na expressão de equilíbrio.
19- RESOLUÇÃO
20-RESP: A
Para determinar o pH da solução da solução resultante, temos que calcular o número de mols dos reagentes e descobrir se a solução resultante é ácida, básica ou neutra.
Dica: A solução resultante será neutra quando o número de mols dos reagentes obedecer a uma proporção.
21-RESP: E
Para determinar o pH da solução da solução resultante, temos que calcular o número de mols dos reagentes e descobrir se a solução resultante é ácida, básica ou neutra.
Dica: A solução resultante será neutra quando o número de mols dos reagentes obedecer a uma proporção.
22-RESP: E
A questão informa que coelhos com respiração natural possuem pH do sangue igual a 7,4.
Concluímos que esse valor mostra que o sangue dos coelhos é básico e a [H+] < [ OH-]
23-RESP: D
A questão fornece o sal denominado de sulfato ferroso, cuja fórmula é FeSO4. Este sal é resultado da reação do ácido sulfúrico (H2SO4 – ácido forte) com a base denominada de hidróxido ferroso ( Fe(OH)2 – base fraca).
Dica: Na hidrólise salina, prevalece o mais forte.
Ácido forte + base fraca = solução ácida ( pH < 7 ).
Portanto concluímos que a hidrólise do sulfato ferroso origina uma solução ácida onde a [H+]>[OH-].
24- RESP: E
25-RESP: B
26-RESP: B
O laboratorista precisa de uma solução neutra. Das soluções apresentadas apenas o NaCl é neutra, pois o ácido que deu origem a este sal é o ácido clorídrico (HCl que é forte ) e o hidróxido de sódio ( NaOH que é uma base forte), indicando que não ocorre hidrólise, deixando o pH igual a 7 ( neutro).
20-RESP: B
I – leite de magnésia ( Mg(OH)2 – solução básica.
II- limonada – solução ácida.
III- salmoura ( água salgada) = neutra
27-RESP: C
Foram dadas as reações:
I- CH3COO– (aq) + H2O (l) ![]() CH3COOH (aq) + OH– (aq)
CH3COOH (aq) + OH– (aq)
II-Mg(OH)2 (s) ![]() Mg2+ (aq) + 2 OH– (aq)
Mg2+ (aq) + 2 OH– (aq)
I – Correta: o acetato de sódio é derivado de ácido acético fraco e do hidróxido de sódio forte, indicando que o pH é maior que 7.
II- Falsa: quando se adiciona gotas de ácido clorídrico em I, está adicionando-se íons H+, que vai consumir OH-, deslocando o equilíbrio para a direita, deslocando no sentido do ácido acético.
III- Correta: quando se adiciona nitrato de magnésio (Mg(NO3)2 em I que possui o caráter ácido ( ácido forte = base fraca), irá consumir OH- e deslocar o equilíbrio para a direita, no sentido da formação do ácido acético.
28-RESP: D
As soluções com pH menor que 7 são ácidas, sendo derivadas de um ácido forte e uma base fraca. Podemos notar esta presença em:
II – nitrato de amônio – NH4NO3 – ácido nítrico (HNO3) e hidróxido de amônio ( NH4OH)- base fraca.
IV – nitrato de alumínio – Al(NO3)3 – ácido nítrico ( HNO3) e hidróxido de alumínio (Al(OH)3) – base fraca.
29-RESOLUÇÃO
a) A fonte é o sangue. O íon ferro nele contido (presente na hemoglobina), ao ser posto em contato com a solução de luminol e água oxigenada em meio básico, promoverá uma reação na qual se nota a emissão de uma luz azul, observável em ambientes com essa contaminação e com pouca iluminação.
b) De acordo com o texto, a solução de água oxigenada e luminol deve ser básica. Entre as substâncias fornecidas, apenas o Na2CO3 deixa o meio básico. O Na2CO3 é derivado do hidróxido de sódio que é uma base forte e do ácido carbônico que é fraco.
30-RESP: C
O NaCl não sofre hidrólise, devido ao ácido forte(HCl) e a base forte(NaOH).
31-RESP: C
De acordo com o texto, a planta Camellia japônica ( camélia) prefere solos ácidos para o seu desenvolvimento. Como o solo está alcalino, será necessário adicionar uma substância com caráter ácido, para diminuir a alcalinidade do solo.
Das substâncias mencionadas, apenas o sulfato de amônio (NH4)2SO4 é derivado de um ácido forte – H2SO4 e uma base fraca – NH4OH.
32-RESP: A
O fosfato de cálcio tem fórmula (Ca3(PO4)2)
Vamos escrever a expressão de Kps.
33-RESP: A
A questão fornece a fórmula do oxalato de cálcio e a massa molar.
34-RESP: B
O sulfato de prata tem fórmula (Ag2SO4)
Vamos escrever a expressão de Kps.
1Ag2SO4(s) ![]() 2Ag+(aq) + 1SO4-2(aq)
2Ag+(aq) + 1SO4-2(aq)
2X X
Kps = [Ag+]2 [SO4-2]
Kps =[2X]2[X] Kps = 4X3
Foi dada a concentração molar igual a 2,0 x 10-2 mol/L
Kps = 4(2 X 10-3)3
Kps = 3,2 X 10-5
35-RESOLUÇÃO
O carbonato de cálcio tem fórmula (CaCO3)
Vamos escrever a expressão de Kps.
36-RESP: C
O cloreto de chumbo tem fórmula (PbCl2)
Vamos escrever a expressão de Kps.
1PbCl2(s) ![]() 1Pb+2 (aq) + 2Cl-1(aq)
1Pb+2 (aq) + 2Cl-1(aq)
Kps = [Pb+2] [Cl-1]2
Foi dado o valor de Kps = 1,6 x 10-5e [Cl-1]= 0,3 mol/L
1,6 x 10-5 =[Pb+2][0,3]2[Pb+2] = 1,77 X 10-4 mol/L












































