Lista de exercícios – Química – prof. Raimundo. 1º. trimestre
3º. Ens. Médio 2019
- Equilíbrio químico.
-pH e pOH.
-Deslocamento de equilíbrio.
-Hidrólise salina
-Equilíbrio ácido-base
Resolução comentada no final da lista .
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Ba = 137
01 - (FPS PE/2018)
Considere uma mistura de PCl5, PCl3 e Cl2, em equilíbrio a 227 ºC, de acordo com a equação:
PCl5(g) ![]() PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
As concentrações de PCl3 e Cl2 são 0,01 mol/L e 21,3 g/L, respectivamente. Sabendo que Kc = 0,006 na mesma temperatura, calcule a concentração de PCl5 nesse equilíbrio.
02 - (FGV SP/2017)
Um indústria produz aromatizante artificial por um processo que é representado de acordo com a equação química seguinte:
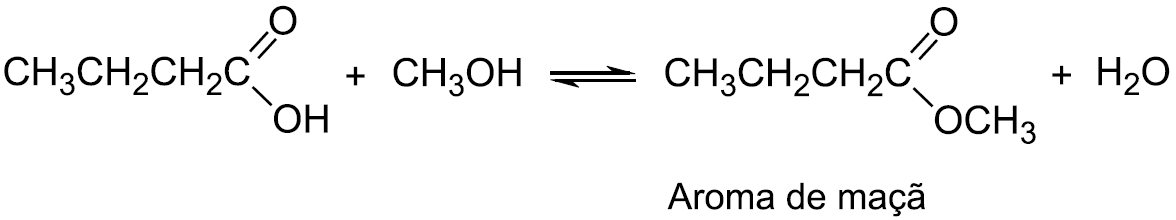
Em um teste de laboratório, foram adicionados 10 mol de
![]()
e n mol de CH3OH a um reator de 1 L. O reator foi fechado e, ao se atingir o equilíbrio reacional, verificou- se a formação de 9 mol, da substância com aroma de maçã e 9 mol de H2O.
Considerando que a constante de equilíbrio referente às condições de temperatura e pressão do processo é igual a 9, o valor correto da quantidade, em mol, de CH3OH adicionado ao reator é
a) 9.
b) 10.
d) 18.
e) 20.
03 - (UEM PR/2017)
Considere a reação abaixo, em equilíbrio, que ocorre em um reator de volume igual a 2 litros. Se 2 mols de O2(g) são injetados no reator contendo 7 mols de H2(g), e sabendo-se que o grau de equilíbrio em relação ao O2(g) é 50%, assinale o que for correto.
2H2(g) + O2(g) ![]() 2H2O(g)
2H2O(g)
01. O valor da constante de equilíbrio é igual a 0,16.
02. A concentração de água no equilíbrio é igual a 2 mol/L.
04. O número de mols de H2(g) que reagiu é igual a 2.
08. A concentração do oxigênio no equilíbrio é igual a 0,5 mol/L.
16. A introdução de gás hélio no sistema, mantendo o volume do reator constante, deslocará o equilíbrio para o lado direito da reação descrita acima, no comando da questão.
04 - (FCM PB/2018)
Ambientalistas do mundo todo tem alertado sobre os perigos do aquecimento global e a emissão de gás carbônico na atmosfera. O derretimento das calotas polares e o processo de branqueamento dos corais tem sido usados como parâmetros para acompanhar este fenômeno.
O motivo para o branqueamento dos corais está diretamente ligado à temperatura das águas. Quando ficam em regiões mais quentes, as algas alojadas em pequenos poros existentes nos corais começam a produzir substâncias químicas tóxicas ao coral. Para se defender, o cnidário expulsa as algas, expondo o exoesqueleto branco de carbonato de cálcio.

Branqueamento de corais na costa australiana.
Fonte: https://www.biologiatotal.com.br/
blog/o+branqueamento+dos+corais-341.html
O carbonato de cálcio do exoesqueleto dissolve-se em contato com a água e com o gás carbônico dissolvido. Tal dissolução do carbonato de cálcio fragiliza a base que os corais utilizam para se fixar, provocando a morte. A equação química em equilíbrio deste fenômeno é mostrada a seguir:
CaCO3 (s) + CO2 (g) + H2O (l) ![]() Ca2+ (aq) + 2HCO3– (aq)
Ca2+ (aq) + 2HCO3– (aq)
Levando em consideração a equação acima, marque a alternativa correta relacionada com os fatores que afetam o equilíbrio desse bioma.
a) Um aumento da temperatura global, incluído a do oceano, desloca o equilíbrio para a esquerda.
b) Uma diminuição da temperatura dos oceanos favorece a dissolução do CaCO3(s).
c) A dissolução do CaCO3(s) não afeta a vida marinha.
d) Um aumento na emissão de CO2 na atmosfera e sua dissolução na água do mar provoca dissolução de mais CaCO3(s).
e) O aquecimento global não compromete o equilíbrio deste bioma.
05 - (FGV SP/2018)
O iodeto de hidrogênio, HI, é uma substância gasosa empregada em sínteses orgânicas. Uma das rotas de obtenção do HI pode ser feita, em um sistema fechado, por meio da reação do hidrogênio e do iodo como representado na equação
H2 (g) + I2 (g) ![]() 2 HI (g)
2 HI (g) ![]()
A constante de equilíbrio dessa reação a 298 K é Keq = 794
Quando o compartimento reacional é aquecido a 700 K, é favorecida a formação de ________, pois na equação, no sentido da direita, a reação é ________. O valor da constante de equilíbrio da reação de formação do HI gasoso a 700 K é ________ do que a 298 K.
As lacunas são preenchidas, correta e respectivamente, por:
a) H2 e I2 … endotérmica … maior
b) H2 e I2 … endotérmica … menor
c) H2 e I2 … exotérmica … menor
d) HI … endotérmica … menor
e) HI … exotérmica … maior
06 - (UFRGS RS/2018)
Considere os dados termodinâmicos da reação abaixo, na tabela a seguir.
CO (g) + NO2 (g) ![]() CO2 (g) + NO (g)
CO2 (g) + NO (g)
![]()
Com base nesses dados, considere as seguintes afirmações sobre o deslocamento do equilíbrio químico dessa reação.
I. O aumento da temperatura desloca no sentido dos produtos.
II. O aumento da pressão desloca no sentido dos produtos.
III. A adição de CO2 desloca no sentido dos reagentes.
Quais estão corretas?
a) Apenas I.
b) Apenas II.
c) Apenas III.
d) Apenas I e II.
e) I, II e III.
07 - (FAMERP SP/2018)
Considere duas soluções aquosas, uma preparada com o sal NH4Cl e outra com o sal NaHCO3. Ambas têm a mesma concentração em mol/L. Uma delas apresenta pH igual 4 e a outra, pH igual a 8.
a) Escreva as equações que representam a hidrólise desses sais.
b) Calcule o valor da concentração de íons OH- (aq) na solução alcalina.
08 - (UECE/2017)
Um estudante de química retirou água do seguinte sistema em equilíbrio:
2NO2(g) + CH4(g) ![]() CO2(g) + 2H2O(l) + N2(g)
CO2(g) + 2H2O(l) + N2(g)
Em seguida, esse aluno constatou acertadamente que
a) a concentração de metano diminuiu.
b) o equilíbrio se desloca para a esquerda.
c) a concentração do dióxido de carbono diminuiu.
d) a concentração do nitrogênio gasoso diminuiu.
09 - (UFRR/2017)
Em 1888, Henri Le Chatelier formulou o chamado princípio de Le Chatelier que afirma: “se uma perturbação externa for aplicada a um sistema em equilíbrio, o sistema reagirá de tal modo a aliviar parcialmente essa perturbação”. Sobre essa afirmação é CORRETO afirmar:
a) O aumento da pressão desloca a reação na direção do lado com mais mols de gás;
b) Remoção de um reagente desloca o equilíbrio para a formação do produto;
c) Adição de um produto desloca o equilíbrio para a formação do produto;
d) Remoção de um produto desloca o equilíbrio para a formação do reagente;
e) Adição de um reagente desloca o equilíbrio para a formação do produto.
10 - (Mackenzie SP/2017)
Certo ácido diprótico fraco de concentração igual a 1 mol.L–1 apresenta, no equilíbrio, grau de ionização de ordem de 2 %. Considerando-se tais informações, é correto afirmar que a concentração em mol.L–1 dos íons H+ e o potencial hidroxiliônico da solução são, respectivamente,
Dados: log10 2 = 0,3; log10 4 = 0,6; log10 6 = 0,78 e log10 8 = 0,9
a) 2![]() 10–2 e 1,4
10–2 e 1,4
b) 2![]() 10–4 e 12,6
10–4 e 12,6
c) 2![]() 10–3 e 1,4
10–3 e 1,4
d) 4![]() 10–2 e 1,4
10–2 e 1,4
e) 4![]() 10–2 e 12,6
10–2 e 12,6
11 - (FPS PE/2017)
Estudos ecológicos e toxicológicos revelam uma forte relação entre baixos níveis de pH e a perda de populações de peixes em lagos. Com pH inferior a 4,5, praticamente, nenhum peixe sobrevive, enquanto níveis iguais ou superiores a 6,0 promovem populações saudáveis. Considerando o texto acima, analise as afirmações seguintes.
1. pH inferior a 4,5 indica que a água do lago está ácida.
2. pH superior a 6,0 indica que a água do lago está alcalina.
3. pH = 6,0 corresponde a uma concentração de
H3O+ = 1,0![]() 10–6 mol
10–6 mol![]() L–1
L–1
Está(ão) correta(s):
a) 1 apenas.
b) 2 apenas.
c) 1 e 3 apenas.
d) 2 e 3 apenas.
e) 1, 2 e 3.
12 - (FCM PB/2017)
Alimentos ácidos, condimentados e gordurosos costumam cair como uma bomba em estômagos mais sensíveis. É comer para logo sentir aquela azia ou queimação. Cafeína, bebidas alcoólicas, cigarro e até o nervosismo também podem piorar problemas como gastrite e úlcera. Isso ocorre porque, em situações de tensão, o sistema nervoso é acionado e estimula a produção de ácido clorídrico no estômago. Assim, o suco gástrico fica mais ácido e a agressão é maior. O suco gástrico é formado basicamente por água, de ácido clorídrico, muco, enzimas e sais. Com gastrite ele fica ainda mais ácido. A gastrite é uma inflamação da parede do estômago e acontece quando a acidez aumenta tanto que começa a agredir o órgão. Quando essa inflamação evolui, pode causar uma ferida mais grave, a úlcera. Sendo o ácido clorídrico um ácido forte, a sua ionização é total em meio aquoso, e a concentração de H+ em quantidade de matéria nesse meio será a mesma do ácido de origem. Assim, uma solução aquosa de ácido clorídrico em concentração 0,01 mol L–1 terá pH igual a:
Fonte: https://yessaude.com/wp-content/uploads/2016/07/ulcera-no-estomago.jpg
a) 4
b) 5
c) 7
d) 9
e) 2
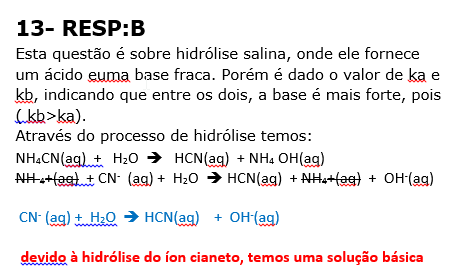
13 - (UNIUBE MG/2016)
A hidrólise salina é um processo no qual o(s) íon(s) do sal formado(s) pela neutralização entre ácido e base pode(m) reagir com a água do meio deixando a solução ácida, básica ou mantendo-a neutra. Um grupo de alunos misturou uma solução de hidróxido de amônio com uma de ácido cianídrico, ambas de mesma concentração, e fez as seguintes afirmações:
Dados: HCN (Ka = 4,9![]() 10–10); NH4OH (Kb = 1,8
10–10); NH4OH (Kb = 1,8![]() 10–5)
10–5)
I. A hidrólise ocorre com o íon NH4+, deixando o meio básico.
II. A reação envolvida seria
CN–(aq) + H2O(l) ![]() HCN(aq) + OH–(aq), pois a base é mais forte.
HCN(aq) + OH–(aq), pois a base é mais forte.
III. O sal formado será neutro, pois o ácido e a base são fracos.
É(São) VERDADEIRA(S) a(s) afirmação(ões) contida(s) em:
a) I, apenas
b) II, apenas
c) III, apenas
d) I e II, apenas
e) II e III, apenas
14 - (UNESP SP/2017)
O estireno, matéria-prima indispensável para a produção do poliestireno, é obtido industrialmente pela desidrogenação catalítica do etilbenzeno, que se dá por meio do seguinte equilíbrio químico:
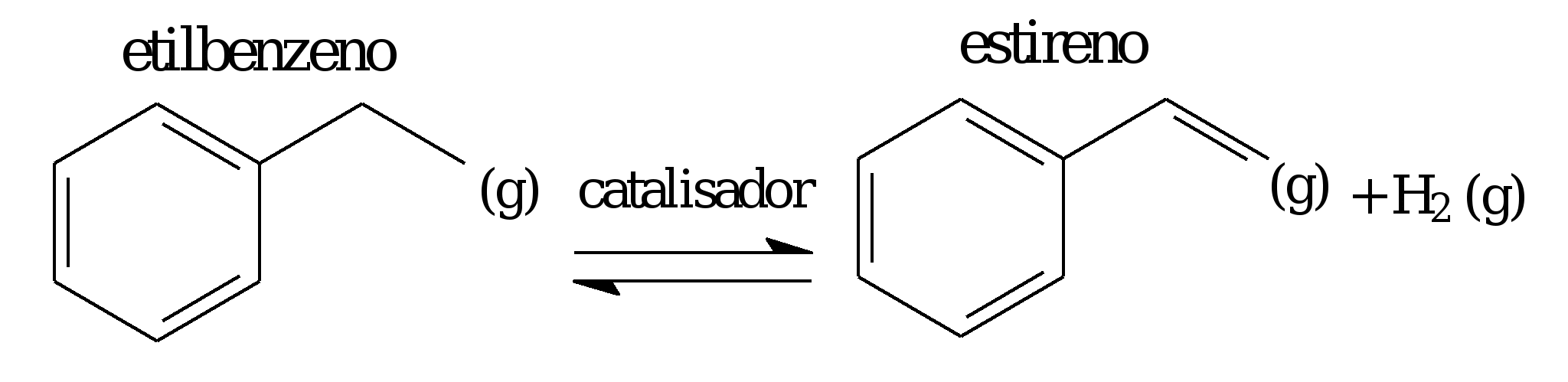
![]()
Analisando-se a equação de obtenção do estireno e considerando o princípio de Le Châtelier, é correto afirmar que
a) a entalpia da reação aumenta com o emprego do catalisador.
b) a entalpia da reação diminui com o emprego do catalisador.
c) o aumento de temperatura favorece a formação de estireno.
d) o aumento de pressão não interfere na formação de estireno.
e) o aumento de temperatura não interfere na formação de estireno.
15 - (Fac. Israelita de C. da Saúde Albert Einstein SP/2016)
O NO, óxido nítrico, é um poluente atmosférico formado em câmaras de combustão ou devido à ação de descargas elétricas. A reação a partir dos gases nitrogênio e oxigênio pode ser representada pela equação:
N2(g) + O2(g) ![]() 2 NO(g)
2 NO(g) ![]() = 180 kJ
= 180 kJ
Sobre a formação do óxido nítrico é possível afirmar que:
I. Se a reação for realizada em recipiente rígido e fechado, mantendo-se a temperatura constante, a pressão também se manterá constante.
II. O aumento de temperatura aumenta o rendimento da formação do NO.
III. Trata-se de um processo exotérmico, pois o produto apresenta maior energia do que os reagentes.
Pode-se dizer que
a) apenas as afirmações I e II estão corretas.
b) apenas as afirmações I e III estão corretas.
c) apenas as afirmações II e III estão corretas.
d) todas as afirmações estão corretas.
16 - (FAMERP SP/2016)
Considere o equilíbrio químico representado por
C (s) + CO2 (g)![]() 2CO (g) ;
2CO (g) ; ![]() = + 88 kJ / mol de CO (g)
= + 88 kJ / mol de CO (g)
O rendimento em CO (g) desse equilíbrio aumenta com o aumento da ____________, com a diminuição da ____________ e não se altera pela adição de ____________.
As lacunas do texto são, correta e respectivamente, preenchidas por:
a) temperatura – pressão – catalisador.
b) temperatura – pressão – CO2 (g).
c) pressão – temperatura – catalisador.
d) pressão – temperatura – CO2 (g).
e) pressão – temperatura – C (s).
17 - (FUVEST SP/2016)
Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta pH 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que a solução resultante apresente pH 8 é
a) 2
b) 6
c) 10
d) 14
e) 18
18 - (Centro Universitário de Franca SP/2016)
Uma etapa importante na produção industrial de ácido sulfúrico é a obtenção do trióxido de enxofre a partir da seguinte reação:
2SO2 (g) + O2 (g)![]() 2SO3 (g)
2SO3 (g) ![]() < 0
< 0
Para aumentar o rendimento da produção de ácido sulfúrico, a formação do gás trióxido de enxofre é uma etapa crítica, sendo importante favorecer o deslocamento do equilíbrio no sentido da formação desse gás. Considere que esse sistema sofre, separadamente, as seguintes ações:
1: aumento da pressão
2: adição de um catalisador
3: aumento da concentração de oxigênio
4: aumento da temperatura
As duas ações que favorecem o rendimento da produção de ácido sulfúrico são as de números
a) 1 e 2.
b) 1 e 3.
c) 1 e 4.
d) 2 e 3.
e) 2 e 4.
19 - (Unioeste PR/2015)
Os sais estão presentes em nosso cotidiano e são de suma importância para a sobrevivência dos seres humanos. Dos sais abaixo, aquele que em solução aquosa apresenta pH igual a 7 é:
a) carbonato ácido de sódio
b) sulfato de amônio
c) cianeto de potássio
d) cloreto de sódio
e) carbonato de sódio
20 - (FUVEST SP)
O cultivo de flores é uma atividade que envolve desde produtores rurais, que fazem dele seu sustento econômico, até amantes da jardinagem que dedicam suas horas de lazer em colecionar e propagar plantas ornamentais.
O professor Fernandinho que é um amante da jardinagem ( gosta tanto, que mora no residencialPortal das flores), observou que uma mesma espécie de planta podia gerar flores azuis ou rosadas. Decidiu então estudar se a natureza do solo poderia influenciar a cor das flores. Para isso, fez alguns experimentos e anotou as seguintes observações:
I. Transplantada para um solo cujo pH era 5,6 , uma planta com flores rosadas passou a gerar flores azuis.
II. Ao adicionar um pouco de nitrato de sódio ao solo, em que estava a planta com flores azuis, a cor das flores permaneceu a mesma.
III. Ao adicionar calcário moído (carbonato de cálcio) ao solo, em que estava a planta com flores azuis, ela passou a gerar flores rosadas.
Considerando essas observações, qual seria a coloração das flores obtida pelo professor Fernandinho em um solo mais ácido do que aquele de pH 5,6 ?
Justifique a sua resposta, demonstranto o processo completo de hidrólise nas observações II e III.
Justificativa errada, indica que a questão está totalmente errada.
21– (PUC/MG)
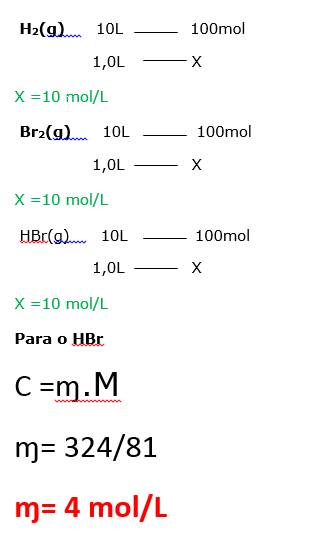
Para realizar um experimento, 200 gramas de gás hidrogênio e 100 mol de Br2 são colocados em um recipiente de 10 L de capacidade, a 575 °C. Atingindo-se o equilíbrio, a análise do sistema mostrou que 324 g/L de HBr está presente. Calcule o valor de Kc, a 575°C, para o equilíbrio: H2 (g) + Br2(g) ⇄ 2 HBr (g )
22 - (MACK SP)
Considere o processo representado pela transformação reversível equacionada abaixo.
A2(g) + B2(g) ![]() 2 AB(g) H > 0
2 AB(g) H > 0
Inicialmente, foram colocados em um frasco com volume de 10 L, 1 mol de cada um dos reagentes. Após atingir o equilíbrio, a uma determinada temperatura T, verificou-se experimentalmente que a concentração da espécie AB(g) era de 0,10 mol/L.
São feitas as seguintes afirmações, a respeito do processo acima descrito.
I. A constante KC para esse processo, calculada a uma dada temperatura T, é 4.
II. A concentração da espécie A2(g) no equilíbrio é de 0,05 mol/L.
III. Um aumento de temperatura faria com que o equilíbrio do processo fosse deslocado no sentido da reação direta.
Assim, pode-se confirmar que
a) é correta somente a afirmação I.
b) são corretas somente as afirmações I e II.
c) são corretas somente as afirmações I e III.
d) são corretas somente as afirmações II e III.
e) são corretas as afirmações I, II e III.
23 - (MACK SP)
Sob condições adequadas de temperatura e pressão, ocorre à formação do gás amônia. Assim, em um recipiente de capacidade igual a 10 L, foram colocados 5 mol de gás hidrogênio junto com 2 mol de gás nitrogênio. Ao ser atingido o equilíbrio químico, verificou-se que a concentração do gás amônia produzido era de 0,3 mol/L. Dessa forma, o valor da constante de equilíbrio (KC) é igual a
a) 1,80 · 10–4
b) 3,00 · 10–2
c) 6,00 · 10–1
d) 3,60 · 101
e) 1,44 · 104
24 - (UEPA)
Até o início do século XX, a principal fonte natural de compostos nitrogenados era o NaNO3 (salitre do Chile), que resultava da transformação de excrementos de aves marinhas em regiões de clima seco, como acontece no Chile. O salitre natural não seria suficiente para suprir a necessidade atual de compostos nitrogenados. Assim a síntese do amoníaco, descrita abaixo, solucionou o problema da produção de salitre:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
Considerando que em um sistema, a mistura dos gases tem pressões parciais de 0,01atm, 0,1atm e 0,5atm para o NH3, H2 e N2, respectivamente, em altas temperaturas, o valor de Kp é igual a:
a) 0,15
b) 0,18
c) 0,20
d) 0,24
e) 0,25
25 - (FAVIP PE)
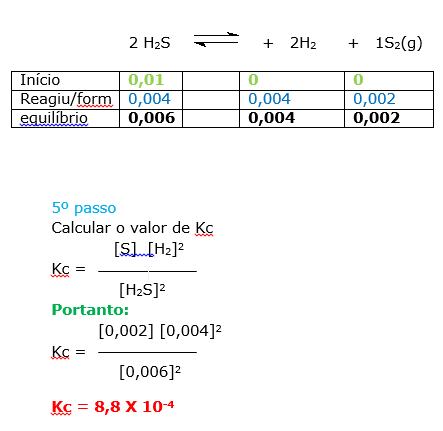
Uma amostra de 0,10 mol de H2S é colocada em um recipiente de reação de 10,0 litros e aquecida até 1.130ºC. No equilíbrio, 0,040 mol de H2 está presente. Calcule o valor de Kc para a reação:
2H2S(g) ![]() 2 H2(g) + S2(g)
2 H2(g) + S2(g)
a) 8,9 10–4.
b) 2,5 10–4.
c) 4,7 10–3.
d) 6,1 10–3.
e) 3,3 10–2.
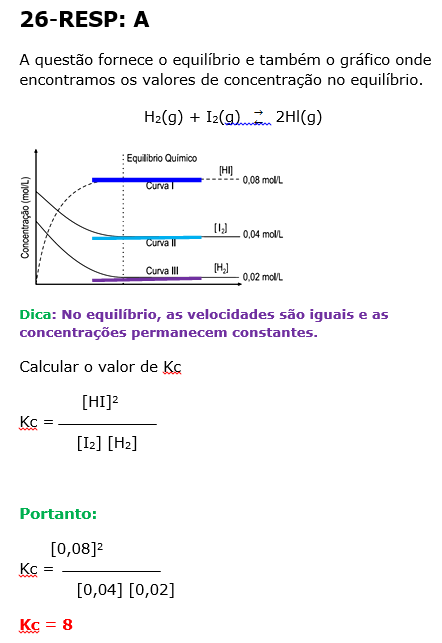
26 - (FM Petrópolis RJ)
O corpo humano é uma fábrica química, e, mesmo assim, aparentemente, permanece inalterado dia após dia. Tal situação está relacionada com as inúmeras reações químicas reversíveis, que estão em equilíbrios dinâmicos.
Considere a seguinte reação química, dentro de um recipiente fechado, a temperatura constante:
H2(g) + I2(g) ![]() 2Hl(g)
2Hl(g)
O gráfico abaixo apresenta as concentrações das substâncias envolvidas ao longo do tempo.
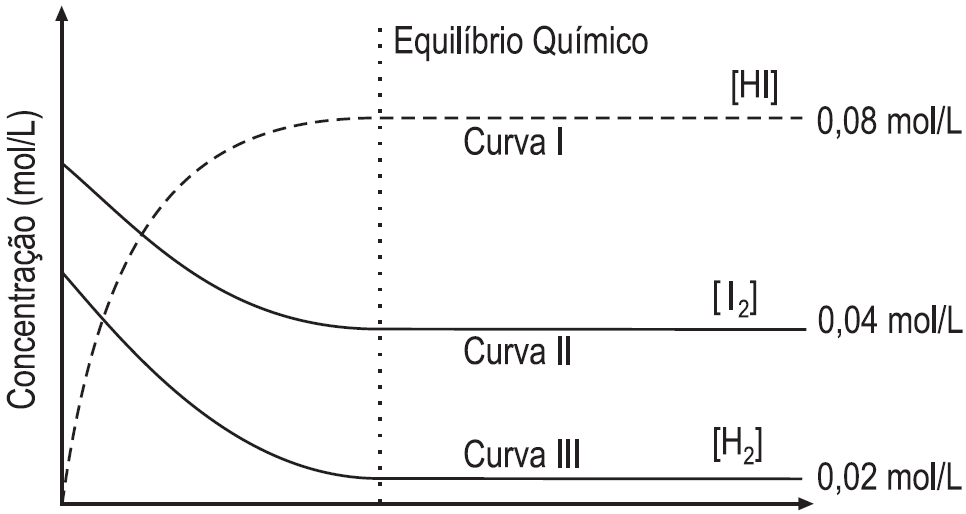
Com base no gráfico e nos respectivos valores do estado de equilíbrio químico alcançado por cada componente da reação, afirma-se que o valor da constante de equilíbrio para a reação é
a) 8
b) 10
c) 16
d) 25
e) 100
27 - (UFG GO)
Em um laboratório, um analista misturou 1 L de uma solução de ácido clorídrico 0,1 mol/L com 1 L de uma solução de hidróxido de sódio 0,2 mol/L.
A partir das informações fornecidas,
a) escreva a equação química balanceada.
b) calcule a concentração molar e o valor do pH da solução resultante. Use log 5 = 0,70.
28 - (UNIRG TO)
Um analista preparou uma solução de NaOH e outra de HCl, ambas na concentração de 0,100 mol/L. Ao misturar 10 mL da solução de HCl com 90 mL da solução de NaOH, o pH da solução final foi, aproximadamente, igual a: Dados: log 8 = 0,9
a) 13,0
b) 10,0
c) 4,0
d) 1,0
29 - (PUC Camp SP)
O cardiologista John Kheir, do Hospital Infantil de Boston (EUA), liderou um estudo em que coelhos com a traqueia bloqueada sobreviveram por até 15 minutos sem respiração natural, apenas por meio de injeção de oxigênio na corrente sanguínea. A técnica poderá prevenir
parada cardíaca e danos cerebrais induzidos pela privação de oxigênio, além de evitar a paralisia cerebral quando há comprometimento de oxigenação fetal.
(Revista Quanta, ano 2, n. 6, agosto e setembro de 2012.
Coelhos com respiração natural possuem pH do sangue igual a 7,4.
(Revista Brasileira de Anestesiologia, v. 53, n. 1,
Janeiro-Fevereiro, 2003. p. 25-31).
Esse valor mostra que o sangue dos coelhos é
a) ácido, porque possui [H+] = [OH–].
b) ácido, porque possui [H+] < [OH–].
c) neutro, porque possui [H+] =[OH–].
d) básico, porque possui [H+] >[OH–].
e) básico, porque possui [H+] <[OH–].
30 - (Univag MT)
Amplamente usado no tratamento da anemia, o sulfato ferroso (FeSO4) é um sal originário de uma base fraca e um ácido forte. Dissolvendo uma amostra desse sal na água, conclui-se corretamente que essa solução tem
a) caráter básico, logo pH < 7. b)caráter ácido, logo [H+] < [OH–]. c) caráter neutro, logo pH = 7.
d) caráter ácido, logo [H+] > [OH–]. e) caráter básico, logo pH > 7.
31 - (UNESP SP)
Em um estudo sobre extração de enzimas vegetais para uma indústria de alimentos, o professor solicitou que um estudante escolhesse, entre cinco soluções salinas disponíveis no laboratório, aquela que apresentasse o mais baixo valor de pH. Sabendo que todas as soluções disponíveis no laboratório são aquosas e equimolares, o estudante deve escolher a solução de
a) cianeto de amônio. b) fosfato de potássio c) carbonato de sódio.
d) nitrato de potássio. e) sulfato de amônio.
32 - (UERJ)
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução. Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
a) ácido clorídrico b) cloreto de sódio c) hidróxido de sódio d) bicarbonato de sódio
33 - (FATEC SP)
Considere as seguintes misturas:
I. leite de magnésia (suspensão aquosa de hidróxido de magnésio);
II. limonada ( suco de limão, água e açúcar);
III. salmoura ( cloreto de sódio dissolvido em água).
Assinale a alternativa que classifica, corretamente, essas três misturas.

34 - (FMJ SP)
Em uma aula de laboratório, utilizando-se água destilada (pH = 7,0), foram preparadas separadamente soluções 0,1 mol/L de
I. cloreto de potássio;
II. nitrato de amônio;
III. acetato de sódio;
IV. nitrato de alumínio.
O pH das soluções foi medido com papel indicador universal.
Apresentaram valores de pH menor que 7 apenas as soluções
a) I e III. b) I e IV. c) II e III. d) II e IV. e) III e IV.
35 - (MACK SP)
O pH dos solos varia de 3,0 a 9,0 e para a grande maioria das plantas a faixa de pH de 6,0 a 6,5 é a ideal, porque ocorre um ponto de equilíbrio no qual a maioria dos nutrientes permanecem disponíveis às raízes. A planta Camellia japonica, cuja flor é conhecida como camélia, prefere solos ácidos para o seu desenvolvimento. Uma dona de casa plantou, em seu jardim, uma cameleira e a mesma não se desenvolveu satisfatoriamente, pois o solo de seu jardim estava muito alcalino. Sendo assim, foi-lhe recomendado que usasse uma substância química que diminuísse o pH do solo para obter o desenvolvimento pleno dessa planta. De acordo com as informações acima, essa substância química poderá ser
a)carbonato de cálcio. b)nitrato de potássio. c)sulfato de amônio. d)nitrato de sódio. e) carbonato de magnésio.
GABARITO: 1) 0,5 mol/L 2)D 3) soma = 12 4) D 5) C 6) C 7)a)NH4+ (aq) + H2O NH4OH + H+(aq) e
HCO3- (aq) + H2O H2CO3(aq) + OH-(aq) b) [OH-] = 1 X 10-6 mol/L 08) A 09)E 10) E 11)C 12) E 13)B
14)C 15)A 16)A 17)E 18)B 19) D 20) azul 21) 0,25 22) E 23) E 24) C 25) A 26) A
27) a) HCl (aq) + NaOH (aq) NaCl (aq) + H2O (aq)
b) Concentração molar: 5x10–2 mol/L pH = 12,70 28) A 29) E 30) D31) E 32) B 33) B 34) D35) C
RESOLUÇÃO COMENTADA
01- RESOLUÇÃO
1º passo
Vamos determinar a concentração molar, utilizando os valores de mols fornecidos na questão.
Reagentes:
PCl5(s) = não foi dada
Volume do recipiente = 1L ( não foi dado)
2º passo
No produto , a questão já fornece a concentração em mol/L e g/L.
PCl3(g) = 0,01 mol/L , no equilíbrio.
Cl2(g) = 21,3 g/L ( 0,3 mol/L ) , no equilíbrio.
C =ɱ.M
ɱ= 21,3/71
ɱ=0,3 mol/L
02- RESP:D
Dados:
A questão forneceu o volume de 1 litro e a quantidade de reagentes em mol.
DICA: Quando o volume for igual a 1 litro, o número de mols será a própria concentração em mol/L
Vamos montar a tabela, porque os valores de
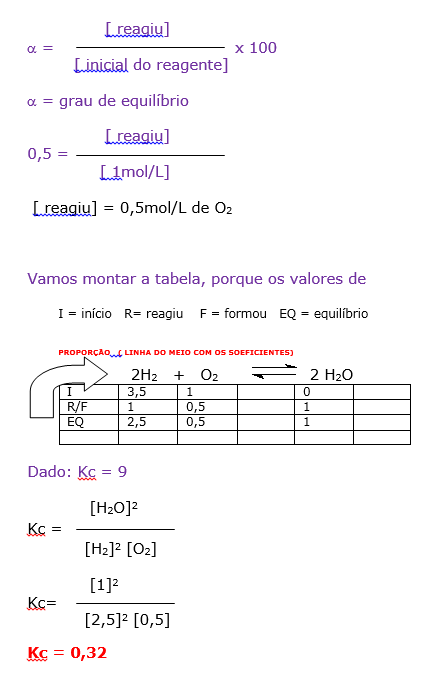
03- RESOLUÇÃO
Dados:
A questão forneceu o volume de 2 litro e a quantidadede reagentes em mol.
Transformaar os valores de mol em mol/L
Para o gás oxigênio ( O2)
2 mol ...........2L
X ...........1L
X = 1mol/L
Para o gás hidrogênio ( H2)
7 mol ...........2L
X ...........1L
X = 3,5 mol/L
Portanto:
1- Falso
2- Falso
4- verdadeira
1mol ..............1L
X .............. 2L
X = 2 mol de H2
8- Verdadeiro
16- Falso
Soma = 12
04- RESP:D
Esta questão é sobre deslocamento de equilíbrio.
Portanto o aumento da emissão de CO2, desloca o equilíbrio para a esquerda, favorecendo a dissolução do carbonato de calcio ( CaCO3).
Dica: Mais informações na resolução da questão de número 16
05- RESP:C
O equilíbrio é exotérmico no sentido direto ( direita)
O aumento de temperatura desloca o equlíbrio no sentido endotérmico, portanto para a esquerda, favorecendo a formação de H2 e I2 , diminuindo a formação de HI.
06- RESP:C
A questão fornece os valores de entalpia, o qual podemos determinar o valor de ΔH e verificar se a reação é ENDO ou EXO no sentido direto
ΔH = HP - HR
ΔH = - 303,2 – ( - 77,3 )
ΔH = - 225,9 Kj ( reação exotérmica para a direita)
I- Falsa
II- Falsa
III- Verdadeira
07- RESOLUÇÃO
a) NH4+ (aq) + H2O NH4OH(aq) + H+(aq)
HCO3- (aq) + H2O H2CO3(aq) + OH-(aq)
b) pH = 8 pOH = 6 [OH-] = 1 X 10-6 mol/L
08- RESP:A
A questão forneceu o equilíbrio e esta questão é sobre deslocamento de equilíbrio.
2NO2(g) + CH4(g) ![]() CO2(g) + 2H2O(l) + N2(g)
CO2(g) + 2H2O(l) + N2(g)
Com a retirada da água, o equilíbrio será deslocado para a direita, diminuindo a concentração de CH4 e NO2.
Dica:Quando retiramos na direita, o equilíbrio desloca para a direita e vice-versa. Quando aumentamos na esquerda, o equilíbrio desloca paraa direita e vice-versa.
09- RESP:E
O aumento da concentração de um reagente, desloca o equilíbrio no sentido da formação do produto
11- RESP:C
1- VERDADEIRA: Solução ácida: pH < 7.
2- FALSA: Solução alcalina: pH > 7
3- VERDADEIRA: pH = 6 [H+] = 1 X 10-6 mol/L
12- RESP:E
No texto, foi dado que a solução é de ácido clorídrico de concentração igual a 0,01 mol/L e já podemos concluir que o pH será menor que 7.
[H+] = 1 X 10-2 mol/L
pH = - log [H+]
pH = - log10-2
pH = 2
14- RESP:C
O equilíbrio dado é endotérmico (ΔH > 0).
O aumento de temperatura desloca o equilíbrio no sentido endotérmico, favorecendo a formação do estireno.
15- RESP:A
Esta questão é de deslocamento de equilíbrio.
N2(g) + O2(g) ![]() 2 NO(g)
2 NO(g) ![]() = 180 kJ
= 180 kJ
Notamos que é uma reação endotérmica, pois o ΔH é positivo, isto indica que o aumento de temperatura desloca o equilíbrio para a direita, favorecendo a formação de NO. O volume do recipiente não muda, indicando que a pressão permanece constante.
Portanto concluímos que está correta o que se diz em I e II.
17- RESP:E
Questão envolvendo diluição de soluções e pH.
Dados: ANTES: pH = 9 pOH = 5 [OH-] = 10-5 mol/L V= 2 L
Dados: DEPOIS: pH = 8 pOH = 6 [OH-] = 10-6 mol/L
ɱ1 = 10-5 mol/L v1 =2L ɱ2 = 10-6 mol/L v2 = ?
ɱ1 v1 = ɱ2 v2
10-5. 2 = 10-6. v2
v2 = 20L
A questão pede o volume adicionado
20 – 2 = 18 litros
25-RESP: A
O método utilizado nesta resolução, segue o procedimento:
1º passo
Vamos determinar a concentração molar, utilizando os valores de mols fornecidos na questão.
Reagentes:
H2S(g) = 0,10 mol
Volume do recipiente = 10L
2º passo
Determinar a concentração molar,ou seja, calcular o número de mols existentes em um litro ( mol/L ).
29-RESP: E
A questão informa que coelhos com respiração natural possuem pH do sangue igual a 7,4.
Concluímos que esse valor mostra que o sangue dos coelhos é básico e a [H+] < [ OH-]
30-RESP: D
A questão fornece o sal denominado de sulfato ferroso, cuja fórmula é FeSO4. Este sal é resultado da reação do ácido sulfúrico (H2SO4 – ácido forte) com a base denominada de hidróxido ferroso ( Fe(OH)2 – base fraca).
Dica: Na hidrólise salina, prevalece o mais forte.
Ácido forte + base fraca = solução ácida ( pH < 7 ).
Portanto concluímos que a hidrólise do sulfato ferroso origina uma solução ácida onde a [H+]>[OH-].
32-RESP: B
O laboratorista precisa de uma solução neutra. Das soluçõesapresentadas apenas o NaCl é neutra, pois o ácido que deu origem a este sal é o ácido clorídrico (HCl que é forte ) e o hidróxido de sódio ( NaOH que é uma base forte), indicando que não ocorre hidrólise, deixando o pH igual a 7 ( neutro).
33-RESP: C
I – leite de magnésia ( Mg(OH)2 – solução básica.
II- limonada – solução ácida.
III- salmoura ( água salgada) = neutra
Foram dadas as reações:
I- CH3COO– (aq) + H2O (l) ![]() CH3COOH (aq) + OH– (aq)
CH3COOH (aq) + OH– (aq)
II-Mg(OH)2 (s) ![]() Mg2+ (aq) + 2 OH– (aq)
Mg2+ (aq) + 2 OH– (aq)
I – Correta: o acetato de sódio é derivado de ácido acético fraco e do hidróxido de sódio forte, indicando que o pH é maior que 7.
II- Falsa: quando se adiciona gotas de ácido clorídrico em I, está adicionando-se íons H+, que vai consumir OH-, deslocando o equilíbrio para a direita, deslocando no sentido do ácido acético.
III- Correta: quando se adiciona nitrato de magnésio (Mg(NO3)2 em I que possui o caráter ácido ( ácido forte = base fraca), irá consumir OH- e deslocar o equilíbrio para a direita, no sentido da formação do ácido acético.
34-RESP: D
As soluções com pH menor que 7 são ácidas, sendo derivadas de um ácido forte e uma base fraca. Podemos notar esta presença em:
II – nitrato de amônio – NH4NO3 – ácido nítrico (HNO3) e hidróxido de amônio ( NH4OH)- base fraca.
IV – nitrato de alumínio – Al(NO3)3 – ácido nítrico ( HNO3) e hidróxido de alumínio (Al(OH)3) – base fraca.
35-RESP: C
De acordo com o texto, a planta Camellia japônica ( camélia) prefere solos ácidos para o seu desenvolvimento. Como o solo está alcalino, será necessário adicionar uma substância com caráter ácido, para diminuir a alcalinidade do solo.
Das substâncias mencionadas, apenas o sulfato de amônio (NH4)2SO4 é derivado de um ácido forte – H2SO4 e uma base fraca – NH4OH.