Lista de exercícios–Química – prof. Raimundo. 1º. Trimestre - 2º. Ens. Médio 2019
- RELAÇÃO ENTRE AS CONCENTRAÇÕES
- CONCENTRAÇÃO COMUM E MOLAR.
- TEORIA ATÔMICA MOLECULAR.
- COEFICIENTE DE SOLUBILIDADE
- DILUIÃO DE SOLUÇÕES
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
A resolução comentada está no final da lista
01 - (Mackenzie SP/2017)
A tabela abaixo mostra a solubilidade do sal X, em 100 g de água, em função da temperatura.
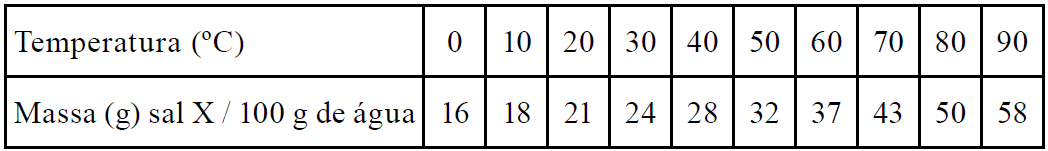
Ao preparar-se uma solução saturada do sal X, a 60 ºC, em 200 g de água e resfriá-la, sob agitação até 10 ºC, serão precipitados quantos gramas desse sal?
02 - (UEPG PR/2017)
A 18ºC, a solubilidade do cloreto de magnésio é de 56 g por 100 g de água. Nessa temperatura, 150 g de MgCl2 foram misturados em 200 g de água. Sobre esta solução, assinale o que for correto.
01. O sistema obtido é homogêneo.
02. A massa de sólido depositada foi de 38 g.
04. Se aquecermos essa solução, não haverá mudança na solubilidade da mesma.
08. A massa de MgCl2 dissolvida na H2O foi de 112 g.
16. A solução obtida é insaturada.
03 - (Unievangélica GO/2017)
Atualmente, a população brasileira tem consumido uma quantidade considerável de refrigerantes, o que tem causado obesidade e muitos outros malefícios, devido, principalmente, à concentração média do açúcar. No rótulo de um determinado refrigerante informa-se que 200 mL do produto contém 27 gramas de açúcar. Houve um anúncio de que o fabricante desse mesmo refrigerante, usando essa concentração, reduziu aproximadamente 10 toneladas de açúcar de seus refrigerantes, mas não se informa há quanto tempo isso aconteceu. Com essa quantidade de açúcar que ele economizou, o volume de refrigerantes que o mesmo produziria é de aproximadamente
a)74 mil litros
b)148 mil litros
c)124 mil litros
d)1,450 mil litros
04 - (ENEM/2017)
A ingestão de vitamina C (ou ácido ascórbico; massa molar igual a 176 g/mol) é recomendada para evitar o escorbuto, além de contribuir para a saúde de dentes e gengivas e auxiliar na absorção de ferro pelo organismo. Uma das formas de ingerir ácido ascórbico é por meio dos comprimidos efervescentes, os quais contêm cerca de 0,006 mol de ácido ascórbico por comprimido. Outra possibilidade é o suco de laranja, que contém cerca de 0,07 g de ácido ascórbico para cada 200 mL de suco.
O número de litros de suco de laranja que corresponde à quantidade de ácido ascórbico presente em um comprimido efervescente é mais próximo de
a)0,002.
b)0,03.
c)0,3.
d)1.
e)3.
05 - (UNIRG TO/2018)
Os polivitamínicos apresentam vitaminas e oligoelementos em sua composição. Um certo polivitamínico apresenta 600 mg de ácido ascórbico, de fórmula molecular C6H8O6, em sua formulação. Após dissolver um comprimido desse produto comercial em 200 mL de água, considerando-se que todo o ácido ascórbico tenha dissolvido nesse volume de água e que não ocorreu mudança de volume, assinale a única alternativa que apresenta a concentração, em mol.L–1, de ácido ascórbico na solução:
a)0,017.
b)0,010.
c)0,015.
d)0,021.
06 - (PUC Camp SP/2018)
Os xaropes são soluções concentradas de açúcar (sacarose). Em uma receita caseira, são utilizados 500 g de açúcar para cada 1,5L de água. Nesse caso, a concentração mol/L de sacarose nesse xarope é de, aproximadamente,
Dado: Massa molar da sacarose = 342 g/mol
a)2,5.
b)1,5.
c)2,0.
d)1,0.
e)3,0.
07 - (UERJ/2018)
Em análises metalúrgicas, emprega-se uma solução denominada nital, obtida pela solubilização do ácido nítrico em etanol.
Um laboratório de análises metalúrgicas dispõe de uma solução aquosa de ácido nítrico com concentração de 60% m/m e densidade de 1,4 kg/L. O volume de 2,0 mL dessa solução é solubilizado em quantidade de etanol suficiente para obter 100,0 mL de solução nital.
Com base nas informações, a concentração de ácido nítrico, em g.L –1, na solução nital é igual a:
a)10,5
b)14,0
c)16,8
d)21,6
08 - (Unievangélica GO/2017)
O vinagre é usado como conservante de alimentos e também na culinária para dar sabor. Sabe-se que o vinagre é basicamente uma solução aquosa de ácido acético (massa molar 60 g/mol) e que tem uma concentração aproximada de 4% e densidade igual a 1g/mL conforme rótulos de várias marcas.
Considerando-se as informações dadas e os devidos conhecimentos de química, calcule a massa de ácido acético em cada 100 mL de vinagre.
09 - (UNITAU SP/2018)
O formol é uma solução aquosa utilizada, por exemplo, para preservação de animais mortos e de peças de anatomia. O formol comercializado contém CHOH na concentração de 37% (massa/volume).
Calcule o volume necessário da solução de formol 37%; o volume de água para se preparar 250 mL de uma solução de CHOH 14,8% (massa/volume).
10 - (FPS PE/2017)
A cefalotina, C16H16N2O6S2, é um antibiótico que possui ação bactericida, sendo utilizada em infecções variadas, incluindo a meningite. Um auxiliar de enfermagem precisa administrar 50,0 mL de uma solução de cefalotina 6,0![]() 10–2 mol.L–1 em um paciente, e a enfermaria só dispõe de ampolas de 20 mL com concentração igual a 0,25 mol.L–1 de cefalotina. Calcule o volume de cefalotina 0,25 mol.L–1 que deve ser aspirado da ampola para administrar a dosagem prescrita.
10–2 mol.L–1 em um paciente, e a enfermaria só dispõe de ampolas de 20 mL com concentração igual a 0,25 mol.L–1 de cefalotina. Calcule o volume de cefalotina 0,25 mol.L–1 que deve ser aspirado da ampola para administrar a dosagem prescrita.
a)10 mL
b)12 mL
c)14 mL
d)16 mL
e)18 mL
11 - (PUC RS)
O Ministério da Saúde recomenda, para prevenir as cáries dentárias, 1,5 ppm (mg/L) como limite máximo de fluoreto em água potável. Em estações de tratamento de água de pequeno porte, o fluoreto é adicionado sob forma do sal flúor silicato de sódio (Na2SiF6; MM = 188g/mol). Se um químico necessita fazer o tratamento de 10000 L de água, a quantidade do sal, em gramas, que ele deverá adicionar para obter a concentração de fluoreto indicada pela legislação será, igual a quanto?
12 - (UCS RS/2017)
Curvas de solubilidade, como as representadas no gráfico abaixo, descrevem como os coeficientes de solubilidade de substâncias químicas, em um determinado solvente, variam em função da temperatura.
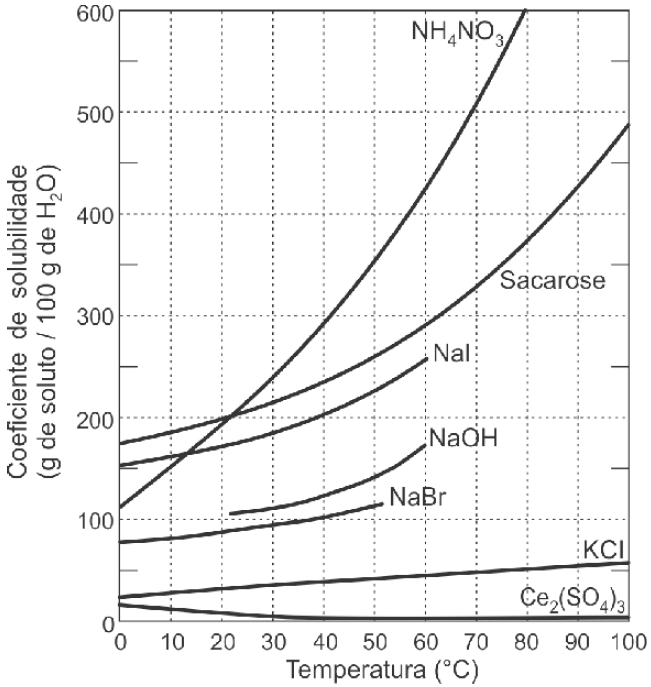
Fonte: BRADY, James E., RUSSELL, Joel W., HOLUM, John R.
Química: a matéria e suas transformações.
3. ed. LTC: Rio de Janeiro, V. 1, 2002. p. 385.
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
a) Todas as substâncias químicas são sais, com exceção da sacarose.
b) O aumento da temperatura de 10 ºC para 40 ºC favorece a solubilização do sulfato de cério (III) em água.
c) A massa de nitrato de amônio que permanece em solução, quando a temperatura da água é reduzida de 80 ºC para 40 ºC, é de aproximadamente 100 g.
d) O aumento da temperatura, favorece a dissolução do iodeto de sódio.
e) A 0 ºC, todas as substâncias químicas são insolúveis em água.
13 - (UEG GO/2016)
Considere 5 L de uma solução aquosa contendo 146 g de cloreto de sódio que será utilizada como solução de partida para outras de mais baixa concentração. Uma quantidade de 2 mL dessa solução contém uma massa de soluto, em miligramas, de aproximadamente
a)3
b)29
c)58
d)73
e)292
14 - (FPS PE/2017)
Formol, também conhecido como formalina, é uma solução aquosa de metanal ou formaldeído. Em altas concentrações, essa solução é utilizada para conservar cadáveres ou peças anatômicas. Determine a quantidade de formaldeído (CH2O) presente em 5,0 L de uma solução 12 mol.L–1 de formol. Dados: Massas molares em g.mol–1:
a)1,8 kg
b)2,5 kg
c)3,7 kg
d)4,6 kg
e) 5,0 kg
15 - (UECE/2016)
O magnésio subministrado na forma de cloreto de magnésio tem papel importante para o fortalecimento dos músculos e nervos, função imunológica, reforça a estrutura óssea, regula os níveis de pressão arterial e o açúcar do sangue, etc. A título experimental, um estudante de bioquímica preparou uma solução de cloreto de magnésio utilizando 200 g de água e 20 g de cloreto de magnésio que passou a ter densidade de 1,10 g/mL. Para essa solução, a concentração em quantidade de matéria é, aproximadamente,
a) 1,05 mol/L.
b) 1,20 mol/L.
c) 1,30 mol/L.
d) 1,50 mol/L.
16 - (Centro Universitário de Franca SP/2016)
O quadro apresenta a estrutura da vitamina C e sua solubilidade em água em função da temperatura.
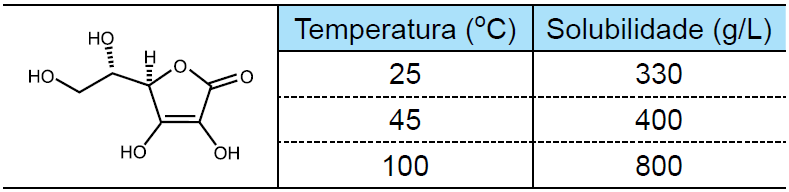
Qual a massa de vitamina C, em gramas, que pode ser cristalizada quando 2 litros de solução saturada dessa vitamina a 100 ºC são resfriados para 45 ºC?
17 - (FEI SP)
Tem-se 180g de uma solução aquosa de sacarose (C12H22O11), saturada a 50°C. Qual a massa de cristais que se separam da solução, quando ela é resfriada até 30°C? Dados: Coeficiente de solubilidade (Cs) da sacarose em água: Cs à 30°C = 220g/100g de água Cs à 50°C = 260g/100g de água
18 - (UNESP SP/2015)
Em um laboratório didático, um aluno montou pilhas elétricas usando placas metálicas de zinco e cobre, separadas com pedaços de papel-toalha, como mostra a figura.
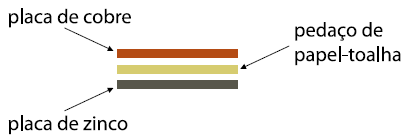
Com o conjunto e os contatos devidamente fixados, o aluno adicionou uma solução de sulfato de cobre II (CuSO4) aos pedaços de papel-toalha de modo a umedecê-los e, instantaneamente, houve o acendimento da lâmpada.
Sabe-se que o aluno utilizou 63,8g de sulfato de cobre II para preparar uma solução de concentração igual a 1,00 mol L–1. Calcule o volume em mL de água necessária para o preparo desta solução.
19 - (UFPEL RS/2015)
Segundo algumas orientações nutricionais, a dose diária recomendada de vitamina C (C6H8O6), a ser ingerida por uma pessoa adulta, é de 2,5 X 10–4 mol. Se uma pessoa consome, diariamente, uma cápsula de 440 mg dessa vitamina, a dose consumida por esse paciente é X vezes maior do que a recomendada. Nesse caso, X equivale a quanto?
20 - (IFPE/2015)
O sulfato ferroso faz parte da composição de remédios indicados para combater a anemia (deficiência de ferro). Esses remédios são usados para combater a deficiência alimentar de ferro, prevenção de anemia e reposição das perdas de ferro por dificuldades na absorção. Considere um vidro de remédio de 200mL que contém 3,04g de sulfato ferroso dissolvido na solução. Assinale a alternativa que indica corretamente a concentração, em quantidade de matéria por litro (mol/L), do ferro (II) no sulfato ferroso, presente neste remédio.
-
0,05 b) 0,20 c) 0,60 d) 0,10 e) 0,40
21 - (UEPA/2015)
Em 100 mL do refrigerante, exposto no Texto XXV, a concentração em mol/L de ciclamato de sódio (NaC6H12SNO3), conforme o rótulo, é:
Dados: considere a massa molar do ciclamato de sódio=201 g/mol.
a) 5,0 x10–4 mol/L b) 1,2 x10–3 mol/L c) 3,5 x10–3 mol/L d) 4,7 x10–3 mol/L e) 5,5 x10–3 mol/L
22 - (UNIFICADO RJ/2015)
Aciclovir é um antiviral indicado no tratamento do vírus do herpes humano, incluindo o vírus do herpes simplex, tipos 1 e 2, e o vírus varicella zoster.
Há, no mercado, comprimidos de aciclovir de 200 mg, 400 mg e 800 mg. Há também a forma em xarope, com apresentação de 200 mg/5 mL. Portanto, a concentração em quantidade de matéria do aciclovir no xarope é, em mol.L–1, Dado: A massa molar do aciclovir é 225 g/mol.
a)0,18 b)0,28 c)0,58 d)0,88 e)0,98
23 - (UDESC SC)
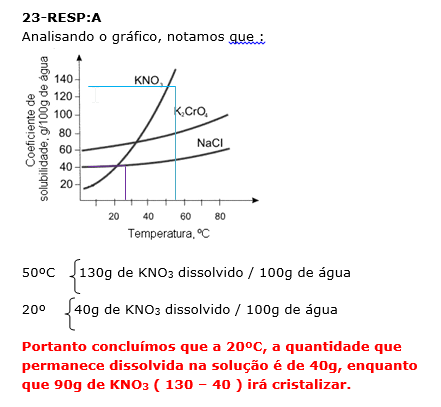
A figura abaixo representa a curva de solubilidade de alguns sais.
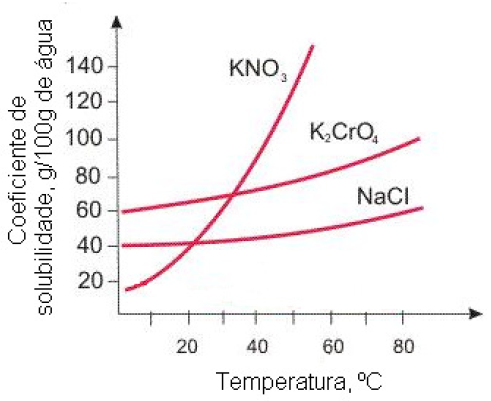
Assinale a alternativa que representa, sequencialmente, a massa (em gramas) de nitrato de potássio que é cristalizada e a massa que permanece na solução, quando uma solução aquosa saturada desse sal a 50ºC é resfriada para 20ºC.
a)90g e 40g b)40g e 90g c)90g e 130g d)10g e 65g e)05g e 40g
24 - (Univag MT)
A solubilidade em água do glutamato monossódico mono-hidratado, sal muito utilizado na culinária oriental para reforçar o sabor dos alimentos, é cerca de 60 g/100 mL a 20 ºC. Sabendo que a fórmula molecular dessa substância é C5H8NNaO4.H2O, conclui-se que a concentração aproximada, em mol/L, de uma solução saturada desse sal a 20 ºC é
a) 4.
b) 5.
c) 2.
d) 1.
e) 3.
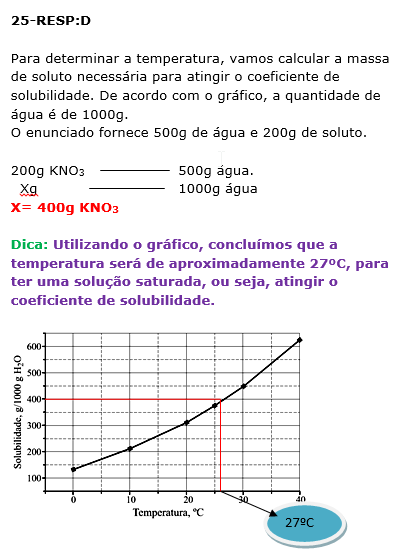
25 - (UNESP SP)
No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em gramas de soluto por 1000 g de água).
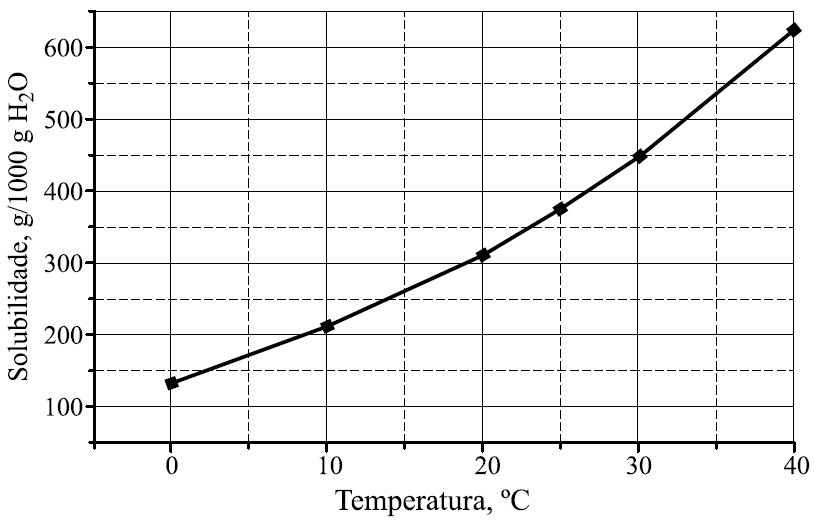
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução deve estar a uma temperatura, aproximadamente, igual a
a)12 °C. b)17 °C. c)22 °C. d)27 ºC. e)32 °C.
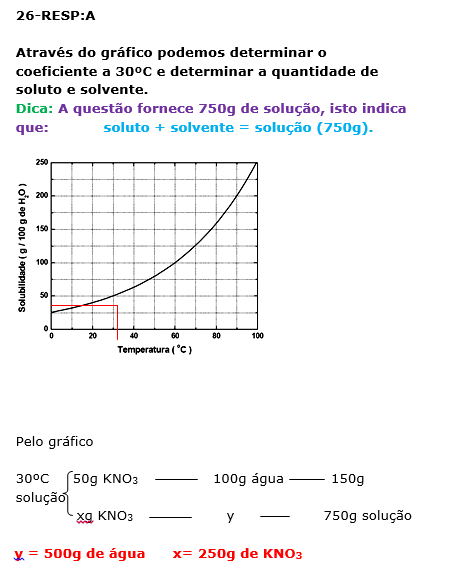
26 - (UFV MG)
A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico abaixo:
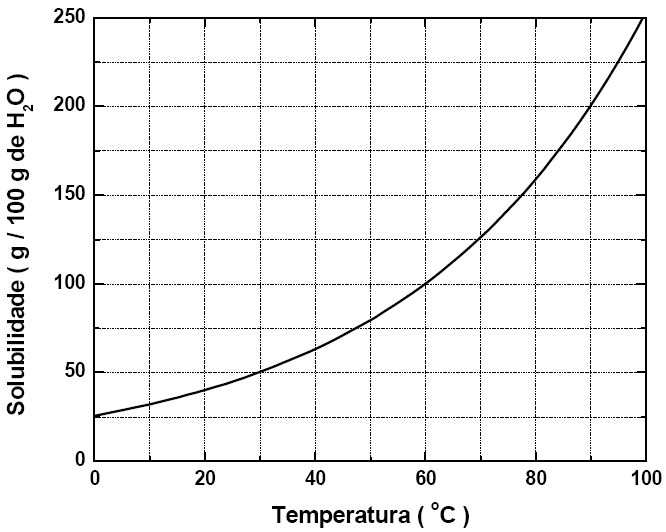
De acordo com o gráfico, assinale a alternativa que indica CORRETAMENTE a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 °C:
a)250 b)375 c)150 d)100 e)500
27 - (UFSCAR SP)
Após a conclusão do ensino médio, uma jovem estudante começou a se preparar para a realização das provas de vestibulares de algumas universidades. Em certo dia, durante os estudos, sentiu azia estomacal. Preocupada, sua mãe dissolveu todo o conteúdo de um envelope de medicamento num copo d’água (200 mL) e deu para a filha tomar. Após o alívio estomacal, a estudante pediu para ver o envelope do medicamento e anotou a sua composição:
• bicarbonato de sódio: 2,10 g
• carbonato de sódio: 0,50 g
• ácido cítrico: 2,25 g
A estudante, entusiasmada, recordou das aulas de química e lembrou-se de alguns conceitos, como soluções e reações químicas, especialmente da reação entre o carbonato de sódio e o ácido produzido pelo estômago, o HCl:
xHCl+ yNa2CO3zNaCl+ wCO2 + uH2O
Se o envelope do medicamento contivesse somente bicarbonato de sódio (2,10 g) e se o volume final do conteúdo do copo d’água não se alterasse após a dissolução do medicamento, é correto afirmar que a concentração, em mol/L, de bicarbonato de sódio (massa molar 84 g/mol) nesta solução seria de
a) 0,025.
b) 0,050.
c) 0,075.
d) 0,100.
e) 0,125.
28 - (ESCS DF)
Para tentar explicar a presença de clorometano e diclorometano em amostras recolhidas em Marte pela sonda Viking, cientistas aqueceram uma mistura de percloratos com o solo do deserto do Atacama, no Chile, possivelmente similar ao solo marciano. As reações químicas da experiência destruíram os compostos orgânicos do solo, liberando traços de clorometano e diclorometano como os encontrados pela sonda.
Considerando que em uma amostra foram encontradas 6 1015 moléculas de clorometano e 1,2 1017 moléculas de diclorometano, os números de mols aproximados de clorometano e de diclorometano são, respectivamente:
a) 1 10–9 e 2 10–7;
b) 1 10–8 e 2 10–7;
c) 1 10–6 e 5 10–6;
d) 1 106 e 2 108;
e) 1 108 e 5 106.
29 - (ACAFE SC)
No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem sobre o ataque com armas químicas na Síria ´´[...] O gás sarin é inodoro e invisível. Além da inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio miligrama. […]”.
Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140g/mol.
a) 1,681026 moléculas.
b) 3,001023 moléculas.
c) 2,141021 moléculas.
d) 2,141018 moléculas.
30 - (UFTM MG)
Os “cianokits”, que são utilizados por socorristas em outros países nos casos de envenenamento por cianeto, geralmente contêm 5 g de hidroxocobalamina ( massa molar igual a 1,3 x 103 g/mol ) injetável. Considerando a constante de Avogadro igual a 6 1023 mol–1, calcula-se que o número aproximado de moléculas existentes nessa massa de hidroxocobalamina é
a) 2 1021.
b) 2 1025.
c) 3 1025.
d) 3 1021.
e) 1 1021.
GABARITO:
1) 38g 2) soma = 10 3) A 4) E 5) A 6) D 7) C 8) 4g 9) 100 mL fornol 37%, 150 mL H2O 10) B 11) 24,7 g 12)D 13) C 14) A 15) A 16) 800g 17)20g 18)400 mL 19)10 vezes 20)D 21)B 22)A 23)A 24)E 25)D 26)A 27)E 28)B 29)D 30)A
RESOLUÇÃO COMENTADA
03-RESP: A
O texto fornece a massa e o volume de açúcar, portanto conseguimos calcular a concentração em um litro.
27g ............0,2L
X ...............1,0L
X = 135g/L
Com esta concentração ele reduziu aproximadamente 10 toneladas ( 10 x 106 gramas) de açúcar.
135g ..............1L
10 X 106g ........x
X = 74,07 litros de refrigerante
04-RESP: E
Ácido ascórbico
- 0,006 mol
- 176g/mol
Portanto vamos calculara massa de ácido.
176 g .........1 mol
x..............0,006 mol
X = 1,056g de ácido
Calcular o volume de suco de laranja para obter a mesma massa de ácido
0,07g ------ 0,2L
1,056G ------ X
X = 3,01L
12-RESP: D

Afirmativa a é falsa : temos a presença do NaOH que é uma base.
Afirmativa b é falsa: de acordo com o gráfico, notamos que o aumento de temperatura, diminui a solubilidade do Ce2(SO4)3.
Afirmativa c é falsa: em 80ºC, temos 600g dissolvido. Quando diminuímos a temperatura para 40ºC, verificamos no gráfico que o coeficiente é de 300g dissolvido. Portanto quando diminuímos a temperatura de 80ºC para 40ºC, irá permanecer dissolvido 300g ( 600 – 300 ).
Afirmativa d é verdadeira: O aumento de temperatura favorece a dissolução do iodeto de sódio.
Afirmativa e é falsa: podemos notar no gráfico que a 0ºC, a solubilidade do nitrato de amônio é maior que 100g
24-RESP:E
A questão fornece a massa ( 60g) presente em 100 mL (0,1L) de solução.
A questão pede a concentração em mol/L, ou seja, quantos mols de glumato em um litro de solução.
Para resolver, primeiro vamos determinar a massa molar do glutamato.
1)Massa molar
C5H8NNaO4 . H2O = 60 + 8 = 14 + 23 +64 + 18 = 177 g/mol
2) Determinar o número de mols em 60g de glutamato.
177g glutamato .............. 1 mol
60g glutamato .............. x
X = 0,338 mol de glutamato.
3) Calculo da concentração molar em 1 litro.
0,338 mol ............... 0,1L
X mol ............... 1,0L
X= 3,38 mol/L