Lista de exercícios–Química – prof. Raimundo. 3º. Trimestre - 2º. Ens. Médio 2018
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Se = 79
Resolução comentada e gabarito no final da lista. É só clicar.
-
CINÉTICA QUÍMICA (LEI DA VELOCIDADE , FATORES QUE INTERFEREM NAVELOCIDADE E GRÁFICOS)
-
TERMOQUÍMICA ( ENERGIA DE LIGAÇÃO).
01 - (PUC SP/2017)
A reação de hidrogenação do etileno ocorre com aquecimento, na presença de níquel em pó como catalisador. A equação termoquímica que representa o processo é
C2H4(g) + H2(g) ![]() C2H6(g)
C2H6(g) ![]() = –137 kJ.mol–1
= –137 kJ.mol–1
Dado:
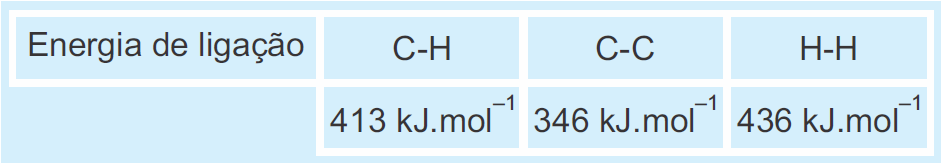
A partir dessas informações, pode-se deduzir que a energia de ligação da dupla ligação que ocorre entre os átomos de C no etileno é igual a
a) 186 kJ.mol–1.
b) 599 kJ.mol–1.
c) 692 kJ.mol–1.
d) 736 kJ.mol–1.
02 - (Mackenzie SP/2017)
O estudo cinético de um processo químico foi realizado por meio de um experimento de laboratório, no qual foi analisada a velocidade desse determinado processo em função das concentrações dos reagentes A e B2. Os resultados obtidos nesse estudo encontram-se tabelados abaixo.
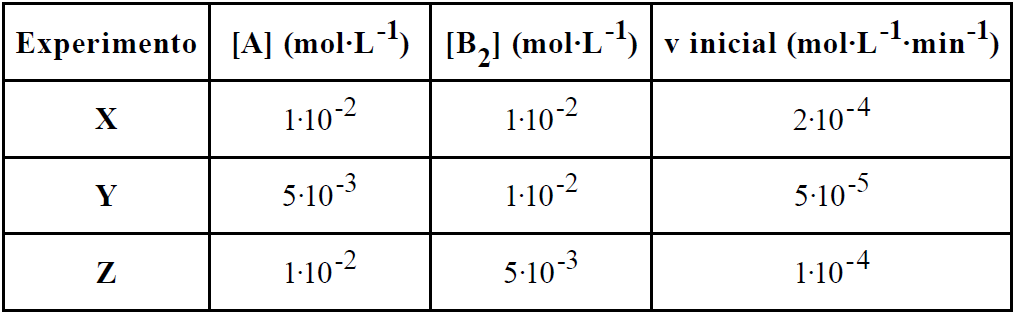
Com base nos resultados obtidos, foram feitas as seguintes afirmativas:
I. As ordens de reação para os reagentes A e B2, respectivamente, são 2 e 1.
II. A equação cinética da velocidade para o processo pode ser representada pela equação v = k![]() [A]2
[A]2![]() [B2].
[B2].
III. A constante cinética da velocidade k tem valor igual a 200.
Considerando-se que todos os experimentos realizados tenham sido feitos sob mesma condição de temperatura, é correto que
a) nenhuma afirmativa é certa.
b) apenas a afirmativa I está certa.
c) apenas as afirmativas I e II estão certas.
d) apenas as afirmativas II e III estão certas.
e) todas as afirmativas estão certas.
03 - (IFBA/2017)
Os gases butano e propano são os principais componentes do gás de cozinha (GLP - Gás Liquefeito de Petróleo). A combustão do butano (C4H10) correspondente à equação:
C4H10 + O2 ![]() CO2 + H2O + Energia
CO2 + H2O + Energia
Se a velocidade da reação for 0,1 mols butano-minuto qual a massa de CO2 produzida em 1 hora?
a) 1.056 g
b) 176 g
c) 17,6 g
d) 132 g
e) 26,4 g
04 - (UNISC RS/2015)
Uma reação química normalmente envolve aspectos energéticos e cinéticos. Interprete o gráfico a seguir, que ilustra uma reação hipotética desenvolvida na presença e na ausência de catalisador e indique a alternativa verdadeira.
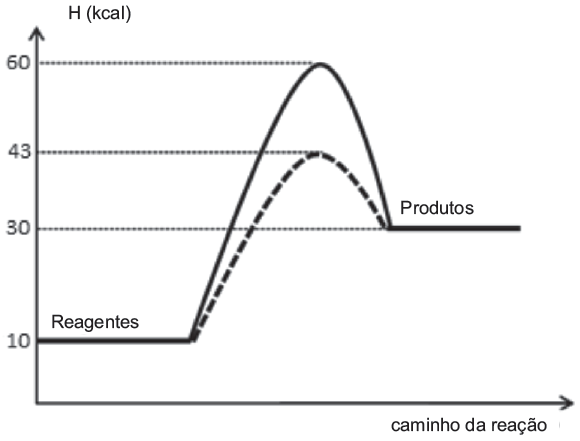
a) A reação é exotérmica com energia de ativação sem o catalisador de 30 Kcal.
b) A reação é endotérmica com energia do complexo ativado sem catalisador de 43 Kcal.
c) A reação apresenta uma energia de ativação de 30 Kcal sem catalisador e 17 Kcal com o catalisador.
d) A reação é endotérmica e tem um ![]() .
.
e) A energia de ativação da reação diminui em 17 Kcal com a utilização do catalisador.
05 - (Uni-FaceF SP/2017)
A substância química eteno (ou etileno) sofre hidrogenação, catalisada por níquel, transformando-se em um etano:
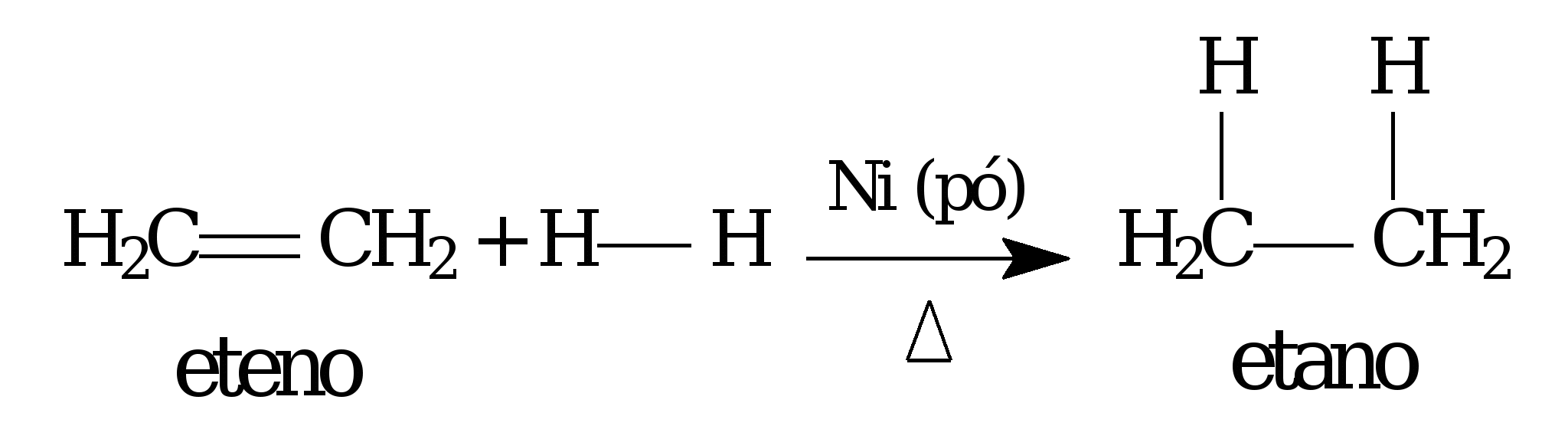
A função do catalisador nessa reação é de
a) reduzir a energia cinética da reação.
b) inibir a reação do eteno com o hidrogênio.
c) reduzir à metade a velocidade de reação.
d) diminuir a quantidade de etano produzido.
e) diminuir a energia de ativação da reação.
06 - (IFSP/2016)
Colocamos um pedaço de palha de aço em cima de uma pia e a seu lado um prego de mesma massa. Notamos que a palha de aço enferruja com relativa rapidez enquanto que o prego, nas mesmas condições, enferrujará mais lentamente. Os dois materiais têm praticamente a mesma composição, mas enferrujam com velocidades diferentes.
Isso ocorre devido a um fator que influencia na velocidade dessa reação, que é:
a) temperatura.
b) concentração dos reagentes.
c) pressão no sistema.
d) superfície de contato.
e) presença de catalisadores.
07 - (PUC SP/2016)
O ânion bromato reage com o ânion brometo em meio ácido gerando a substância simples bromo segundo a equação: BrO3– (aq) + 5 Br– (aq) + 6 H+ (aq) ![]() 3 Br2(aq) + 3 H2O(l)
3 Br2(aq) + 3 H2O(l)
A cinética dessa reação foi estudada a partir do acompanhamento dessa reação a partir de diferentes concentrações iniciais das espécies BrO3– (aq), Br– (aq) e H+ (aq).
Ao analisar esse processo, escreva a lei da velocidade dessa reação.
08 - (UNCISAL/2016)
No processo de Haber-Bosch, a amônia é obtida em alta temperatura e pressão, utilizando ferro como catalisador. Essa amônia tem vasta aplicação como fonte de nitrogênio na fabricação de fertilizante e como gás de refrigeração. Dadas as energias de ligação, H–H![]() 436kJ/mol,N
436kJ/mol,N![]() N
N![]() 944kJ/mol e H–N
944kJ/mol e H–N ![]() 390 kJ/mol, calcule a variação de entalpia para a reação dada: Reação: N2 + 3H2→ 2NH3
390 kJ/mol, calcule a variação de entalpia para a reação dada: Reação: N2 + 3H2→ 2NH3
09 - (Mackenzie SP/2014)
No estudo cinético do processo químico equacionado por
A(g) + B(g) + C(g) ![]() D (g),
D (g),
foram realizados experimentos a uma dada temperatura T, por meio dos quais foram obtidos os dados que se encontram na tabela abaixo:
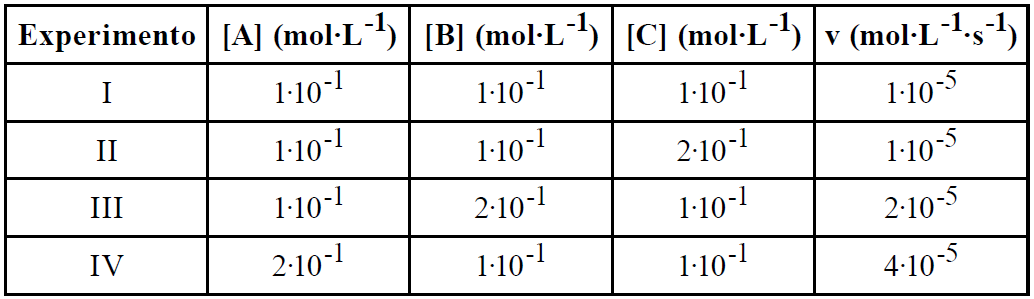
A partir desses dados, foram feitas as seguintes afirmações:
I. Trata-se de um processo de ordem global igual a 3.
II. A expressão da velocidade cinética do processo é dada por v = k[A][B][C].
III. O valor da constante de proporcionalidade k, na temperatura T, é de 0,01.
É correto dizer que
a) apenas I e III são verdadeiras.
b) apenas I e II são verdadeiras.
c) apenas I é verdadeira.
d) apenas II é verdadeira.
e) apenas III é verdadeira.
10 -(UNIUBE MG/2014)
No estudo das velocidades das reações, conceitua-se a ordem de reação como a soma dos expoentes aos quais estão elevadas as concentrações na expressão de velocidade, não sendo associada aos coeficientes da reação. Qualquer hipótese levantada sobre uma reação química em nível molecular deverá, obrigatoriamente, concordar com a lei de velocidade, pois ela é proposta única e exclusivamente com base em dados experimentais. Imagine que um grupo de estudantes queira determinar a ordem de reação para os reagentes da reação entre gás oxigênio e monóxido de nitrogênio, formando dióxido de nitrogênio, representada abaixo.
O2(g) + 2 NO(g) ![]() 2 NO2(g) V = K.[O2]a.[NO]b
2 NO2(g) V = K.[O2]a.[NO]b
Para a determinação dos valores de “a” e “b”, os alunos realizaram 4 experimentos cujos dados são mostrados na tabela abaixo.
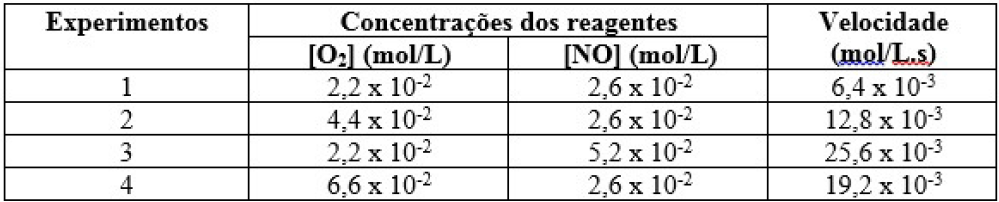
De acordo com as informações dadas e os conceitos sobre cinética química, a ordem de reação em relação ao O2, NO e a expressão da velocidade para a reação são, respectivamente:
a) 1; 1 e V = K.[O2].[NO]
b) 2; 1 e V = K.[O2]2.[NO]
c) 2; 2 e V = K.[O2]2.[NO]2
d) 1; 1 e V = K.[O2]2.[NO]2
e) 1; 2 e V = K.[O2].[NO]2
11 - (MACK SP)
O gás propano é um dos integrantes do GLP (gás liquefeito de petróleo) e, desta forma, é um gás altamente inflamável.
Abaixo está representada a equação química NÃO BALANCEADA de combustão completa do gás propano.
C3H8(g) + O2(g) → CO2(g) + H2O(v)
Na tabela, são fornecidos os valores das energias de ligação, todos nas mesmas condições de pressão e temperatura da combustão.

Assim, a variação de entalpia da reação de combustão de um mol de gás propano será igual a
a) – 1670 kJ. b) – 6490 kJ. c) + 1670 kJ. d) – 4160 kJ. e) + 4160 kJ.
12 - (UESPI)
Os clorofluorcarbono (CFCs) são usados extensivamente em aerosóis, ar-condicionado, refrigeradores e solventes de limpeza. Os dois principais tipos de CFCs são o triclorofluorcarbono (CFCl3) ou CFC-11 e diclorodifluormetano (CF2Cl2) ou CFC-12. O triclorofluorcarbono é usado em aerosóis, enquanto que o diclorodifluormetano é tipicamente usado em refrigeradores. Determine o H para a reação de formação do CF2Cl2:
CH4(g) + 2Cl2(g) + 2F2(g) CF2Cl2(g) + 2HF(g) + 2HCl(g)
Dados de energia de ligação em kJ/mol: C-H (413); Cl-Cl (239); F-F (154); C-F (485); C-Cl (339); H-F (565); H-Cl (427).
a) – 234 kJ b) – 597 kJ c) – 1194 Kj d) – 2388 kJ e) – 3582 kJ
13 - (UEG GO)
Baseado na tabela contendo valores de entalpias de ligação acima, o calor liberado em kJ.mol–1, na reação de combustão completa do butano em fase gasosa, seria:
a) 1970 b) 2264 c) 4180 d) 5410
14 - (UEL PR/2014)
O processo de remoção de enxofre em refinarias de petróleo é uma prática que vem sendo cada vez mais realizada com o intuito de diminuir as emissões de dióxido de enxofre de veículos automotivos e o grau de envenenamento de catalisadores utilizados. A dessulfurização é um processo catalítico amplamente empregado para a remoção de compostos de enxofre, o qual consiste basicamente na inserção de hidrogênio.
A reação química do composto etanotiol é mostrada a seguir.
C2H5SH(g) + H2(g) C2H6(g) + H2S(g)
Suponha que a reação de dessulfurização seja realizada em laboratório, na presença de concentrações diferentes de etanotiol e hidrogênio, conforme quadro a seguir.
Com base nos dados apresentados nessa tabela, determine a lei da velocidade e a ordem da reação.
15 - (Unimontes MG)
A velocidade da reação genérica 2A + B C é dada por V1 = k [A]2.[B]1. Em uma determinada situação, a concentração de A foi triplicada, e a de B duplicada. O novo valor de velocidade (V2), em função de V1, será:
a) igual a V1. b) 18 vezes maior. c) 2 vezes maior. d) 18 vezes menor.
16 - (UFPA)
Os resultados de três experimentos, feitos para encontrar a lei de velocidade para a reação: 2 NO(g) + 2 H2(g) N2(g) + 2 H2O(g), encontram-se na Tabela abaixo.
Tabela 1 – Velocidade inicial de consumo de NO(g)
De acordo com esses resultados, é correto concluir que a equação de velocidade é
a)v = k [NO] [H2]2b)v = k [NO]2[H2]2c)v = k [NO]2[H2]
d)v = k [NO]4[H2]2e)v = k [NO]1/2[H2]
17 - (UFT TO)
Considere a equação para a reação de obtenção do dióxido de nitrogênio:
2NO(g) + O2(g) 2NO2(g)
A tabela a seguir apresenta dados obtidos experimentalmente para determinação da cinética de reação do dióxido de nitrogênio à temperatura de 400ºC.
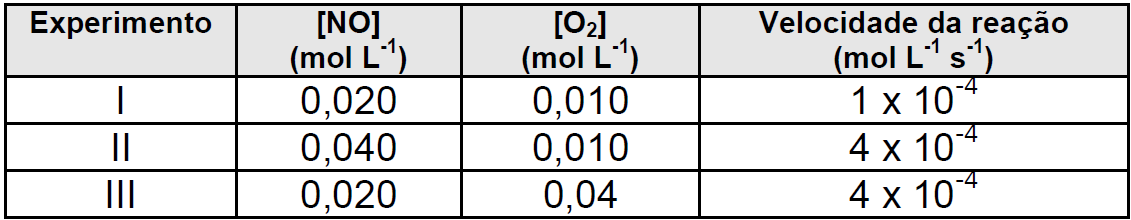
A ordem global da reação é:
-
4 b) 3 c) 2 d) 1 e) 0
18 - (FATEC SP/2014)
Uma indústria necessita conhecer a mecânica das reações para poder otimizar sua produção.
O gráfico representa o mecanismo de uma reação hipotética:
A2 + B2 2 AB
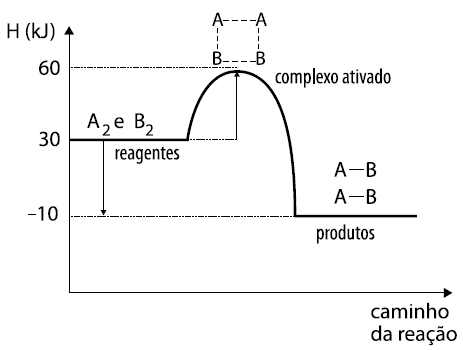
A análise do gráfico permite concluir corretamente que
a) temos uma reação endotérmica, pois apresenta H = –10 kJ.
b) temos uma reação exotérmica, pois apresenta H = +10 kJ.
c) a energia do complexo ativado é 30 kJ.
d) a energia de ativação para a reação direta é 30 kJ.
e) a energia de ativação para a reação inversa é 40 kJ.
19 - (UEG GO)
Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos que serão formados.
O gráfico abaixo representa um diagrama de variação de energia de uma reação química hipotética em que a mistura dos reagentes A e B levam à formação dos produtos C e D.
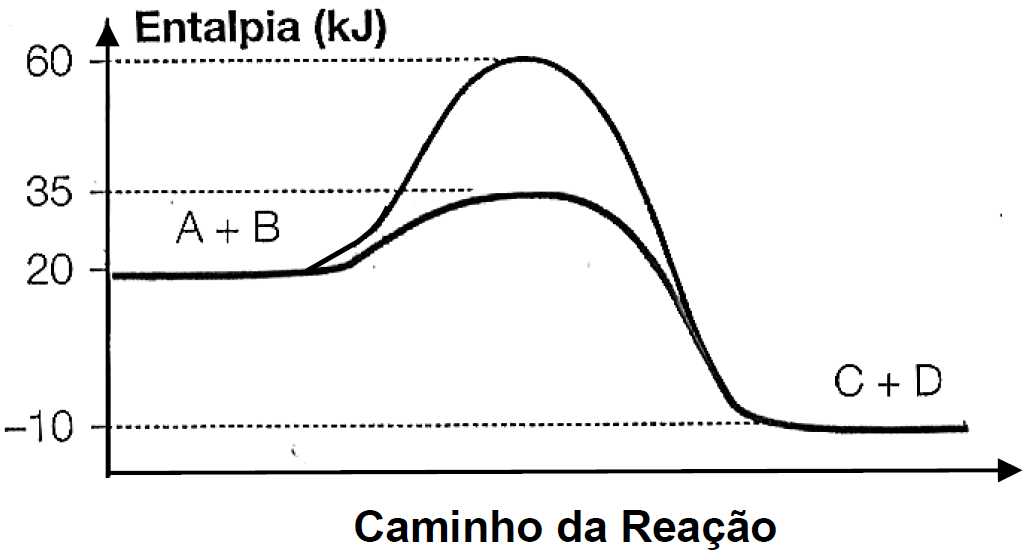
Com base no diagrama, no sentido direto da reação, conclui-se que a
a) energia de ativação da reação sem o catalisador é igual a 15kJ.
b) energia de ativação da reação com o catalisador é igual a 40kJ.
c) reação é endotérmica.
d) variação de entalpia da reação é igual a -30kJ.
20 - (UFG GO)
A reação química descreve a transformação do composto A em um complexo ativado intermediário que, por sua vez, forma o composto B.
![]()
O gráfico a seguir apresenta a relação entre a energia e o caminho da reação.
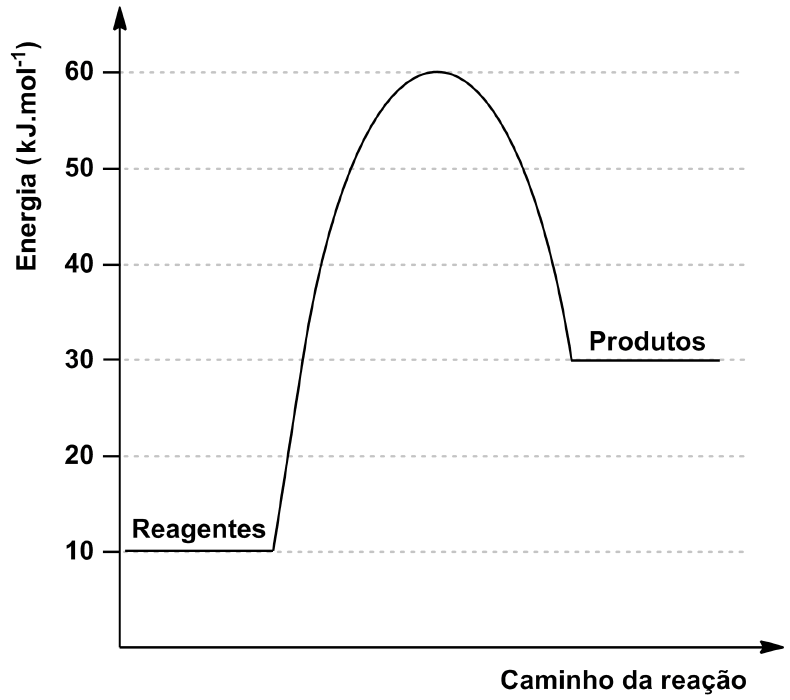
Considerando o exposto,
a) calcule a energia de ativação e a variação de entalpia (DH) da reação.
b) esboce um gráfico entre a energia e o caminho da reação inversa.
21 - (UNESP SP)
O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador.
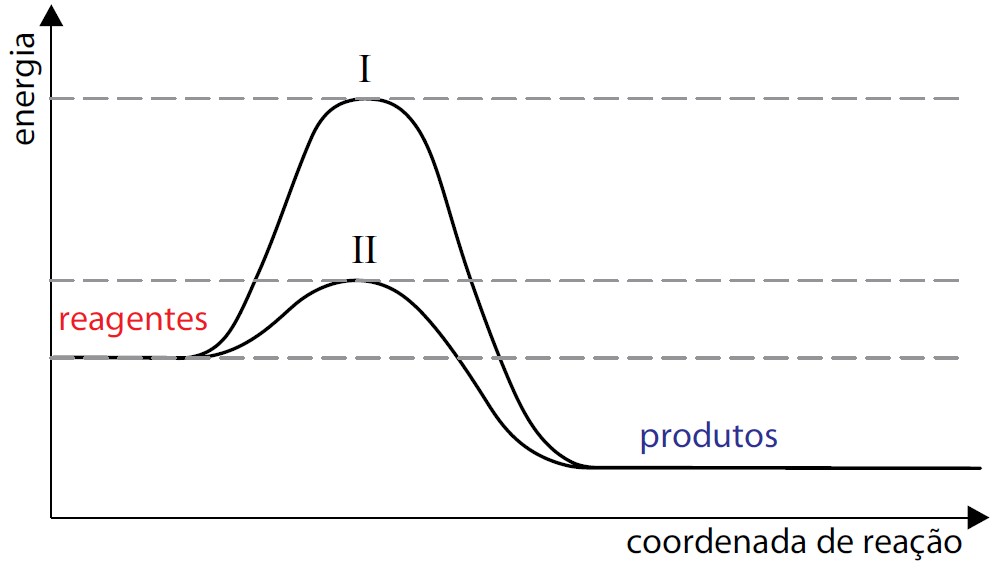
Com base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador.
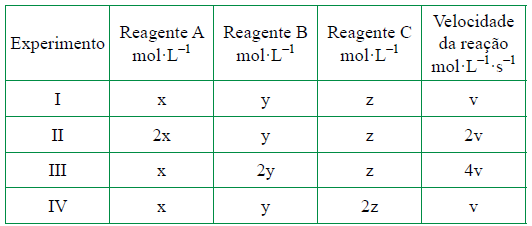
22 - (FGV SP/2014)
Para otimizar as condições de um processo industrial que depende de uma reação de soluções aquosas de três diferentes reagentes para a formação de um produto: A + 3 B + 2 C Produtos, o mestre Pifer realizou um experimento que consistiu em uma série de reações nas mesmas condições de temperatura e agitação. Os resultados são apresentados na tabela:Após a realização dos experimentos , qual a equação da velocidade encontrada pelo nosso mestre?
23 - (UEG GO/2014)
O mestre Gerson, (também escritor de poemas ) , resolveu estudar a formação e a quebra das ligações químicas que é de grande importância para prever a estabilidade dos produtos que serão formados no curso de uma reação química. Portanto, a partir do conhecimento das energias de ligação presentes nos reagentes e produtos, pode-se estimar a variação de energia total envolvida na reação química. Um exemplo é a reação de hidrogenação do eteno, cuja equação química e cujas energias de ligação são apresentadas a seguir.
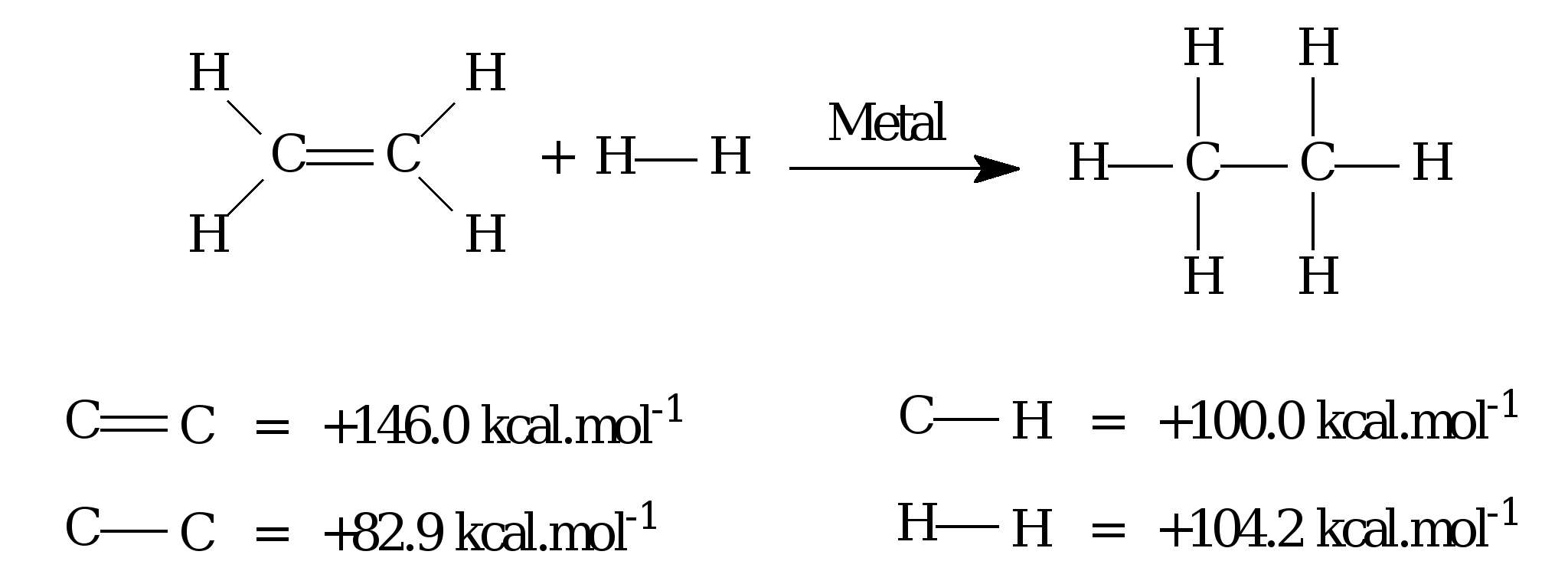
Considerando-se as informações apresentadas, calcule a variação da energia (ΔH) em kcal.mol–1 envolvida na reação .
24 - (UCB DF/2017)
Medicamentos e alimentos perecíveis são comercializados com datas de validade, isto é, com um marco limite de consumo daquele material, de modo a não produzir nenhum efeito nocivo à saúde do consumidor. Essas datas de validade são produzidas por modelos associados à cinética química.
Acerca das velocidades das reações químicas e os respectivos modelos, assinale a alternativa correta.
a) Reagentes com maior superfície de contato tendem a reagir mais rapidamente, quando comparados àqueles de menor superfície de contato.
b) Todos os choques entre reagentes levam a reações.
c) A diminuição da temperatura abaixa a energia de ativação das reações, reduzindo a velocidade das reações.
d) Um alimento perecível pode ser armazenado por um tempo indefinido no freezer doméstico, sem perder as respectivas propriedades.
e) Um medicamento pode ter a respectiva data de validade aumentada, se tal material for acondicionado em lugar com temperatura elevada.
GABARITO:
1) B 2) E 3) A 4) E 5) E 6) D 7) V = K [BrO-3]1 [Br-]1 [H+]28) – 88Kj
9) A 10) E11) A 12) C 13) B 14) v = k [Etanotiol] [H2] e a ordem da reação é 2.
15) B 16) C 17) B 18) D 19) D
20) DHAtivação = +50 kJ/mol DHReação = +20 kJ/mol
21) A curva II representa a reação na presença de catalisador, pois houve diminuição da energia de ativação. A variação de entalpia é a mesma na presença e na ausência de um catalisador.
22) V = k [A]1[B]2 23) – 32,7 kJ 24) A

![2018-10-06 15_46_44-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE [Modo de Compatibilidade] - Word](http://quimicaevestibular.com.br/wp-content/uploads/2018/10/2018-10-06-15_46_44-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE-Modo-de-Compatibilidade-Word.png)
![2018-10-06 15_48_27-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE [Modo de Compatibilidade] - Word](http://quimicaevestibular.com.br/wp-content/uploads/2018/10/2018-10-06-15_48_27-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE-Modo-de-Compatibilidade-Word.png)
![2018-10-06 15_48_59-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE [Modo de Compatibilidade] - Word](http://quimicaevestibular.com.br/wp-content/uploads/2018/10/2018-10-06-15_48_59-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE-Modo-de-Compatibilidade-Word.png)
![2018-10-06 15_49_31-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE [Modo de Compatibilidade] - Word](http://quimicaevestibular.com.br/wp-content/uploads/2018/10/2018-10-06-15_49_31-LISTA-03-2EM-2018-RESOLVIDA-COMENTADA-SITE-Modo-de-Compatibilidade-Word.png)
