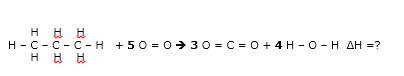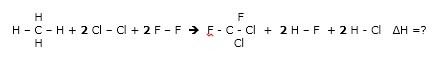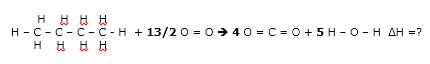Lista de exercícios–Química – prof. Raimundo. 3º. Trimestre - 2º. Ens. Médio 2019
- Cinética Química
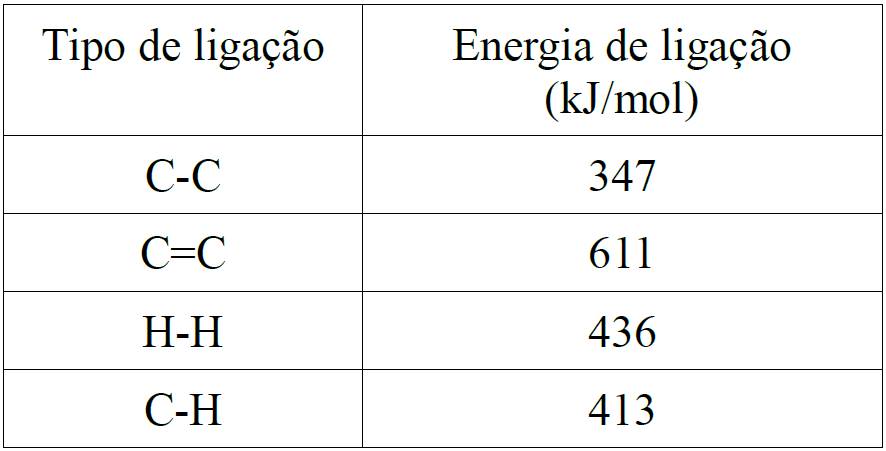
- Termoquímica – Energia de Ligação
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
A resolução comentada está no final da lista
01 - (UNITAU SP/2019)
O gás propano pode ser obtido pela hidrogenação do propeno. Assinale a alternativa com o valor CORRETO da entalpia de reação, e a classificação da reação como endotérmica ou exotérmica.
Dados:
a)![]() kJ/mol; reação endotérmica
kJ/mol; reação endotérmica
b)![]() kJ/mol; reação exotérmica
kJ/mol; reação exotérmica
c)![]() kJ/mol; reação exotérmica
kJ/mol; reação exotérmica
d)![]() kJ/mol; reação endotérmica
kJ/mol; reação endotérmica
e)![]() kJ/mol; reação exotérmica
kJ/mol; reação exotérmica
02 - (Unioeste PR/2019)
Os organoclorados são poluentes considerados perigosos, mas, infelizmente, têm sido encontradas quantidades significativas destas substâncias em rios e lagos. Uma reação de cloração comumente estudada é a do etano com o gás cloro, como mostrada abaixo:
C2H6 (g) + Cl2(g) ![]() CH3CH2Cl(g) + HCl(g)
CH3CH2Cl(g) + HCl(g)
Sabendo os valores de ![]() de cada ligação (Tabela abaixo), determine o valor de
de cada ligação (Tabela abaixo), determine o valor de ![]() da reação pelo método das energias de ligação.
da reação pelo método das energias de ligação.
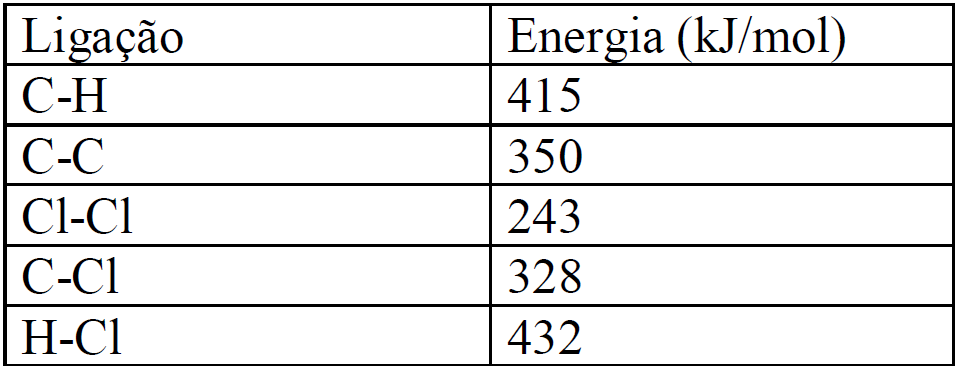
a)–102 kJ/mol
b)+102 kJ/mol
c)+367 kJ/mol
d)–367 kJ/mol
e)+17 kJ/mol
03 - (UECE/2018)
Através da eletrólise, houve a decomposição da água em hidrogênio e oxigênio. Considerando-se os seguintes valores de energia de ligação para as várias substâncias envolvidas no processo: E(H – H) = 104,30 kcal/mol; E (O = O) = 119,13 kcal/mol e E(O – H) = 111,72 kcal/mol, é correto afirmar que o valor da variação de entalpia da reação descrita acima, em kcal/mol, é aproximadamente
a)80,0.
b)120,0.
c)60,0.
d)90,0.
04 - (PUC RS/2019)
O peróxido de hidrogênio (H2O2) é um composto utilizado em várias áreas (industrialização de alimentos e de medicamentos, tratamento de efluentes e controle ambiental). Apesar de sua grande reatividade, o peróxido de hidrogênio é um metabólito natural em muitos organismos, participando de inúmeras reações biológicas. Quando decomposto, resulta em oxigênio molecular e água, segundo a equação química 2 H2O2(aq) ![]() 2 H2O(l) + O2(g) . Ao monitorar-se a decomposição de uma solução de H2O2 em função do tempo, a 20ºC, foram obtidos os seguintes dados:
2 H2O(l) + O2(g) . Ao monitorar-se a decomposição de uma solução de H2O2 em função do tempo, a 20ºC, foram obtidos os seguintes dados:
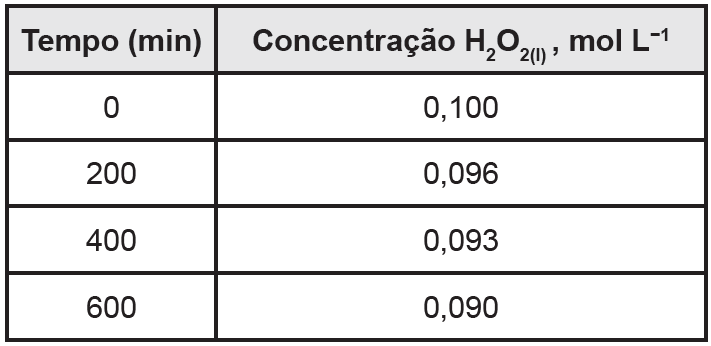
Com base nos dados da tabela, podemos concluir que, nos 200 min iniciais de reação, a velocidade de desaparecimento de H2O2 (mol L–1 min–1) será de aproximadamente
a)0,004
b)0,096
c)1![]() 10–5
10–5
d)2![]() 10–5
10–5
05 - (UEPG PR/2019)
Os dados da tabela a seguir referem-se ao processo químico:
A + B + C ![]() X
X
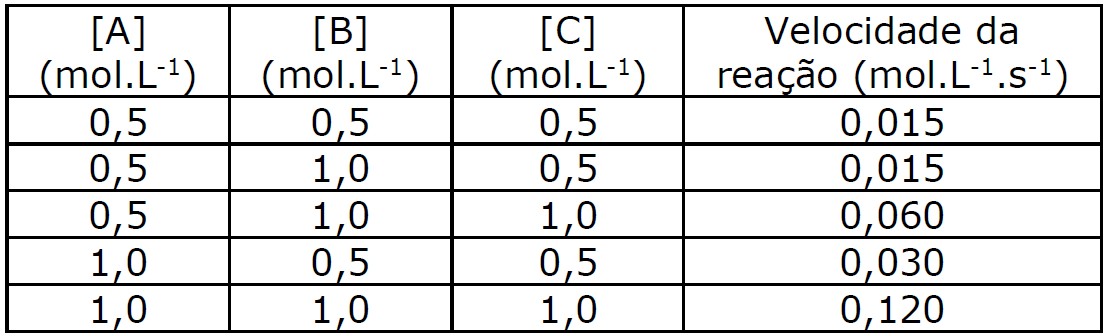
Diante do exposto, assinale o que for correto.
01. A equação da velocidade da reação é v = k[A][C]2.
02. A velocidade da reação é independente da concentração de B.
04. A constante da velocidade da reação é 0,12 L2.s–1.mol–2.
08. O aumento da temperatura aumenta a velocidade da reação.
16. A adição de um catalisador promove o aumento da velocidade da reação, porque o catalisador aumenta a energia de ativação da reação.
06 - (Mackenzie SP/2018)
O processo equacionado por NO(g) + O3(g) ![]() NO2(g) + O2(g) é classificado, em termos cinéticos, como elementar e de segunda ordem. Desse modo, ao serem feitos dois experimentos, ambos sob determinada temperatura “T”, ao duplicar-se tanto a concentração do NO(g) como do O3(g) em relação ao primeiro experimento, o segundo experimento terá sua velocidade
NO2(g) + O2(g) é classificado, em termos cinéticos, como elementar e de segunda ordem. Desse modo, ao serem feitos dois experimentos, ambos sob determinada temperatura “T”, ao duplicar-se tanto a concentração do NO(g) como do O3(g) em relação ao primeiro experimento, o segundo experimento terá sua velocidade
a)reduzida a um quarto.
b)reduzida à metade.
c)mantida constante.
d)duplicada.
e)quadruplicada.
07 - (Fac. Direito de São Bernardo do Campo SP/2018)
Considere a reação hipotética representada a seguir:
A2(g) + 2 BC(g) ![]() B2(g) + 2 AC(g)
B2(g) + 2 AC(g)
A tabela abaixo apresenta os valores experimentais de velocidade inicial da reação medidos em diferentes concentrações dos reagentes. Nestes experimentos a única variável foi a concentração dos reagentes.
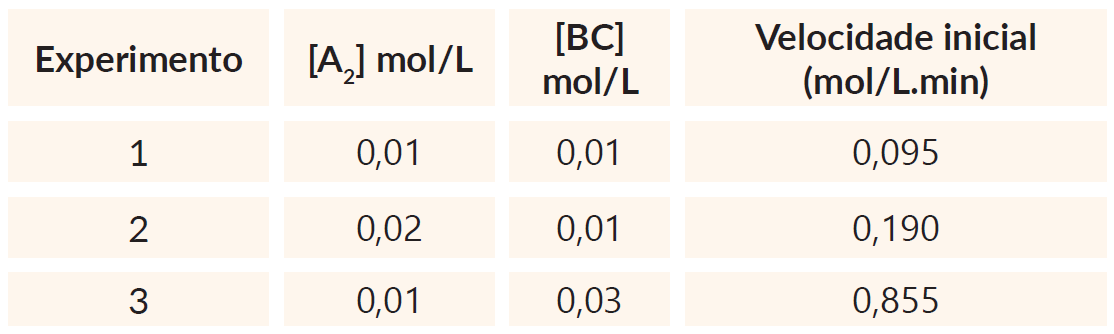
Com base nos dados ao lado, é correto afirmar que a expressão de velocidade para a reação é:
a)v = k. [A2]. [BC]
b)v = k. [A2]2. [BC]
c)v = k. [A2]2. [BC]3
d)v = k. [A2]. [BC]2
08 - (UFPR/2019)
O níquel é empregado na indústria como catalisador de diversas reações, como na reação de reforma do etileno glicol, que produz hidrogênio a ser utilizado como combustível. O processo ocorre num tempo muito menor quando é utilizado 1 g de níquel em uma forma porosa desse material, em comparação à reação utilizando uma única peça cúbica de 1 g de níquel. Abaixo está esquematizada a equação de reforma do etileno glicol e em seguida uma imagem de microscopia eletrônica de uma amostra de níquel na forma porosa.
C2H6O2 + H2O ![]() 2CO2 + 5H2
2CO2 + 5H2

(Fonte da imagem: Zhu, L-J. et alii. An environmentally benign and catalytically efficient non-pyrophoric Ni catalyst for aqueous-phase reforming of ethylene glycol. Green Chem., 2008, 10, 1323-1330. Adaptado.)
Nas condições mencionadas, a reação de reforma ocorre num tempo menor quando usado o níquel poroso porque:
a)a temperatura local é maior.
b)outra via de reação é favorecida.
c)a concentração dos reagentes é maior.
d)a área superficial do catalisador é maior.
e)a pressão parcial das espécies gasosas é maior.
9 - (PUC SP/2017)
A reação de hidrogenação do etileno ocorre com aquecimento, na presença de níquel em pó como catalisador. A equação termoquímica que representa o processo é
C2H4(g) + H2(g) ![]() C2H6(g)
C2H6(g) ![]() = –137 kJ.mol–1
= –137 kJ.mol–1
Dado:
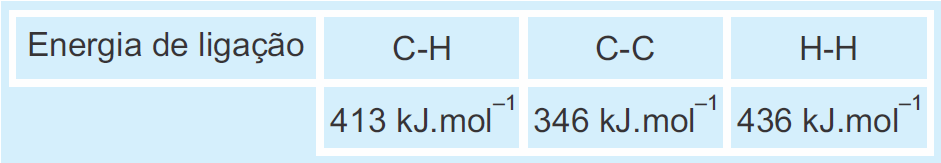
A partir dessas informações, pode-se deduzir que a energia de ligação da dupla ligação que ocorre entre os átomos de C no etileno é igual a
a) 186 kJ.mol–1. b) 599 kJ.mol–1. c) 692 kJ.mol–1. d) 736 kJ.mol–1.
10 - (Mackenzie SP/2017)
O estudo cinético de um processo químico foi realizado por meio de um experimento de laboratório, no qual foi analisada a velocidade desse determinado processo em função das concentrações dos reagentes A e B2. Os resultados obtidos nesse estudo encontram-se tabelados abaixo.
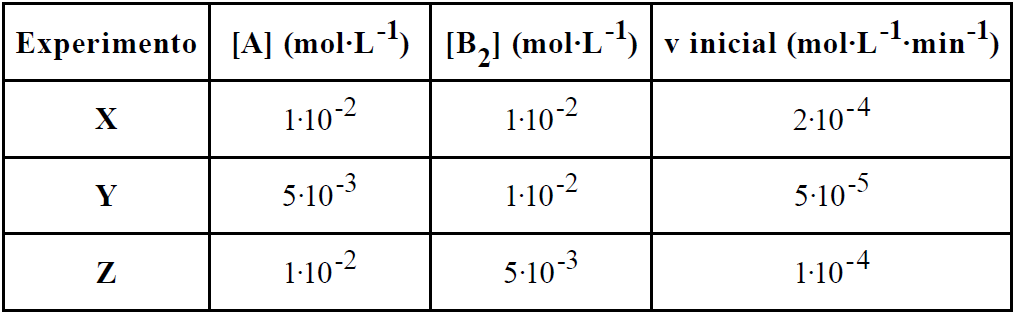
Com base nos resultados obtidos, foram feitas as seguintes afirmativas:
I. As ordens de reação para os reagentes A e B2, respectivamente, são 2 e 1.
II. A equação cinética da velocidade para o processo pode ser representada pela equação v = k![]() [A]2
[A]2![]() [B2].
[B2].
III. A constante cinética da velocidade k tem valor igual a 200.
Considerando-se que todos os experimentos realizados tenham sido feitos sob mesma condição de temperatura, é correto que
a) nenhuma afirmativa é certa.
b) apenas a afirmativa I está certa.
c) apenas as afirmativas I e II estão certas.
d) apenas as afirmativas II e III estão certas.
e) todas as afirmativas estão certas.
11 - (IFBA/2017)
Os gases butano e propano são os principais componentes do gás de cozinha (GLP - Gás Liquefeito de Petróleo). A combustão do butano (C4H10) correspondente à equação:
C4H10 + O2 ![]() CO2 + H2O + Energia
CO2 + H2O + Energia
Se a velocidade da reação for 0,1 mols butano-minuto qual a massa de CO2 produzida em 1 hora?
a) 1.056 g
b) 176 g
c) 17,6 g
d) 132 g
e) 26,4 g
12 - (UNISC RS/2015)
Uma reação química normalmente envolve aspectos energéticos e cinéticos. Interprete o gráfico a seguir, que ilustra uma reação hipotética desenvolvida na presença e na ausência de catalisador e indique a alternativa verdadeira.
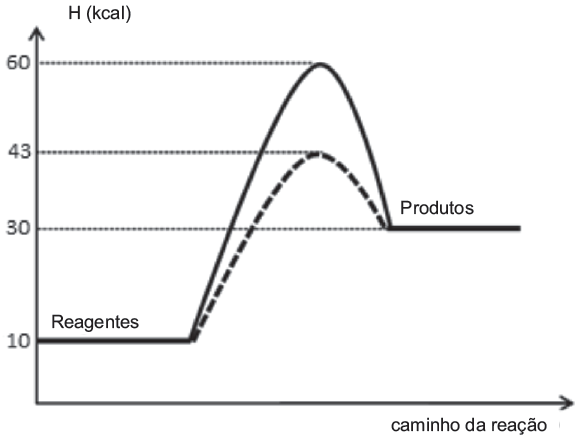
a) A reação é exotérmica com energia de ativação sem o catalisador de 30 Kcal.
b) A reação é endotérmica com energia do complexo ativado sem catalisador de 43 Kcal.
c) A reação apresenta uma energia de ativação de 30 Kcal sem catalisador e 17 Kcal com o catalisador.
d) A reação é endotérmica e tem um ![]() .
.
e) A energia de ativação da reação diminui em 17 Kcal com a utilização do catalisador.
13 - (Uni-FaceF SP/2017)
A substância química eteno (ou etileno) sofre hidrogenação, catalisada por níquel, transformando-se em um etano:
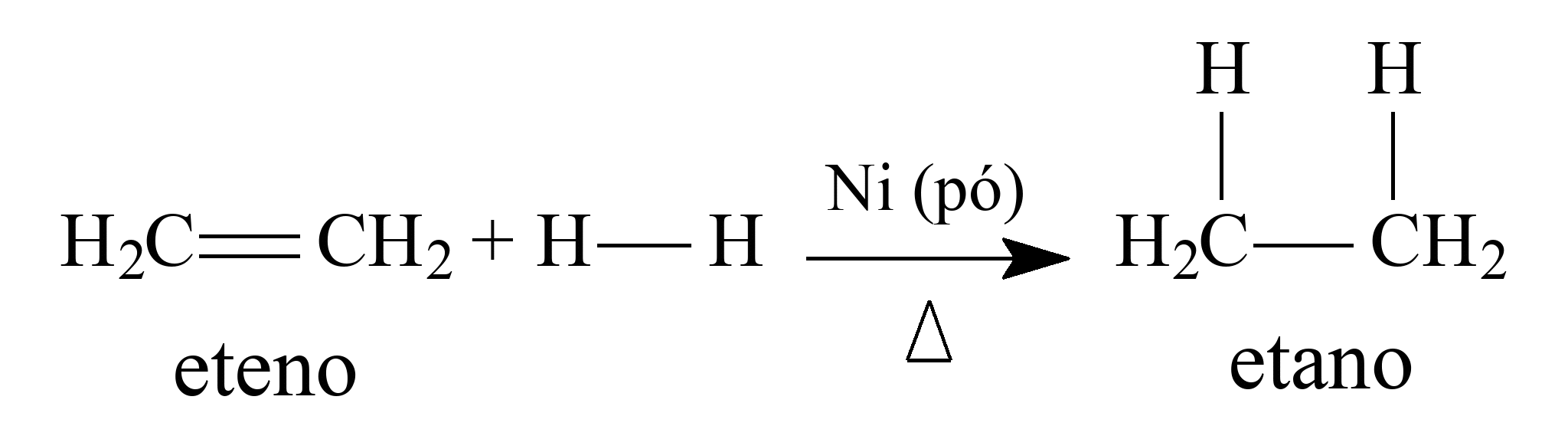
A função do catalisador nessa reação é de
a) reduzir a energia cinética da reação.
b) inibir a reação do eteno com o hidrogênio.
c) reduzir à metade a velocidade de reação.
d) diminuir a quantidade de etano produzido.
e) diminuir a energia de ativação da reação.
14 - (IFSP/2016)
Colocamos um pedaço de palha de aço em cima de uma pia e a seu lado um prego de mesma massa. Notamos que a palha de aço enferruja com relativa rapidez enquanto que o prego, nas mesmas condições, enferrujará mais lentamente. Os dois materiais têm praticamente a mesma composição, mas enferrujam com velocidades diferentes.
Isso ocorre devido a um fator que influencia na velocidade dessa reação, que é:
a) temperatura.
b) concentração dos reagentes.
c) pressão no sistema.
d) superfície de contato.
e) presença de catalisadores.
15 - (PUC SP/2016)
O ânion bromato reage com o ânion brometo em meio ácido gerando a substância simples bromo segundo a equação: BrO3– (aq) + 5 Br– (aq) + 6 H+ (aq) ![]() 3 Br2(aq) + 3 H2O(l)
3 Br2(aq) + 3 H2O(l)
A cinética dessa reação foi estudada a partir do acompanhamento dessa reação a partir de diferentes concentrações iniciais das espécies BrO3– (aq), Br– (aq) e H+ (aq).
Ao analisar esse processo, escreva a lei da velocidade dessa reação.
velocidade
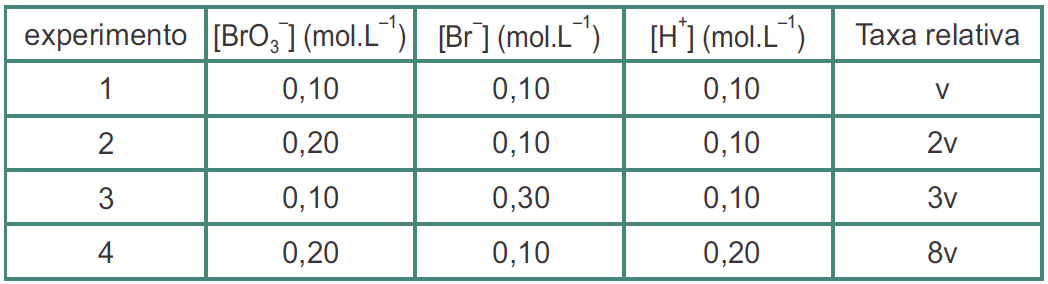
16 - (UNCISAL/2016)
No processo de Haber-Bosch, a amônia é obtida em alta temperatura e pressão, utilizando ferro como catalisador. Essa amônia tem vasta aplicação como fonte de nitrogênio na fabricação de fertilizante e como gás de refrigeração. Dadas as energias de ligação, H–H![]() 436kJ/mol, N
436kJ/mol, N![]() N
N![]() 944kJ/mol e H–N
944kJ/mol e H–N ![]() 390 kJ/mol, calcule a variação de entalpia para a reação dada: Reação: N2 + 3H2→ 2NH3
390 kJ/mol, calcule a variação de entalpia para a reação dada: Reação: N2 + 3H2→ 2NH3
17 - (MACK SP)
O gás propano é um dos integrantes do GLP (gás liquefeito de petróleo) e, desta forma, é um gás altamente inflamável.
Abaixo está representada a equação química NÃO BALANCEADA de combustão completa do gás propano.
C3H8(g) + O2(g) ® CO2(g) + H2O(v)
Na tabela, são fornecidos os valores das energias de ligação, todos nas mesmas condições de pressão e temperatura da combustão.

Assim, a variação de entalpia da reação de combustão de um mol de gás propano será igual a
a) – 1670 kJ. b) – 6490 kJ. c) + 1670 kJ. d) – 4160 kJ. e) + 4160 kJ.
18 - (UESPI)
Os clorofluorcarbono (CFCs) são usados extensivamente em aerosóis, ar-condicionado, refrigeradores e solventes de limpeza. Os dois principais tipos de CFCs são o triclorofluorcarbono (CFCl3) ou CFC-11 e diclorodifluormetano (CF2Cl2) ou CFC-12. O triclorofluorcarbono é usado em aerosóis, enquanto que o diclorodifluormetano é tipicamente usado em refrigeradores. Determine o H para a reação de formação do CF2Cl2:
CH4(g) + 2Cl2(g) + 2F2(g) CF2Cl2(g) + 2HF(g) + 2HCl(g)
Dados de energia de ligação em kJ/mol: C-H (413); Cl-Cl (239); F-F (154); C-F (485); C-Cl (339); H-F (565); H-Cl (427).
a) – 234 kJ b) – 597 kJ c) – 1194 Kj d) – 2388 kJ e) – 3582 kJ
19 - (UEG GO)

Baseado na tabela contendo valores de entalpias de ligação acima, o calor liberado em kJ.mol–1, na reação de combustão completa do butano em fase gasosa, seria:
a) 1970 b) 2264 c) 4180 d) 5410
20 - (Unimontes MG/2013)
A velocidade da reação genérica 2A + B C é dada por V1 = k [A]2.[B]1. Em uma determinada situação, a concentração de A foi triplicada, e a de B duplicada. O novo valor de velocidade (V2), em função de V1, será:
a) igual a V1. b) 18 vezes maior. c) 2 vezes maior. d) 18 vezes menor.
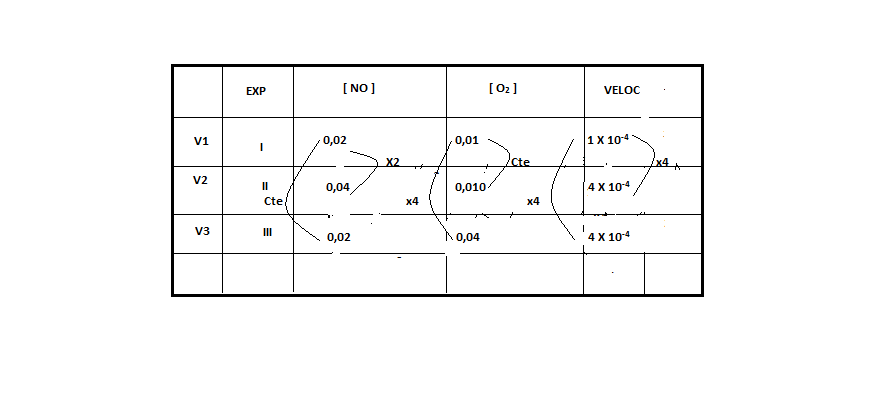
21 - (UFT TO)
Considere a equação para a reação de obtenção do dióxido de nitrogênio:
2NO(g) + O2(g) 2NO2(g)
A tabela a seguir apresenta dados obtidos experimentalmente para determinação da cinética de reação do dióxido de nitrogênio à temperatura de 400ºC.
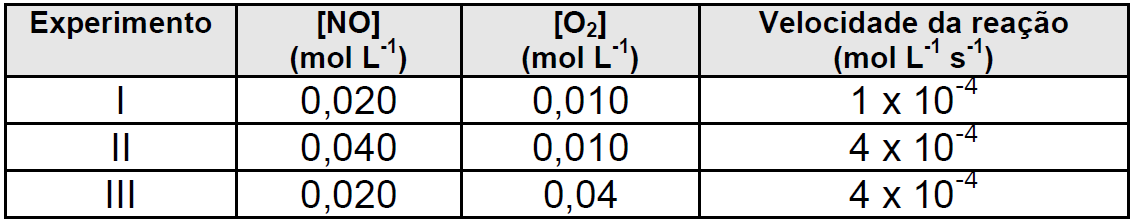
A ordem global da reação é:
-
4 b) 3 c) 2 d) 1 e) 0
22 - (FATEC SP/2014)
Uma indústria necessita conhecer a mecânica das reações para poder otimizar sua produção.
O gráfico representa o mecanismo de uma reação hipotética:
A2 + B2 2 AB
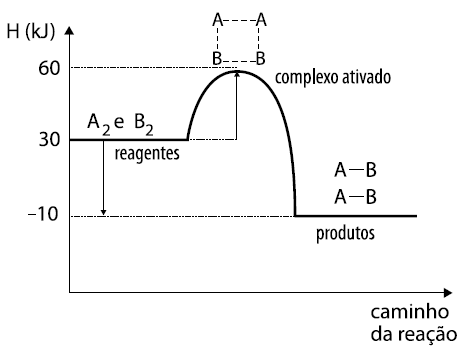
A análise do gráfico permite concluir corretamente que
a)temos uma reação endotérmica, pois apresenta H = –10 kJ.
b)temos uma reação exotérmica, pois apresenta H = +10 kJ.
c)a energia do complexo ativado é 30 kJ.
d)a energia de ativação para a reação direta é 30 kJ.
e)a energia de ativação para a reação inversa é 40 kJ.
23 - (UEG GO )
Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos que serão formados.
O gráfico abaixo representa um diagrama de variação de energia de uma reação química hipotética em que a mistura dos reagentes A e B levam à formação dos produtos C e D.
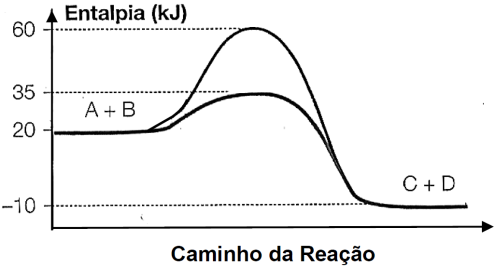
Com base no diagrama, no sentido direto da reação, conclui-se que a
a)energia de ativação da reação sem o catalisador é igual a 15kJ.
b)energia de ativação da reação com o catalisador é igual a 40kJ.
c)reação é endotérmica.
d)variação de entalpia da reação é igual a -30kJ.
24 - (UFG GO)
A reação química descreve a transformação do composto A em um complexo ativado intermediário que, por sua vez, forma o composto B.
![]()
O gráfico a seguir apresenta a relação entre a energia e o caminho da reação.
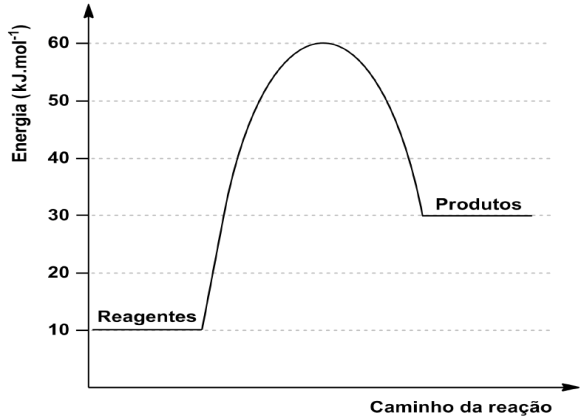
Considerando o exposto,
calcule a energia de ativação e a variação de entalpia (DH) da reação.
25 - (UNESP SP )
O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador.
C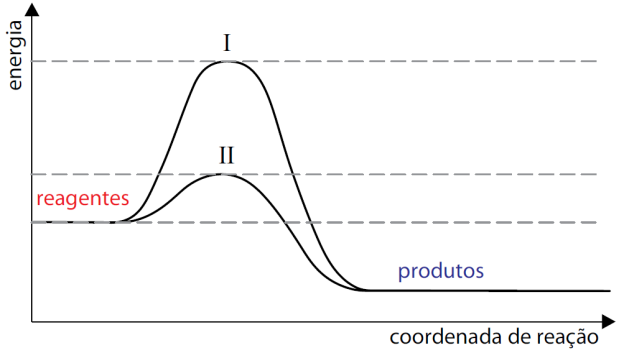 om base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador.
om base no esquema, responda qual a curva que representa a reação na presença de catalisador. Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e na presença do catalisador.
26 - (UEG GO/2014)
O mestre GERSON, (também escritor de poemas ) , resolveu estudar a formação e a quebra das ligações químicas que é de grande importância para prever a estabilidade dos produtos que serão formados no curso de uma reação química. Portanto, a partir do conhecimento das energias de ligação presentes nos reagentes e produtos, pode-se estimar a variação de energia total envolvida na reação química. Um exemplo é a reação de hidrogenação do eteno, cuja equação química e cujas energias de ligação são apresentadas a seguir.
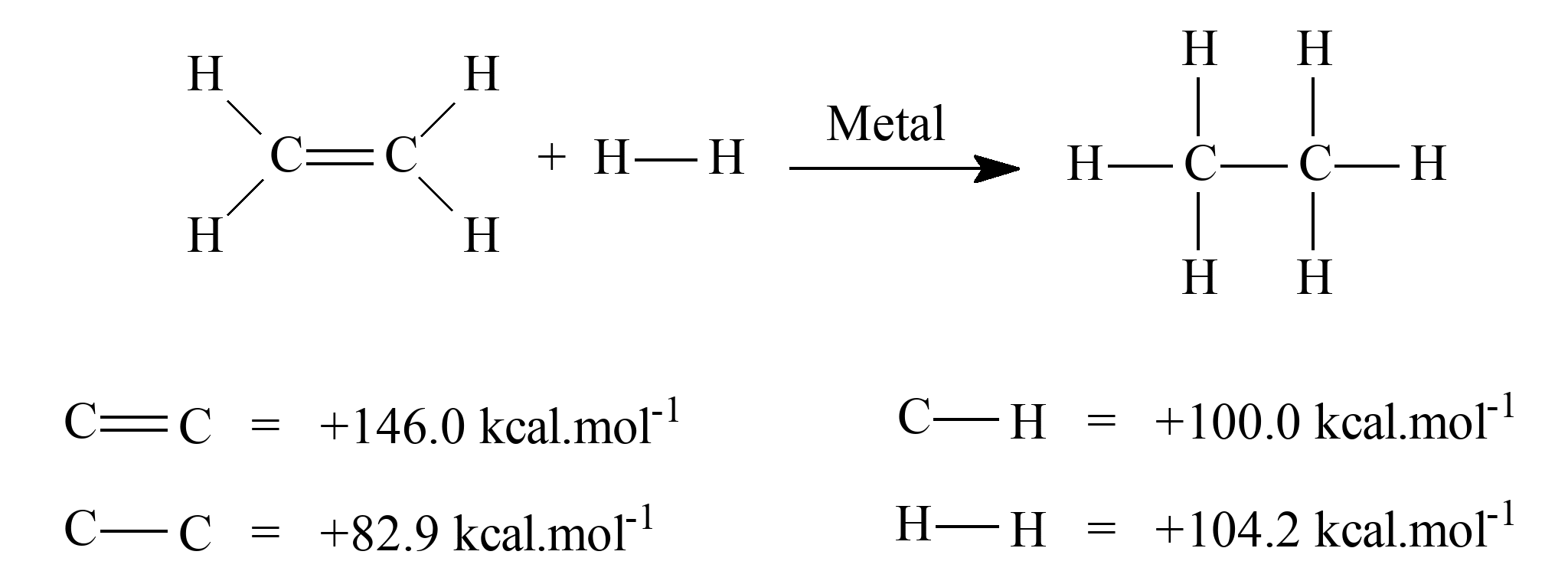
Considerando-se as informações apresentadas, calcule a variação da energia (ΔH) em kcal.mol–1 envolvida na reação .
GABARITO:
1-B 2-A 3-C 4-D 5- 15 6-E 7- D 8-D 9) B 10) E 11) A 12) E 13) E 14) D 15) V = K [BrO-3]1 [Br-]1 [H+]216) – 88Kj17) A 18) C 19) B 20) B 21) B 22) D 23) D
24) DHAtivação = +50 kJ/mol DHReação = +20 kJ/mol
25) A curva II representa a reação na presença de catalisador, pois houve diminuição da energia de ativação. A variação de entalpia é a mesma na presença e na ausência de um catalisador. 26) – 32,7 kJ
GABARITO E RESOLUÇÃO COMENTADA
01- RESP: B
Equacionar a reação citada
H3C – CH = CH2 + H- H → H3C – CH2 – CH3 ΔH=?
Nos reagentes temos:
6 ligações C – H , 1 ligação H – H, 1 igação C – C, 1 ligação C = C
Nos produtos temos:
8 ligações C – H , 2 igação C – C
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH= 6(413) + 347 + 611 + 436+ 8(-413) + 2(-347) =
ΔH = 2478 + 347 +611 + 436 - 3304 - 694=
ΔH = - 126 Kj – Reação exotérmica
OBS: Na questão 21, temos uma outra maneira de resolução.
02- RESP: A
Dada a reação:
H3C – CH3 + Cl – Cl → H3C – CH2Cl + H - Cl
Nos reagentes temos:
6 ligações C – H , 1 ligação Cl – Cl, 1 igação C – C
Nos produtos temos:
5 ligações C – H , 1 igação C – C, 1 ligação C – Cl, 1 ligação H - Cl
ΔH=6(415) + 350 +243 + 5(-415) +(-350) +(-328) +(-432) =
ΔH = 2490 + 350 +243 - 2075 – 350 -328 -432=
ΔH = - 102 Kj – Reação exotérmica
03- RESP: C
Dada a reação:
1H2O → 1H2 + ½ O2
1 H – O – H → 1 H – H + ½ O = O
Obs: arepresentação da água deve ser angular. Apenas coloquei linear para facilitar a sua visualização.
Nos reagentes temos:
2 ligações O – H
Nos produtos temos:
2 ligações H – H , 1/2 igação O = O
ΔH=2(111,72) + (-104,3) + 1/2 (-119,3) =
ΔH = 223,44 – 104,3 – 59,65=
ΔH = - 59,45 kcal/mol – Reação exotérmica
04- RESP: D
A tabela fornece o tempo e o valor de concentração no intervalo de zero a 200 minutos

Com base nos dados da tabela, podemos concluir que, nos 200 mininiciais de reação, a velocidade de desaparecimento de H2O2 (mol L–1 min–1) será de aproximadamente
Tempo = zero ( 0,100 mol/L)
Tempo = 200 ( 0,096 mol/L)
Portanto: 0,096 – 0,100 = 4 x 10-3 mol/L (desapareceu/reagiu)
Vm = 4 x 10-3/ 200
Vm = 2 x 10-5 mol.L-1.min-1
05- Soma: 15
A + B + C ![]() X
X

V = K [A]a[B]b[C]c
Verificando de 1 para 2
A concentração de [B] dobra e a velocidade permanece constante (x1).
1 = 2bb = 0
Verificando de 2 para 3
A concentração de [C] dobra e a velocidade quadruplica.
4 = 2cc = 2
Verificando de 1 para 4
A concentração de [A] dobra e a velocidade também dobra
2 = 2aa = 1
06- RESP: E
O enunciado afirma que a reação é de segunda ordem.
V = K.[ NO]1.[ O3]1
Vamos admitir que inicialmente as concentrações eram 1 mol/L ( poderia ser qualquer valor, pois ele não disse quanto era antes).
V = K.[ 1]1.[ 1]1
V = 1K
Agora ,duplicando as concentrações
V = K.[ 2]1.[ 2]1
V = 4K
07- RESP: D
Dada a tabela

V = K [A2]a[BC]b
Verificando de 1 para 2
A concentração de [A2] dobra e a velocidade também dobra
2 = 2aa = 1
Verificando de 1 para 3
A concentração de [BC] triplica e a velocidade aumenta nove vezes.
9 = 3bb = 2
Equação da velocidade
V = K.[ A2]1.[ BC]2
08- RESP: D
A reação será mais rápida no níquel poroso, devido a superficie de contato.
Quanto maior a superficie de contato, maior será a velocidade da reação.
09- RESP: B
Foi dada a reaçãoe o valor de ΔH
C2H4(g) + H2(g) ![]() C2H6(g)
C2H6(g) ![]() = –137 kJ.mol–1
= –137 kJ.mol–1
Dado:

No reagentes temos:
- ligação C – H = 4 , C = C = 1 e H - H = 1
Nos produtos temos:
- ligação C – H = 6 e C - C = 1
RESOLUÇÃO
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
-137 = 4(413) + X + 436 + 6(-413) + (-346) =
-137 = 1652 + X +436 - 2478 -346 =
X = 1652+ 436 – 2478 – 346 + 137
X = - 599 Kj
10- RESP: E
A reação não é elementar, pois foi dado a tabela

Verificando de y para x
A concentração de A dobra e a velocidade aumenta quatro vezes.
4 = 2a a = 2
Verificando de z para x
A concentração A dobra e a velocidade dobra.
2 = 2b b = 1
Equação da velocidade
V = K.[A]2.[B]1
12- RESP: E

HCA = 60 kcal ( sem catalisador).
HCA = 43 Kj ( com catalisador).
HR = 10 kcal.
HP = 30 kcal
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = 30 – 10 → ΔH = 20 kJ ( ENDOTÉRMICA ).
Ea = HCA - HR → Ea = 60 – 10 → Ea = 50 kcal ( sem catalisador).
Ea = HCA - HR → Ea = 43 – 10 → Ea = 33 kcal ( com catalisador).
Portanto temos uma diminuição de 17 kcal
13- RESP: E
O catalisador acelera uma reação, pois diminui a energia de ativação. O catalisador é regenerado no final da reação.
14- RESP: E
Quanto maior a superfície de contanto, maior será a velocidade da reação.
15- RESOLUÇÃO
A reação não é elementar, pois foi dado a tabela

*Taxa relativa = velocidade
Verificando de 1 para 2
A concentração de [BrO3-] dobra e a velocidade dobra também.
2 = 2aa = 1
Verificando de 1 para 3
A concentração de [Br-] triplica e a velocidade também triplica.
3 = 3bb = 1
Verificando de 2 para 4
A concentração de [H+] dobra e a velocidade aumenta quatro vezes
4 = 2zz = 2
Equação da velocidade
V = K.[ BrO3-]1.[ Br-]1.[ H+]2
16- RESOLUÇÃO
Foi dada a reação e os valores de energia de ligação.
N2(g) +3 H2(g) ![]() 2 NH3(g)
2 NH3(g) ![]() = ?
= ?
No reagentes temos:
ligação N Ξ N = 1 , H - H = 3
Nos produtos temos:
ligação N – H = 6
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 944 + 3(436) + 6(-390) =
ΔH = 944 + 1308 -2340 =
ΔH = - 88 kJ
17- RESP: A
De acordo com os dados, trata-se de energia de ligação, conforme informação do enunciado, temos que balancear a equação.
1 C3H8 + 5 O2è3 CO2 + 4 H2O ΔH =?
Agora vamos abrir a reação para facilitar a visualização das ligações.
NOTA: a representação da água é angular, apenas colocamos linear para facilitar a visualização.
No reagentes temos:
- ligação C – H = 8 , C – C = 2 e O = O = 5
Nos produtos temos:
- ligação O – H = 8 e C = O = 6
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 8 (413 ) + 2(348) + 5(498) + 6(-744) + 8(-462) =
ΔH = 3304 + 696 + 2490 – 4464 -3696 =
ΔH = - 1670 Kj
18 – RESP: C
De acordo com os dados, trata-se de energia de ligação.
Agora vamos abrir a reação para facilitar a visualização das ligações.
No reagentes temos:
- ligação C – H = 4 , Cl – Cl = 2 e F = F = 2
Nos produtos temos:
- ligação C – F = 2 ; C - Cl = 2 ; H – F = 2 ; H – Cl = 2
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 4(413) + 2(239) + 2(154) + 2(-485) + 2(-339) + 2 (-565) + 2 (-427) =
ΔH = 1652 + 478 + 308 - 970 -678 – 1130 – 854 =
ΔH = - 1194 Kj
19 – RESP: B
De acordo com os dados, trata-se de energia de ligação, conforme informação do enunciado, temos que equacionar a reação de combustão total do butano. A combustão total de hidrocarboneto produz gás carbônico e água
1 C4H10 + 13/2 O2è4 CO2 + 5 H2O ΔH =?
Agora vamos abrir a reação para facilitar a visualização das ligações.
NOTA: a representação da água é angular, apenas colocamos linear para facilitar a visualização.
No reagentes temos:
- ligação C – H = 10 , C – C = 3 e O = O = 6,5
Nos produtos temos:
- ligação O – H = 10 e C = O = 8
RESOLUÇÃO
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 10(412) + 3(348) + 6,5(484 ) + 8(-743) + 10(-463) =
ΔH = 4120 + 1044 + 3146 -5944 – 4630 =
ΔH = - 2264 Kj
20 – RESP: B
A questão é sobre velocidade de reação, onde a mesma foi dada.
V = k [ A]2 [B]1
A questão (este tipo de questão) não forneceu a concentração molar inicial. Para facilitar os cálculos vamos admitir que a concentração inicial dos reagentes fosse de 1 mol/L ( poderia ser qualquer número. Escolhemos o 1 mol/L para ficar mais fácil de verificar quantas vezes aumentou ou diminuiu ) e calcular a velocidade inicial.
No início temos:
V = k [ 1]2 [1]1è V = 1K
Depois temos:
- concentração de A foi triplicada è [ 3 ].
-concentração de B foi duplicada è [2 ]
V = k [ 3]2 [2]1è V = 18K
O NOVO VALOR DA VELOCIDADE SERÁ 18 VEZES MAIOR.
21 – RESP: B
Para determinar o Y, vamos deixar o X constante. Encontramos esta situação no experimento 1 e 3, onde notamos que a concentração do [NO] permanece constante e a concentração de [O2] aumenta 4 vezes, e a velocidade também aumenta 4 vezes.
22 – RESP: D
A questão fornece a reação : A2 + B2® 2 AB
HCA = 60 Kj.
HR = 30 Kj.
HP = - 10 Kj.

OBSERVAÇÕES IMPORTANTES:
HCA = Entalpia do complexo ativado.
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = -10 – 30 → ΔH = - 40 kJ ( EXOTÉRMICA ).
Ea = HCA - HR → Ea = 60 – 30 → Ea = 30 Kj ( reação direta).
Ea = HCA - HR → Ea = 60 – (-10) → Ea = 70 Kj ( reação inversa)
RESPOSTA CORRETA : D
23- RESP: D
A questão informa que a reação é: A + B è C + D
H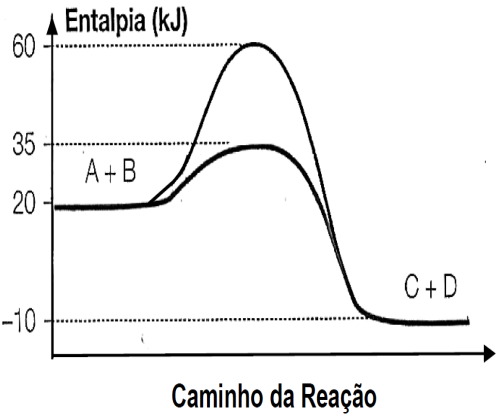 CA = 60 Kj ( sem catalisador).
CA = 60 Kj ( sem catalisador).
HCA = 35 Kj ( com catalisador).
HR = 20 Kj.
HP = - 10 Kj.
HCA = Entalpia do complexo ativado.
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = -10 – 20 è ΔH = - 30 kJ ( EXOTÉRMICA ).
Ea = HCA - HR → Ea = 60 – 20 → Ea = 30 Kj ( sem catalisador).
Ea = HCA - HR → Ea = 35 – 20 → Ea = 15 Kj ( com catalisador).
24 – RESOLUÇÃO
Através do gráfico temos:
![]()
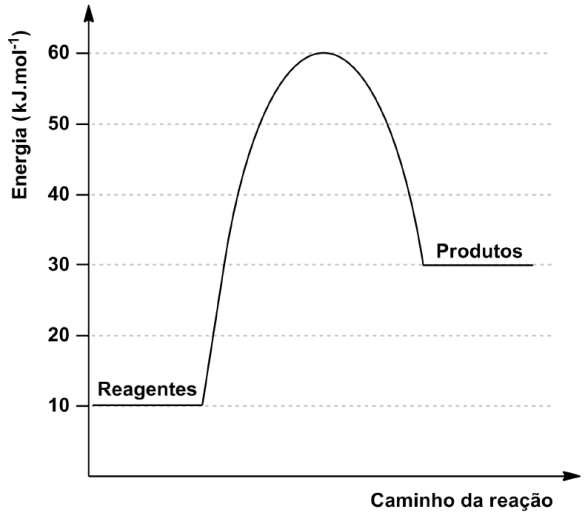
HCA = 60 Kj
HR = 10 Kj.
HP = 30 Kj.
HCA = Entalpia do complexo ativado.
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = 30 – 10 → ΔH = + 20 kJ ( ENDOTÉRMICA ).
Ea = HCA - HR → Ea = 60 – 10 → Ea = 50 Kj
25 – RESOLUÇÃO
Dado o diagrama notamos que:
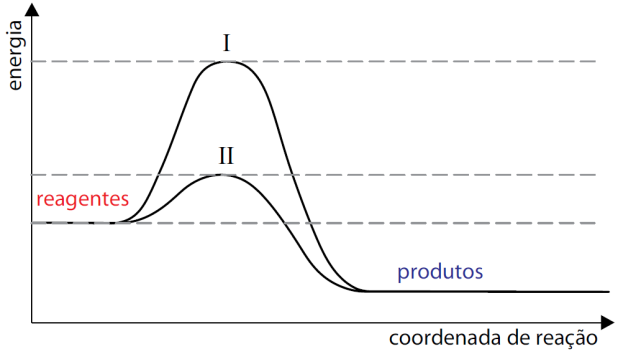
I = HCA sem catalisador
II = HCA com catalisador
HP Entalpia dos produtos
HR Entalpia dos reagentes
A curva II representa a reação na presença de catalisador. Quanto menor a energia de ativaçã ( dada aos reagentes até atingir o complexo ativado), maior a velocidade da reação.
O catalisador não interfere na variação de entalpia, pois a mesma é calculada pela diferença entre a entalpia dos produtos e entalpia dos reagentes, na presença ou não do catalisador.
26 – RESOLUÇÃO
seguir.
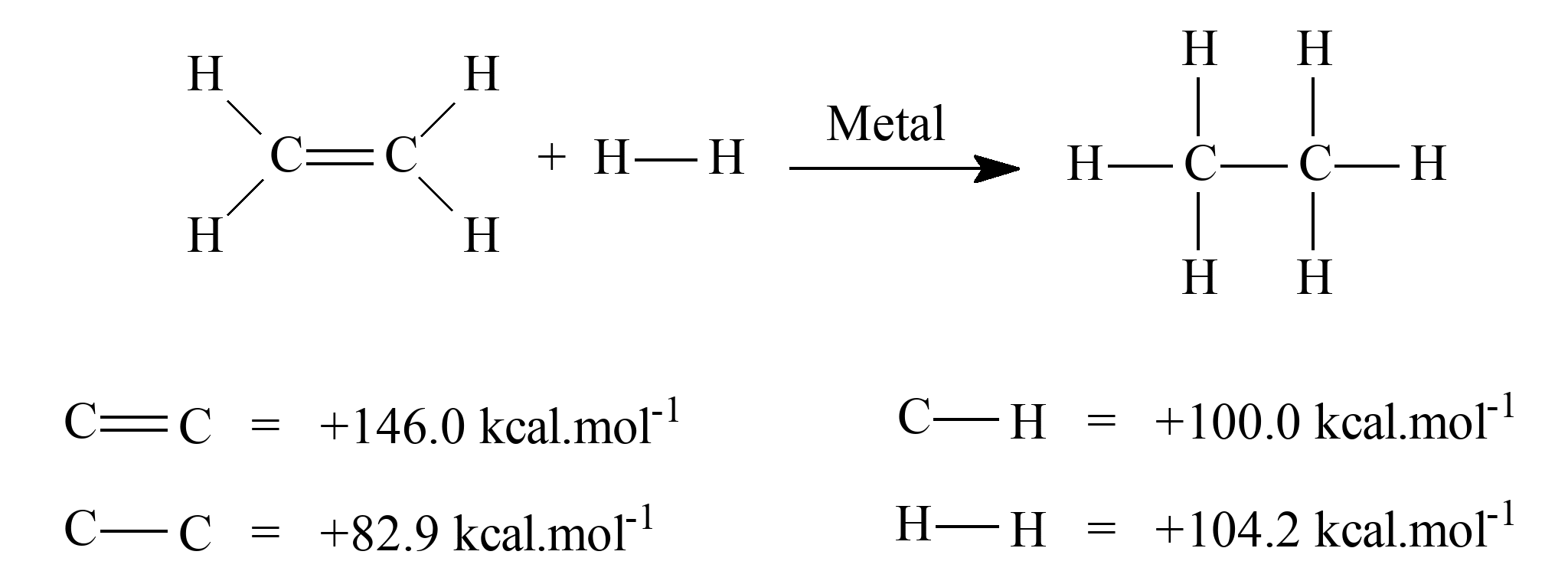 A questão já forneceu as ligações. Portanto temos:
A questão já forneceu as ligações. Portanto temos:
ΔH = 4(100) + 146 + 104,2 + 6(-100) + ( - 82,9 ) =
ΔH = 400 + 146 + 104,2 – 600 – 82,9 = ΔH = - 32,7 kcal