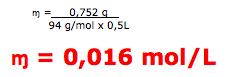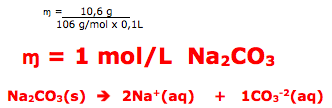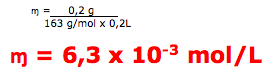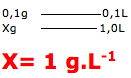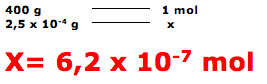RESOLUÇÃO COMENTADA
1-A questão pede para calcular a concentração comum ( g.L-1).
Portanto precisamos ter o valor de massa, pois o volume nós temos (500 cm3 = 0,5 L ) e a questão forneceu o número de mols que vamos transformar em massa.
Vamos calcular a massa molar do C2H6O2 = 24+6+32 = 62 g/mol.
Temos: 62 g/mol------- 1 mol
X------------------------- 5 mol
X = 310 gramas
Dica: quando a questão pede para calcular em g.L-1, entendemos que temos que calcular a massa existente em um (1L) de solução.
Isto indica que em :
310 g ----- 0,5 L
X---------- 1,0 L
X = 620 g.L-1
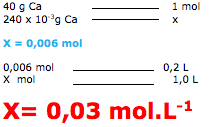
2- A questão pede para calcular a concentração molar ( mol.L-1) e fornece o volume de 0,2 L, uma massa de 240 mg ( 240 x 10-3g ) e o elemento é o cálcio de massa 40 g/mol ( tabela periódica ).
Para resolver, podemos utilizar a fórmula ou uma regra de três.
Dica: para transformar mg em grama, é só multiplicar por 10-3
Também podemos resolver utilizando a regra de três. De acordo com o enunciado temos que determinar o número de mols em um (1L) de solução, pois vamos calcular a concentração em mol/L.
3-Nesta questão temos que ler com atenção o enunciado, pois foi preparado 2 litros de solução que sofreu evaporação, restando apenas 800 mL ( 0,8 L ). Portanto o volume que será utilizado é de 0,8 litros em uma massa de 19,6 g de ácido sulfúrico (H2SO4 = 98 g/mol).
Dica: utilizando a fórmula será apenas substituir os valore. Na regra de três, primeiro temos que calcular o número de mols existentes em 19,6g de ácido e depois calcular a concentração molar.
4- Para esta questão vamos utilizar a seguinte fórmula:
5-Nesta resolução vamos utilizar diretamente a fórmula.
A questão fornece a massa de 0,752g , volume de 0,5 litros e massa molar igual a 94 g/mol.
6- Vamos calcular a massa molar do Na2CO3 = 46+12+48 = 106 g/mol.
Temos:
X = 5,3 gramas
Dica: quando a questão pede para calcular em g.L-1, entendemos que temos que calcular a massa existente em um (1L) de solução.
Isto indica que em :
5,3 g ------ 0,1 L
X ----------- 1,0 L
X = 53 g.L-1
7-A questão envolve um experimento onde ocorre uma reação de neutralização total ( balanceada), formação de sal neutro.
Dica : sal neutro: H+ = OH- ( quantidade de H+ = OH- ).
Para ocorrer a neutralização total, o número de mols dos reagentes tem que obedecer a uma proporção.
2 HCl + Ca(OH)2 CaCl2 + 2 H2O
Utilizando a reação notamos que a proporção é de 2:1
2 HCl + 1 Ca(OH)2 CaCl2 + 2 H2O
O texto informa que a solução de hidróxido de cálcio foi neutralizada com 5 ml de solução de HCl 0,01 mol.L-1. Com esta informação podemos calcular o número de mols de ácido utilizado.
0,01 mol ---------------- 1L
X mol ................... 5 x 10-3 L
X = 5 X 10-5 mol de ácido.
Como a proporção é de 2:1
Temos: 2 mol HCl --------- 1 mol de Ca(OH)2
5 x 10-5 mol -------- x
X = 2,5 x 10-5 mol de Ca(OH)2
Agora vamos transformar o número de mols da base em massa.
74 g Ca(OH)2 ................ 1 mol
X g .................. 2,5 x 10-5 mol
X = 0,00185 g
Determinação da concentração em g/L.
0,00185 g Ca(OH)2 ................ 10 x 10-3L
X g .................. 1,0 L
X= 0,185 g.L-1
8-RESP:A
A questão fornece a concentração em mg/L, que vamos transformar em gramas, multiplicando por 10-3.
Portanto : 1 mg/L = 1 x 10-3g/L.
O tanque tem um formato regular de 5m x 2m x 10m = 100m3 =
Dica: 100m3 = 100 X 103L ( 1m3 = 1000L ).
Utilizando a regra de três temos de acordo com o enunciado:
1 x 10-3g ............. 1L
X .............100 X 103L
X= 100 gramas
9-RESP:D
A questão refere-se a uma criança de 12 anos, onde a dose recomendada é de 1mg/kg, duas vezes ao dia, durante cinco dias.
Concluímos que após os 5 dias serão 10 doses e uma massa de 600 mg, pois a criança pesa 60 kg e a dose ajustada é de 1mg/kg.
O produto encontrado na farmácia é de 12mg/mL
Cálculo do volume em mL.
12 mg .................... 1 mL
600 mg .................... x
X = 50 mL
10-RESP:A
Primeiro vamos determinar a massa molar do Na2CO3.
Na2CO3 = 46 + 12 + 48 = 106 g/mol
A questão fornece 21,2g e um volume de 1L(1000 mL).
Dica: Na dissociação, a concentração obedece a proporção.
Neste caso a mesma é de 2:1
11-RESP:C
O etanol possui fórmula molecular C2H5OH e massa molar igual a 46 g/mol, a massa é de 0,2 g e o volume de 1 litro.
A questão deseja saber a concentração em mols existentes em 1 litro. O primeiro passo é transformar a massa de álcool dada em mol.
46 g etanol .............. 1 mol
0,2 g etanol .............. x
X = 0,0043 mol/L = 4,3 X 10-3 mol/L
Dica : a massa dada 0,2 gramas é para um litro, logo o número de mols encontrado também será para um litro.
12-RESP:E
A massa molar do KmnO4 = 39 + 55 + 64 = 158 g/mol.
A concentração molar é de 0,02 mol/L, ocupando um volume de 2,5 litros. Para calcular a massa, vamos utilizar novamente a fórmula da concentração molar.
13-RESP:C
A massa molar glicose = 180 g/mol.
A concentração molar é de 0,5 mol/L, ocupando um volume de 0,2 litros. Para calcular a quantidade de matéria, precisamos apenas da regra de três.
0,5 mol ……………… 1L
X ……………….0,2L
X = 0,1 mol
Dica : quantidade de matéria é a definição de mol
14- RESOLUÇÃO
Primeiro vamos determinar a massa molar do Na2CO3.
Na2CO3 = 46 + 12 + 48 = 106 g/mol
A questão fornece 10,6g e um volume de 0,1L(100mL).
15-RESP:E
A questão indica que a massa molar é igual a 163 g/mol
A questão fornece 0,2g do medicamento e um volume de 0,2L(200 mL). Portanto para calcular a concentração molar temos:
17-RESP:D
A concentração da solução inicial é de 2 mol/L e o estudante tinha inicialmente 1 litro dessa solução. Após a evaporação ele tem apenas ¼, ou seja,, 250 mL de solução.
Podemos calcular o número de mols neste volume.
2 mol ............... 0,25L
X ----------------1L
X = 8 mol/L
Dica : Na diminuição de volume, a concentração sempre aumenta sem alterar o número de mols.
ɱ v = ɱ1 v1
2 x 1 = ɱ1 x 0,25
ɱ1 = 8 mol.L-1
18-RESP:A
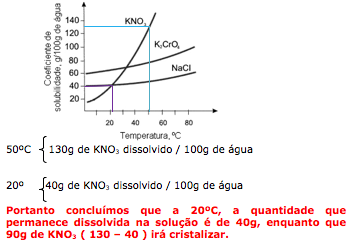
Analisando o gráfico, notamos que :
19-RESP:E
A questão fornece a massa ( 60g) presente em 100 mL (0,1L) de solução.
A questão pede a concentração em mol/L, ou seja, quantos mols de glumato em um litro de solução.
Para resolver, primeiro vamos determinar a massa molar do glutamato.
1)Massa molar
C5H8NNaO4 . H2O = 60 + 8 = 14 + 23 +64 + 18 = 177 g/mol
2) Determinar o número de mols em 60g de glutamato.
177g glutamato .............. 1 mol
60g glutamato .............. x
X = 0,338 mol de glutamato.
3) Calculo da concentração molar em 1 litro.
0,338 mol ............... 0,1L
X mol ............... 1,0L
X= 3,38 mol/L
21-RESP:A
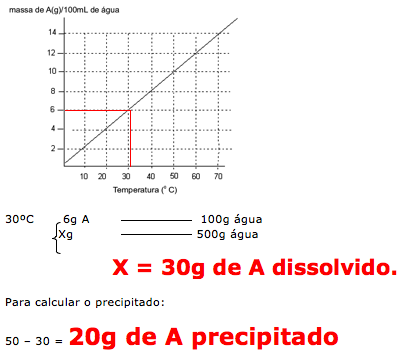
A questão fornece o coeficiente de solubilidade do K2Cr2O7 que é de 12g em 100 mL de água.
A questão fornece uma massa de 120 gramas e 600 mL de água ( 600g água)
Dica: A densidade da água é de 1g/mL, indicando que 600mL é igual a 600g de água.
A quantidade de água é que determina o quanto de soluto irá dissolver.
Portanto vamos calcular quanto os 600 mL consegue dissolver de K2Cr2O7.
12g K2Cr2O7 ....100 mL água
X ........................ 600 mL água
X = 72 g de K2Cr2O7 dissolvido
Temos: 120 – 72 = 48g não dissolvido
Concluímos que dos 120g de K2Cr2O7 em 600 mL de água, 72g dissolvem e 48 gramas cristaliza formando o precipitado, indicando um sistema heterogêneo.
22-RESP:C
A questão forneceu uma tabela com o coeficiente de solubilidade do sal.

23-RESP:E
Pelo enunciando temos que o coeficiente de solubilidade da substância X é de 53g em 100 mL de água.
Dica: Como a questão fornece valores diferentes de água, temos que calcular a quantidade de sal dissolvida nestas quantidades.
Para 50 mL de água
Conhecimento para a resolução:
Solução insaturada: quantidade de soluto dissolvido é menor que o estipulado pelo coeficiente.
Solução saturada: quantidade de soluto dissolvido é igual ao estipulado pelo coeficiente.
Solução supersaturada: quantidade de soluto dissolvido é maior que o estipulado pelo coeficiente.
Soluções:
1- Saturada pois a quantidade dissolvida é igual ao coeficiente para 50 mL de água.
2- Insaturada, pois a quantidade dissolvida é menor que a determinada para 100 mL de água.
3- Insaturada, pois a quantidade dissolvida é menor que a determinada para 150 mL de água.
4-Saturada com precipitado, pois a quantidade estipulada é maior que o coeficiente para 100 mL de água.
24-RESP:B
A questão informa que o coeficiente de solubilidade do cloreto de sódio é:
360g de NaCl/1000g de água (1000 Ml ).
Como foi adicionado 500g na mesma quantidade de água, apenas 360g dissolvem e 140g cristaliza formando o precipitado.
Concluímos que o sistema resultante é de uma solução saturada com precipitado.
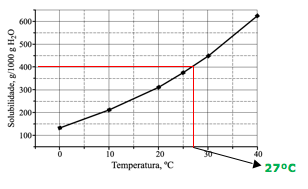
25-RESP:D
Para determinar a temperatura, vamos calcular a massa de soluto necessária para atingir o coeficiente de solubilidade. De acordo com o gráfico, a quantidade de água é de 1000g.
O enunciado fornece 500g de água e 200g de soluto.
Dica: Utilizando o gráfico, concluímos que a temperatura será de aproximadamente 27ºC, para ter uma solução saturada, ou seja, atingir o coeficiente de solubilidade.
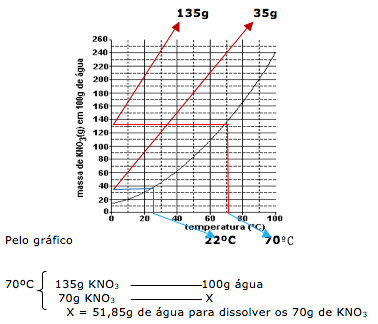
26-RESP:B
A questão diz que preparou duas soluções a 70ºC, onde cada uma contém 70g de soluto em 200g de água. Uma solução foi resfriada até começar a cristalizar. Portanto vamos calcular o quanto de água será necessário para dissolver os 70 gramas de KNO3
Como temos 200g de água ( 200 – 51,85 =148,15), concluímos que após evaporar 148,15 g de água, o sal começa a precipitar.
Através do gráfico temos que a quantidade de água é de 100g.
Traçando no gráfico vamos achar a temperatura de 22ºC.
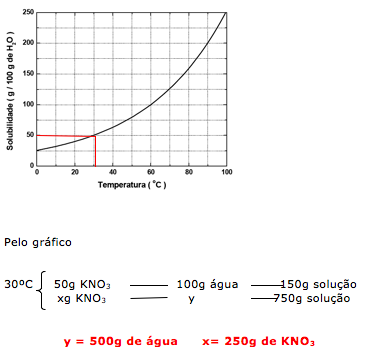
27-RESP:A
Através do gráfico podemos determinar o coeficiente a 30ºC e determinar a quantidade de soluto e solvente.
Dica: A questão fornece 750g de solução, isto indica que: soluto + solvente = solução (750g).
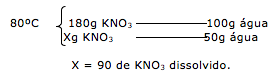
28-RESOLUÇÃO
Resfriando até 40ºC
Dica: Quando resfria, a quantidade de água permanece a mesma, ou seja , a quantidade de água a 80ºC é a mesma em 40ºC.
Quanto ao soluto, muda apenas a quantidade que permanece dissolvida.
Na temperatura de 80ºC, temos dissolvido 90 gramas de KNO3. Após o resfriamento a 40ºC, apenas 30g permanecem dissolvidos.
Dica: Para calcular o quanto de precipitado será formado, basta apenas realizar a subtração do dissolvido no inicio e no final.
Portanto temos:
90 – 30 = 60g de precipitado.
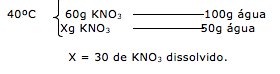
29-RESOLUÇÃO
Pelo enunciado temos 50g de uma substância A dissolvida em 1 litro (1000g) de água, a 70ºC que é aquecida até evaporar a metade da água. Portanto passamos a ter 500 gramas de água e 50g da substância A.
Esta solução é resfriada até atingir 30ºC.
Analisando o gráfico temos que a 30ºC a solubilidade é de 6g de A em 100g de água. Com isso podemos calcular quanto dos 50g de A permanecem dissolvidos e posteriormente calcular o quanto precipitou.
30-RESP:E
Esta é aquela questão de enunciado longo, onde a maior parte do enunciado “não serve pra nada”.
Dica: Neste tipo de questão o ideal é grifar os dados numéricos, verificando as unidades , e a pergunta do exercício.
Neste temos que a dose diária da vitamina C é de 100mg = 0,1g.
Esta vitamina é dissolvida em um copo com cerca de 100mL= 0,1L de água .
A questão pede para calcular a quantidade de vitamina existente em 1L de solução (g.L-1).
Resolução:
31-RESP:C
Esta questão refere-se a teoria atômica molecular, onde se deve calcular o número de mols existentes em 0,25mg=0,25 x 10-3g de brometo de ipratrópio.
Dica: massa molar – 1 mol – 6 x 1023 moléculas.
A questão fornece a massa molar igual a 400 g.mol-1
32-RESP:D
Questão que possui enunciado longo, porém a resolução é mais simples.
Dica: Os metais alcalinos-terrosos são aqueles que pertencem a família 2ª.
Trata-se de um rótulo de água mineral. Concluímos que os sais estão na forma de íons. A tabela fornece a quantidade de íons em mg e a questão pede a massa total de metais alcalinos em mg. Portanto é só somar.
Cálcio + estrôncio + magnésio ( metais alcalino-terrosos)
7,792 + 0,342 + 0,340 = 8,474
RESPOSTA = 8,474 mg/L
33-RESP:E
A questão fornece um enunciado longo que não interfere na resolução do exercício.
Dica: A reação dada não será utilizada, pois foi apenas uma maneira da aluna recordar as aulas de química. Se você não ficar atento ao enunciado, vai querer balancear a equação que não será usada. O que vamos utilizar é apenas a massa molar do Bicarbonato ( 84 g/mol), o volume do copo d´água ( 200 Ml = 0,2L) e a massa contida no envelope de 2,10 g.
Calcular o número de mols de bicarbonato de sódio(NaHCO3).
84 g de NaHCO3 ------- 1mol
2,10 g de NaHCO3 ---- X
X = 0,025 mol
Cálculo do número de mols em 1 litro de solução ( mol/L )
0 ,025 mol -- 0,2L
,025 mol -- 0,2L
X ------------1,0L
------------1,0L
X = 0,125 mol/L
34-RESP:A
35-RESP:A
36-RESP:C
Gasto com a torneira aberta = 12 litros.
Gasto , fechando a torneira = 0,3 L.
Economia: 11,7L
Sabendo-se que a densidade da água é de 1g/ml.
1g ----- 1X10-3L
X ------ 11,7 L
X = 11700 gramas de água
Cálculo do número de moléculas.
18 g de água ------------------ 6 x 1023 moléculas
11700 g água ------------------ x
X = 3,9 x 1026 moléculas de água
37-RESP: B
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de mols do clorometano
1mol ------------ 6 x 1023 moléculas.
X ------------ 6 x 1015 moléculas
X= 1 x 10-8 moléculas de clorometano.
Cálculo do número de mols do diclorometano
1mol ------------ 6 x 1023 moléculas.
X ------------ 1,2 x 1017 moléculas
X= 2 x 10-7 moléculas de diclorometano.
38-RESP: D
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de moléculas do gás sarin
140 g sarin ------------ 6 x 1023 moléculas.
0,5 x 10-3 g ------------ x
X= 2,14 x 1018 moléculas de gás sarin
39-RESP: A
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de moléculas do hidroxocobalamina
1300 g ------------ 6 x 1023 moléculas.
5,0 g ------------ x
X= 2,3 x 1021 moléculas hidroxocobalamina