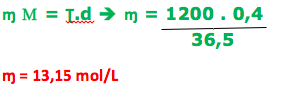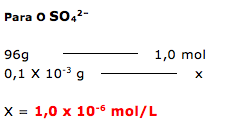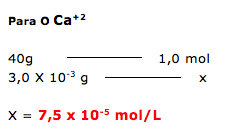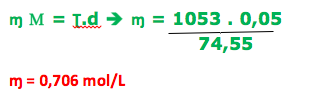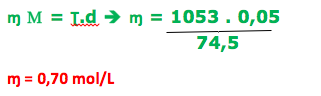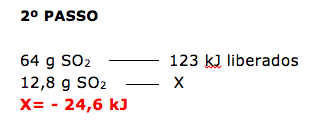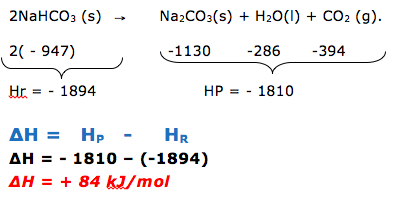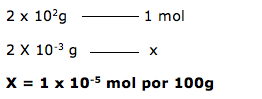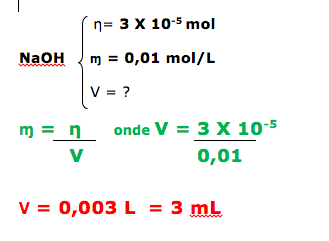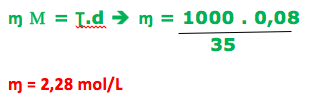RESOLUÇÃO COMENTADA
GABARITO E RESOLUÇÃO COMENTDA – LISTA 02 – 2ºEM
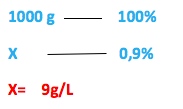
1- RESP: 9g/L
RESOLUÇÃO
A questão fornece a porcentagem (título), a densidade e diz que a solução é de cloreto de sódio (NaCl) e pede para calcular a concentração comum (C).
1º. Passo
Separar os dados:
Ʈ = 0,9% ( 9x10-3) Μ = 58,5 g/mol d = 1g/mL = 1000 g/L C = ?
C = Ʈ . d C = 9 X 10-3 . 1000
C = 9 g/L
Ou
2- RESP: soma = 27
RESOLUÇÃO
Separando os dados da questão:
Ʈ = 40% ( 0,4) Μ = 36,5 g/mol d = 1,20g/mL = 1200 g/L C = ?
01- verdadeiro
C = Ʈ . d C = 0,4 . 1200
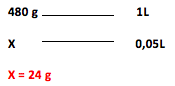
C = 480 g/L
Agora calculando a massa em 50 mL
02- verdadeiro
A indicação 40% em massa de HCl, mostra que em cada 100 g de solução de HCl, temos 40g de soluto e 60 g de água
Dica: Toda concentração indica a quantidade de soluto.
08- verdadeiro
A palavra molaridade significa concentração molar(ɱ ) ( mol/L), separando os dados, temos:
Ʈ = 40% ( 0,4) Μ = 36,5 g/mol d = 1,20g/mL = 1200 g/L ɱ = ?
16- verdadeiro
Através do enunciado, notamos que ocorre uma diluição.
Temos:
ɱ1 = 13,1 mol/L ɱ2 = ?
v1 = 0,1 L v2 = 0,5L
ɱ1 . V1 = ɱ2 . V2
13,1 . 0,1 = ɱ2 . 0,5
ɱ2 = 2,62 mol/L
Dica: Na diluição, o volume aumenta, a concentração diminui , a massa e o número de mols permanecem constantes.
3- RESP: C
A questão envolve relação entre as concentrações e diluição.
1º passo
Calcular a concentração molar da solução inicial, utilizando os dados da questão.
Ʈ = 85,5% ( 0,855) M = 98 g/mol d = 1,69g/mL = 1690 g/L ɱ = ?
2º passo
Agora vamos diluir a solução.
Temos:
ɱ1 = 14,74 mol/L ɱ2 = ?
v1 = 0,0678 L v2 = 0,25L
ɱ1 . V1 = ɱ2 . V2
14,74 . 0,0678 = ɱ2 . 0,25
ɱ2 = 3,99 mol/L
4- RESP: D
A questão envolve a concentração molar de íons e relação entre as concentrações. É dada a concentração em mg/L, que podemos transformar em g/L e depois transformar na concentração molar que é em mol/L
1º PASSO
Transformar as concentrações de mg/L em g/L. Para ficar mais fácil, basta apenas multiplicar o valor dado em mg por 10-3.
Assim temos: SO42– = 0,1 X 10-3 g/L e Ca2+ = 3 X 10-3 g/L
2º PASSO
Vamos utilizar a relação:
Também podemos utilizar a regra de três
5- RESP: B
A questão é sobre a relação entre as concentrações, onde temos:
Ʈ = 5,0% ( 0,05) M = 74,55 g/mol d = 1,053g/mL = 1053 g/L ɱ = ?
6- RESP: E
A questão é sobre a relação entre as concentrações, onde temos:
Ʈ = ? M = 106,0 g/mol d = 1,124kg/L = 1124 g/L ɱ = 1,27 mol/L
7- RESP: 0,70 mol/L
A questão é sobre a relação entre as concentrações, onde temos:
Ʈ = 5,0% ( 0,05) M = 74,5 g/mol d = 1,0453g/mL = 1043 g/L ɱ = ?
8- RESP: 0,66 mol/L
Esta questão é envolve mistura de soluções com reação química ( titulação). O texto informa que ocorreu a neutralização.
RESOLUÇÃO.
O primeiro passo é equacionar a reação de neutralização total entre o ácido e a base. Lembrando que na neutralização total o sal formado é neutro, portanto o número de H+ é igual à quantidade de OH-
H2SO4 (aq) +2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (aq)
De acordo com o enunciado a solução resultante será neutra.
Dica: A solução resultante será neutra quando o número de mols dos reagentes obedecer a uma proporção.
Obs.: O sal formado na reação é neutro, mas nós estamos falando de uma solução.
Primeiro vamos determinar o número de mols dos reagentes.
TAMBÉM PODEMOS CALCULAR A CONCENTRAÇÃO MOLAR DA BASE, UTILIZANDO A FÓRMULA, POIS FOI INFORMADO QUE A SOLUÇÃO RESULTANTE É NEUTRA
Dica: prestar atenção na resolução, pois devido a um descuido você pode estar aplicando distributiva devido à presença do parênteses. Quando o correto é apenas a multiplicação.
9- RESP: a)0,26 mol/L b) 130 mL
Esta questão envolve mistura de soluções de mesmo soluto. Para facilitar a resolução, o correto é montar o esquema a seguir e colocar os dados.
Dica: O volume final será igual à soma dos volumes das soluções envolvidas.
O número de mols final será a soma dos números de mols das soluções envolvidas.
Obs.: Não podemos simplesmente somar as concentrações.
RESOLUÇÃO
10- RESP: a)0,24 mol/L b) 1,65 mol/L
Esta questão envolve mistura de soluções de mesmo soluto. Para facilitar a resolução, o correto é montar o esquema a seguir e colocar os dados.
11- RESP: C
Esta questão envolve mistura de soluções. Para facilitar ele forneceu uma tabela.
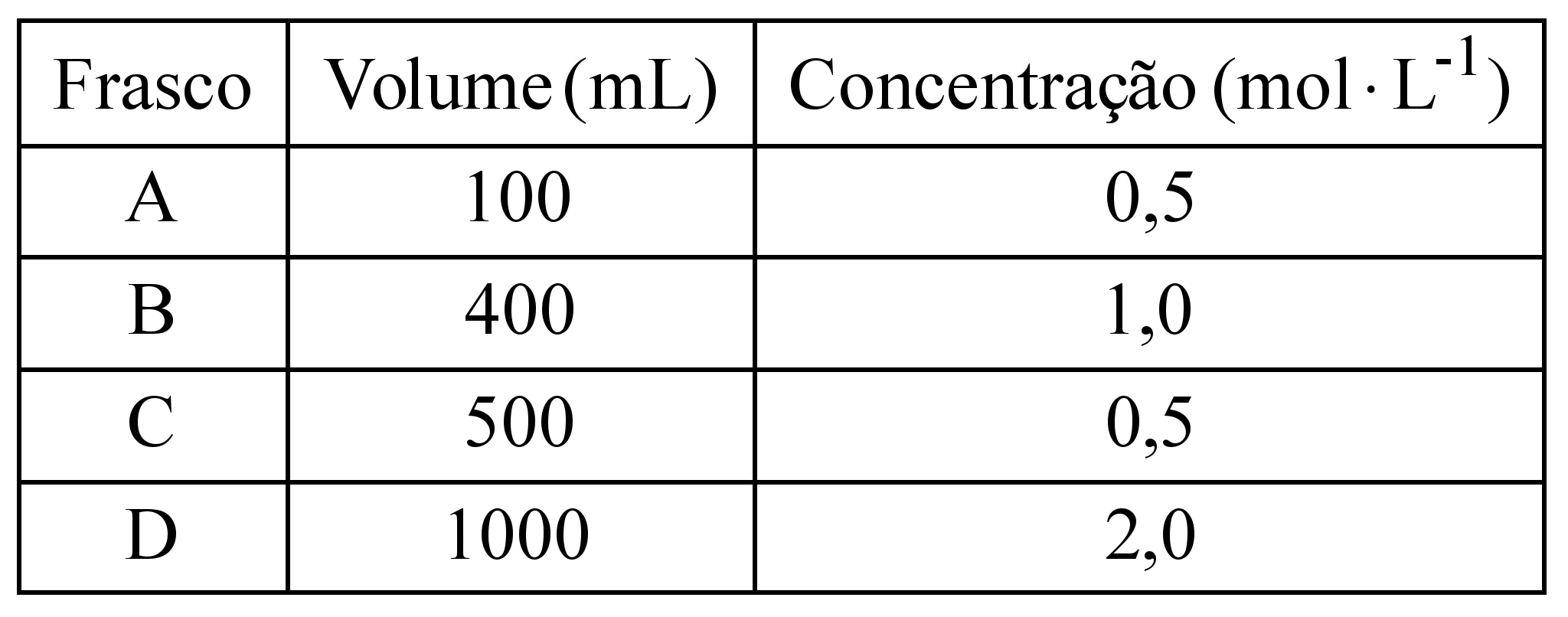
Vamos seguir as instruções dadas.
12- RESP: D
Esta questão envolve mistura de soluções de mesmo soluto. Para facilitar a resolução, o correto é montar o esquema a seguir e colocar os dados.
13- RESP: - 891 Kj/mol
A questão envolve termoquímica. Será necessário equacionar a reação de combustão total do metano.
14- RESP: D
Esta questão é envolve mistura de soluções com reação química ( titulação). O texto informa que ocorreu a neutralização.
RESOLUÇÃO.
O primeiro passo é equacionar a reação de neutralização total entre o ácido e a base. Lembrando que na neutralização total o sal formado é neutro, portanto o número de H+ é igual à quantidade de OH-
H2SO4 (aq) +2 NaOH (aq) Na2SO4 (aq) + 2 H2O (aq)
De acordo com o enunciado a solução resultante será neutra.
15- RESP: 5 mL
Questão envolvendo uma diluição.
Temos:
ɱ1 = 0,01 mol/L
ɱ2 = 1 x 10-4 mol/L
v1 = ?
v2 = 0,50L
ɱ1 . V1 = ɱ2 . V2
0,01 . V1= 1 X 10-4 . 0,50
V1 = 0,005L ( 5 mL ).
16- RESP: C
A questão indica que ocorreu uma titulação.Podemos concluir que a solução resultante é neutra e o número de mols dos reagentes obedece a uma proporção
17- RESP: C
Nesta questão , foi informado que 1,92g do ácido, neutraliza o a solução aquosa de hidróxido de sódio.
18- RESP: C
A questão indica que ocorreu uma neutralização total. portanto concluímos que a solução resultante é neutra e o número de mols dos reagentes obedece a uma proporção
19- RESP: B
20- RESP: D
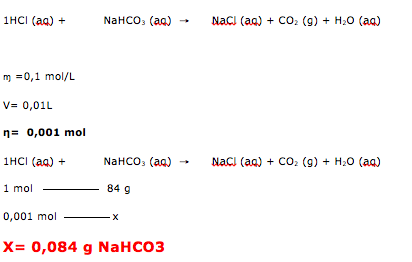
Esta questão, apesar de ser de mistura de soluções com reação química, ela é basicamente um cálculo estequiométrico, relacionando mols e massa.
21- RESP: C
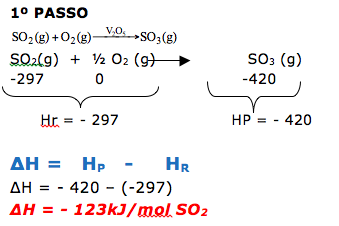
Questão envolvendo termoquímica, onde se pede para calcular a variação de entalpia (ΔH ).
Dica: Antes de iniciar a resolução já podemos afirmar que a variação de entalpia será negativa, pois se trata de uma combustão.
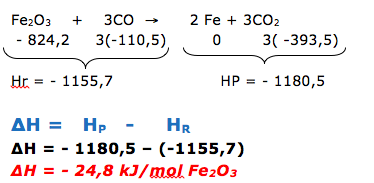
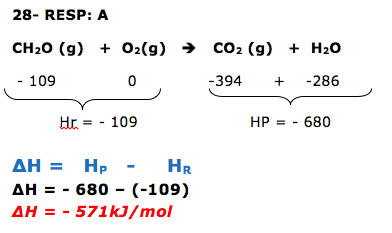
22- RESP: B
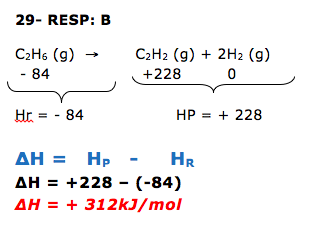
23- RESP: B
DICA : Reação endotérmica, a variação de entalpia tem sinal positivo.
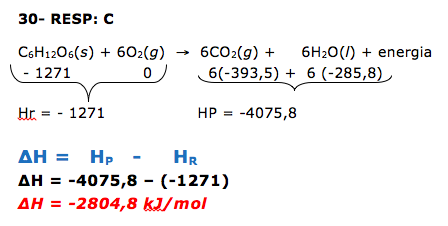
25- RESP: A
31- RESP: A
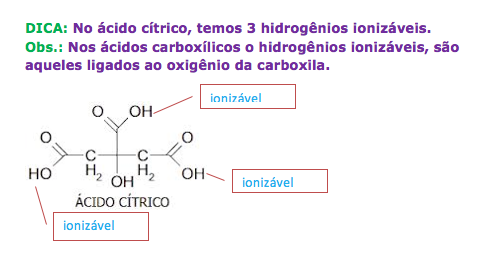
A questão fornece a concentração do ácido cítrico em mg/100g, ou seja, 2x10-3g/100g.
1º. PASSO
Com esta informação podemos calcular o número de mols do ácido, pois a questão fornece a massa molar.
2º. PASSO
A questão indica que o ácido é triprótico ( 3 hidrogênios ionizáveis) e foi neutralizado com NaOH.
Portanto a proporção do número de mols entre o ácido e a base é de 1:3.
32- RESP: D
A questão é sobre a relação entre as concentrações, onde temos:
Obs. Admitir a densidade da solução igual a 1g/mL
Ʈ = 8,0% ( 0,08) M = 35 g/mol d = 1,0 g/mL = 1000 g/L ɱ = ?