Lista de exercícios–Química – prof. Raimundo. 2º. Trimestre - 2º. Ens. Médio 2017
- Mistura de soluções com reação química.
-Mistura de soluções de mesmo soluto.
-Termoquímica.
-Relação entre as concentrações.
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
01 - (UEA AM/2017)
Considere as seguintes informações, obtidas de um rótulo de água mineral da cidade de Porto Seguro (BA):
nitrato --------------1,45 mg/L
pH a 25 ºC-------- 4,51
Sabendo que 1 g = 103 mg e que a massa molar do íon nitrato é igual a 62 g/mol, é correto afirmar que a concentração de íons nitrato, em mol/L, nessa água mineral é próxima de
a) 2,3 ![]() 10–5.
10–5.
b) 6,2 ![]() 10–5.
10–5.
c) 2,3 ![]() 10–3.
10–3.
d) 2,3 ![]() 105.
105.
e) 6,2 ![]() 105.
105.
02 - (UniCESUMAR SP/2017)
Uma amostra de 5,0 g de soda cáustica foi titulada utilizando-se uma solução aquosa de ácido sulfúrico de concentração 0,80 mol.L–1.
Considerando que foram necessários 50 mL da solução ácida para neutralizar completamente essa amostra e que nenhuma das impurezas presentes reage com ácido sulfúrico, pode-se concluir que o teor de hidróxido de sódio na soda cáustica analisada é de
a) 32 %.
b) 48 %.
c) 64 %.
d) 80 %.
e) 90 %.
03 - (Mackenzie SP/2016)
200 mL de uma solução aquosa de ácido sulfúrico de concentração igual a 1 mol![]() L–1 foram misturados a 300 mL de uma solução aquosa de hidróxido de sódio de concentração igual a 2 mol
L–1 foram misturados a 300 mL de uma solução aquosa de hidróxido de sódio de concentração igual a 2 mol![]() L–1. Após o final do processo químico ocorrido, é correto afirmar que
L–1. Após o final do processo químico ocorrido, é correto afirmar que
a) a concentração do ácido excedente, na solução final, é de 0,4 mol![]() L–1.
L–1.
b) a concentração da base excedente, na solução final, é de 0,4 mol![]() L–1.
L–1.
c) a concentração do sal formado, na solução final, é de 0,2 mol![]() L–1.
L–1.
d) a concentração do sal formado, na solução final, é de 0,1 mol![]() L–1.
L–1.
e) todo ácido e toda base foram consumidos.
04 - (UNIUBE MG/2016)
A titulação é muito utilizada no estudo de reações ácido-base e tem por principal característica determinar a concentração de uma solução problema. Em um laboratório, um grupo de alunos pipetou uma amostra de 20,0 mL de ácido sulfúrico (H2SO4) de concentração desconhecida e adicionou 3 gotas do indicador fenolftaleína. Essa solução foi titulada com hidróxido de sódio 0,1 Molar. Após a viragem do indicador, o volume gasto de NaOH foi de 40 mL.
Com base nas informações, assinale a alternativa CORRETA.
a) A concentração do ácido é de 0,1 mol/L.
b) O número de mols de base necessário para neutralizar totalmente o ácido é de 2![]() 10–3.
10–3.
c) A reação entre o ácido e a base é 1:1.
d) No ponto final da titulação, a solução muda de róseo-avermelhada para incolor.
e) A neutralização total entre esse ácido e a base formará um sal de caráter ácido.
05 - (UEFS BA/2017)
Um motociclista foi de Salvador-BA para Feira de Santana-BA, percorrendo no total 110,0 km. Para percorrer o trajeto, sua motocicleta flex consumiu 5 litros de etanol (C2H5OH, d = 0,8 g.cm–3), tendo um consumo médio de 22,0 km/L.
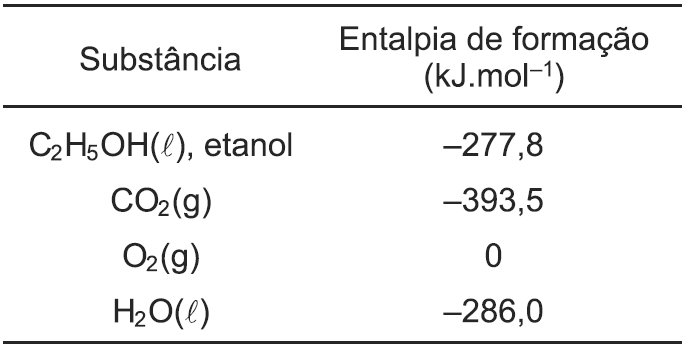
Com base nos dados de entalpia de formação de algumas substâncias, o calor envolvido na combustão completa por litro de etanol foi, em kJ, aproximadamente,
a). –1367
b). +1367
c). –18200
d). +10936
e). –23780
06 - (Mackenzie SP/2016)
Considerando a reação de combustão completa de 1 mol de gás butano no estado-padrão e as informações existentes da tabela abaixo, calcule a variação de entalpia de combustão do butano.

07 – (Mackenzie SP/2015)
Uma solução aquosa de ácido sulfúrico, com densidade igual a 1,4 g![]() mL–1, apresenta 70% em massa de soluto. Calcule a concentração, expressa em mol por litro, para essa solução.
mL–1, apresenta 70% em massa de soluto. Calcule a concentração, expressa em mol por litro, para essa solução.
08 –(Fac. Israelita de C. da Saúde Albert Einstein SP/2016-MOD)
Para determinar a pureza de uma amostra de ácido sulfúrico , uma analista dissolveu certa massa do ácido em água até obter uma solução. A analista separou 10,0 mL dessa solução e realizou a titulação, utilizando fenolftaleína como indicador. A neutralização dessa alíquota foi obtida após a adição de 40,0 mL de uma solução aquosa de hidróxido de potássio de concentração 0,5 mol.L–1. Determine a concentração em mol.L-1 do ácido analisado.
09 – (Mackenzie SP/2015)
O cicloexano (C6H12) é um hidrocarboneto líquido à temperatura ambiente, insolúvel em água, que pode ser obtido pela redução com hidrogênio, na presença de um catalisador e pressão adequados, a partir do benzeno, apresentando valor de entalpia-padrão de formação igual a –156 kJ.mol–1. Sabendo-se que as entalpias padrão de formação, da água líquida e do dióxido de carbono gasoso são, respectivamente, –286 kJ.mol–1 e –394 kJ.mol–1, determine a entalpia-padrão(ΔH) de combustão do cicloexano.
Reação: C6H12 + 9 O2 6 CO2 + 6H20
10 - (UERGS)
O volume em litros de uma solução de HNO3 0,1mol.L–1 que deve ser adicionado a 5L de uma solução de HNO30,5 mol.L–1 para obter uma concentração final igual a 0,2 mol.L–1 é
-
3. b) 6. c) 12. d)15. e)30.
11 - (UFF RJ)
A molaridade de uma solução X de ácido nítrico é o triplo da molaridade de outra solução Y do mesmo ácido. Ao se misturar 200,0 mL da solução X com 600,0 mL da solução Y, obtém-se uma solução 0,3M do ácido. Pode-se afirmar, então, que as molaridades das soluções X e Y são, respectivamente:
a)0,60 M e 0,20 M b)0,45 M e 0,15 M c)0,51 M e 0,17 M d)0,75 M e 0,25 M e)0,30 M e 0,10 M
12 - (PUC RJ)
Uma solução de ácido clorídrico (HCl) 4,0M foi misturada com outra solução do mesmo ácido (HCl) 1,5M, obtendo-se 400 mililitros de solução 2,5M.
Os volumes em mililitros das soluções 4,0M e 1,5M de HCl que foram adicionadas são, respectivamente.
a) 120 e 280 b)140 e 260 c)160 e 240 d)180 e 220 e)200 e 200
13- (UEL PR)
Esta questão relaciona-se com a solução obtida pela mistura de 200 mL de 0,50M de HNO3 e 300 mL de solução 0,20 M do mesmo ácido. A solução final tem concentração molar
-
0,50 b) 0,32 c)0,25 d) 0,20 e) 0,15
14 - (UFG GO)
Misturando-se 280mL de uma solução 0,5N de HCl com 200mL de uma segunda solução de HCl contendo 14,6g deste ácido puro em 500mL de solução, a normalidade final será:
a)0,625 b)0,8 c)0,84 d)0,4 e)1,46
15 - (UNIFOR CE/2016)
O sabor azedo característico do vinagre deve-se à presença do ácido acético, CH3COOH, um ácido fraco, produzido principalmente pela fermentação do vinho. Para quantificar a presença deste ácido, 10,0 mL de uma amostra de vinagre foram neutralizados com 25,0 mL de uma solução de NaOH 0,1 mol/L. A concentração do ácido acético no vinagre, em gramas por litro, será aproximadamente igual a quanto?
16 - (Fac. Direito de Sorocaba SP/2016)
Uma solução de ácido acético (CH3COOH; massa molar 60 g) encontra-se sem titulação. Sabe-se que para a neutralização total de 150 mL dessa solução são necessários 100 mL de NaOH (1mol/L).
Segue a equação da reação de neutralização.
CH3COOH + NaOH ![]() Na+ + CH3COO– + H2O
Na+ + CH3COO– + H2O
Qual a concentração em g.L-1 para essa solução de ácido acético ?
17 - (IFGO/2016)
O trifluormetano, CHF3, é produzido pela fluoração do gás metano, de acordo com a equação abaixo não balanceada.
CH4(g) + F2(g) ![]() CHF3(g) + HF(g).
CHF3(g) + HF(g).
Dados:
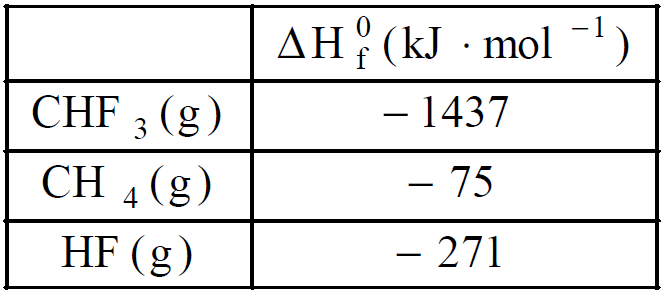
A entalpia-padrão da reação de fluoração do gás metano, em kJ.mol–1, é igual a
a) + 1633
c) – 1633
d) – 2175
e) – 2325
18 - (UNESP SP/2015)
Chama-se titulação a operação de laboratório realizada com a finalidade de determinar a concentração de uma substância em determinada solução, por meio do uso de outra solução de concentração conhecida. Para tanto, adiciona-se uma solução-padrão, gota a gota, a uma solução-problema (solução contendo uma substância a ser analisada) até o término da reação, evidenciada, por exemplo, com uma substância indicadora. Uma estudante realizou uma titulação ácido-base típica, titulando 25,0 mL de uma solução aquosa de hidróxido de cálcio e gastando 20,0 mL de uma solução padrão de ácido nítrico de concentração igual a 0,10 mol · L–1.
Utilizando os dados do texto,calcule a concentração da solução de Ca(OH)2.
19 – (Unioeste PR/2014)
Atualmente, encontra-se no mercado álcool(C2H5OH) grau 46º INPM. Esta medida baseia-se na porcentagem, em massa, de álcool (46%) presente na mistura. Para a mesma, pode-se afirmar que a concentração de álcool, em mol.L–1, é igual a quanto? Para efeito de cálculos, considere a densidade da solução acima igual a 1,0 g/mL.
20 –(PUC RJ/2014)
Neutraliza-se 50 mL de solução aquosa de hidróxido de sódio 0,10 mol L–1 com 50 mL de solução aquosa de ácido sulfúrico. Nessa reação, há formação de sal e água.
Admitindo como desprezível a expansão de volume como resultado dessa reação, calcule a concentração em mol.L-1 do ácido utilizado nesta titulação.
21 - (Unievangélica GO/2015)
Leia o rótulo de determinado soro fisiológico no destaque.
Solução fisiológica de cloreto de sódio a 0,9% e densidade 1g/mL

De acordo com as especificações do rótulo e considerando condições ambientes, calcule a concentração comum desta solução.
22 –(Unimontes MG)
A densidade é uma propriedade física muito utilizada na caracterização das substâncias, principalmente nas misturas. Nesse caso, a densidade depende da proporção dos constituintes da mistura. Sabe-se que a densidade de uma solução de KCl em água, 5,00 % em massa, é 1,043 g/mL. A partir desses dados, calcule a concentração em mol/L do KCl nessa solução . K = 39 Cl = 35,5
23 – (MACK SP/2014)
Na neutralização de 30 mL de uma solução de soda cáustica (hidróxido de sódio comercial), foram gastos 20 mL de uma solução 0,5 mol/L de ácido sulfúrico, até a mudança de coloração de um indicador ácido-base adequado para a faixa de pH do ponto de viragem desse processo. Determine a concentração em mol/L da soda cáustica.
24 – (UNIFOR CE)
Gás natural veicular (GNV) é um combustível disponibilizado na forma gasosa, a cada dia mais utilizado em automóveis como alternativa à gasolina e ao álcool. O GNV diferencia-se do gás liquefeito de petróleo (GLP) por ser constituído por hidrocarbonetos na faixa do metano e do etano, enquanto o GLP possui em sua formação hidrocarbonetos na faixa do propano e do butano.
Usando os dados fornecidos, e sabendo que é um tanque típico de GNV ( formado exclusivamente por metano ( CH4 )), calcule a variação de entalpia (ΔH ) produzido na queima total de um tanque de GNV (CH4) ? Dados: CH4 = - 75 kJ/mol , CO2 = - 394 kJ/mol , H2O = - 286 Kj/mol
25 - (Mackenzie SP/2014)
Na neutralização de 30 mL de uma solução de soda cáustica (hidróxido de sódio comercial), foram gastos 20 mL de uma solução 0,5 mol/L de ácido sulfúrico, até a mudança de coloração de um indicador ácido-base adequado para a faixa de pH do ponto de viragem desse processo. Desse modo, é correto afirmar que as concentrações molares da amostra de soda cáustica e do sal formado nessa reação de neutralização são, respectivamente,
a) 0,01 mol/L e 0,20 mol/L. b) 0,01 mol/L e 0,02 mol/L. c) 0,02 mol/L e 0,02 mol/L.
d) 0,66 mol/L e 0,20 mol/L. e) 0,66 mol/L e 0,02 mol/L.
26 - (Unicastelo SP/2014)
No laboratório de um hospital, uma amostra de 10,0 mL de suco gástrico, obtida 8 horas após um paciente ter ingerido caldo de legumes, foi titulada com NaOH 0,1 mol/L, consumindo 7,2 mL da solução básica até a completa neutralização, que ocorre segundo a equação
HCl(aq) + NaCl(aq) → NaCl(aq) + H2O(l)
Afirma-se que a concentração de ácido, em mol/L, na amostra de suco gástrico analisada é de
a)0,1. b)0,36. c)0,072. d)0,036. e)0,0072.
27 - (PUC MG/2014)
20 mL de HCl 0,5 mol L–1 foram neutralizados por 10 mL de solução aquosa de NaOH. Qual foi a concentração dessa solução?
a)0,1 mol L–1 b)0,5 mol L–1 c)1,0 mol L–1 d)2,0 mol L–1
28 - (IME RJ)
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
a) 3,65 x 10–3 g/cm3 b)7,30 x 10–3 g/cm3 c)4,00 x 10–3 g/cm3
d) 3,20 x 10–3 g/cm3 e)2,00 x 10–3 g/cm3
29 - (UERN/2015)
Também denominado anidrido sulfúrico ou óxido sulfúrico, o trióxido de enxofre é um composto inorgânico, representado pela fórmula química SO3, é gasoso, incolor, irritante, reage violentamente com a água, é instável e corrosivo. O trióxido de enxofre é obtido por meio da oxidação do dióxido de enxofre, tendo o pentóxido de vanádio como catalisador da reação realizada pelo método de contato. Observe:
![]()
Ressalta-se que as entalpias de formação, em kJ/mol, do SO2 e SO3 são, respectivamente, –297 e –420. A entalpia de combustão de 12,8 gramas, em kJ, do dióxido de enxofre é igual a
a) –123. b)+123. c)–24,6. d)+24,6.
30 - (UDESC SC/2014)
A indústria siderúrgica utiliza-se da redução de minério de ferro para obter o ferro fundido, que é empregado na obtenção de aço. A reação de obtenção do ferro fundido é representada pela reação:
Fe2O3 + 3CO → 2 Fe + 3CO2
Dados: Entalpia de formação (ΔHof) a 25ºC, kJ/mol.
![]()
A entalpia de reação (ΔHor) a 25ºC é:
a)24,8 kJ/mol b)–24,8 kJ/mol c)541,2 kJ/mol d)–541,2 kJ/mol e)1328,2 kJ/mol
31 - (Unimontes MG/2014)
O bicarbonato pode ser utilizado para apagar pequenos incêndios, em função da liberação de gás carbônico, conforme a equação:
2NaHCO3 (s) ![]() Na2CO3(s) + H2O(l) + CO2 (g).
Na2CO3(s) + H2O(l) + CO2 (g).
Utilizando os dados de entalpia padrão de formação dessas substâncias,
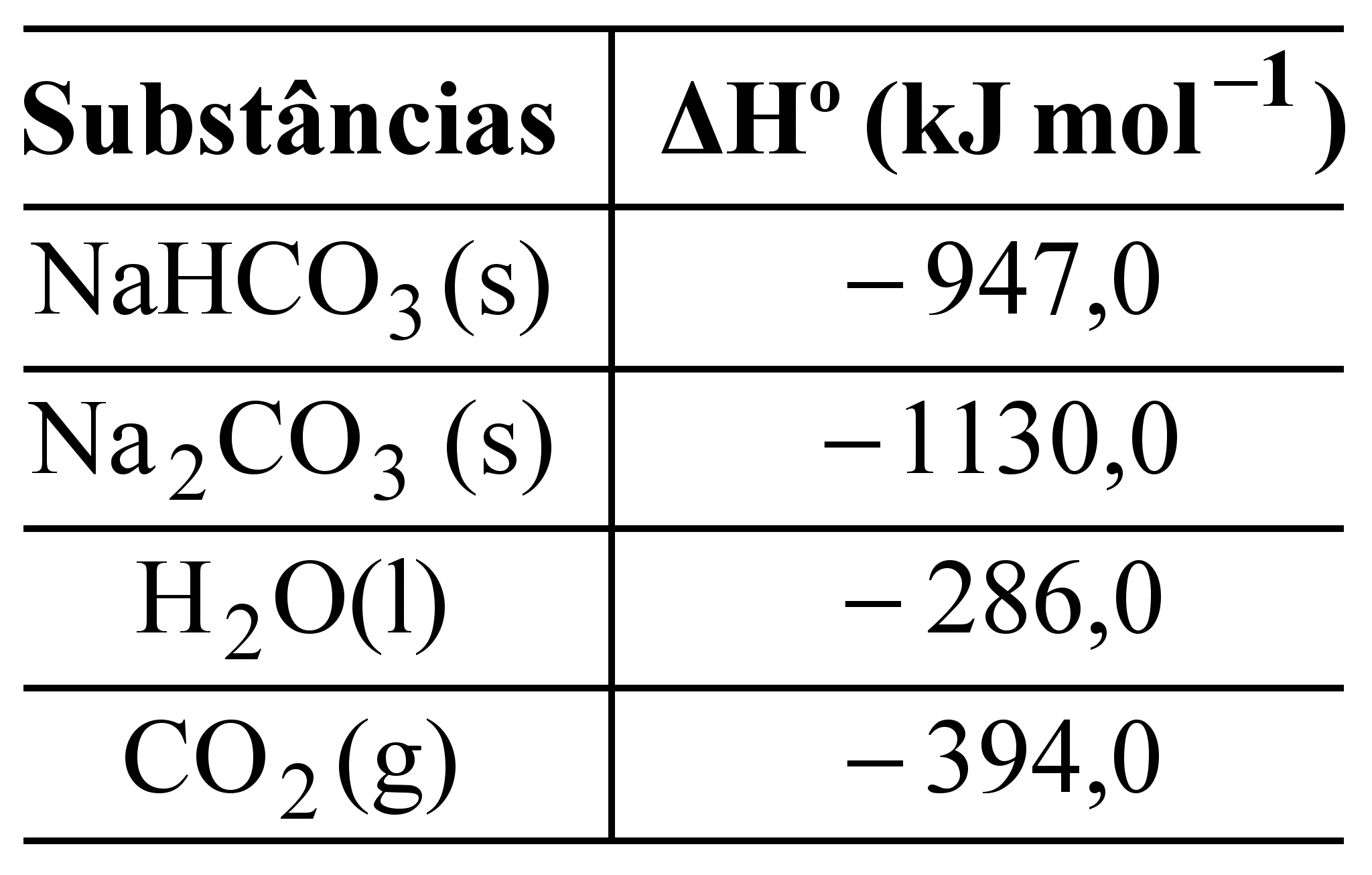
pode-se afirmar que a reação é
a)exotérmica e apresenta valor de ΔHo = – 84 kJ. b)endotérmica e apresenta valor de ΔHo = 84 kJ.
c)endotérmica e apresenta valor de ΔHo = 680 kJ. d)exotérmica e apresenta valor de ΔHo = – 680 kJ.
32 - (Fac. Santa Marcelina SP/2013)
Nos laboratórios de anatomia das universidades de medicina, as peças humanas podem ser conservadas em tanques contendo solução de formol.

A entalpia de combustão completa do formol, em kJ/mol, é igual a
a)– 571. b)+ 217. c)– 789. d) – 217. e) + 571.
33 - (UEPB/2013)
O acetileno (etino) é um gás que, ao ser queimado, atinge altas temperaturas e, por isso, tem aplicação em processos de soldas de metais. Esse gás pode ser produzido industrialmente a partir do etano, conforme a equação:
C2H6 (g) → C2H2 (g) + 2H2 (g)
A tabela a seguir apresenta alguns valores de entalpias padrão de formação:
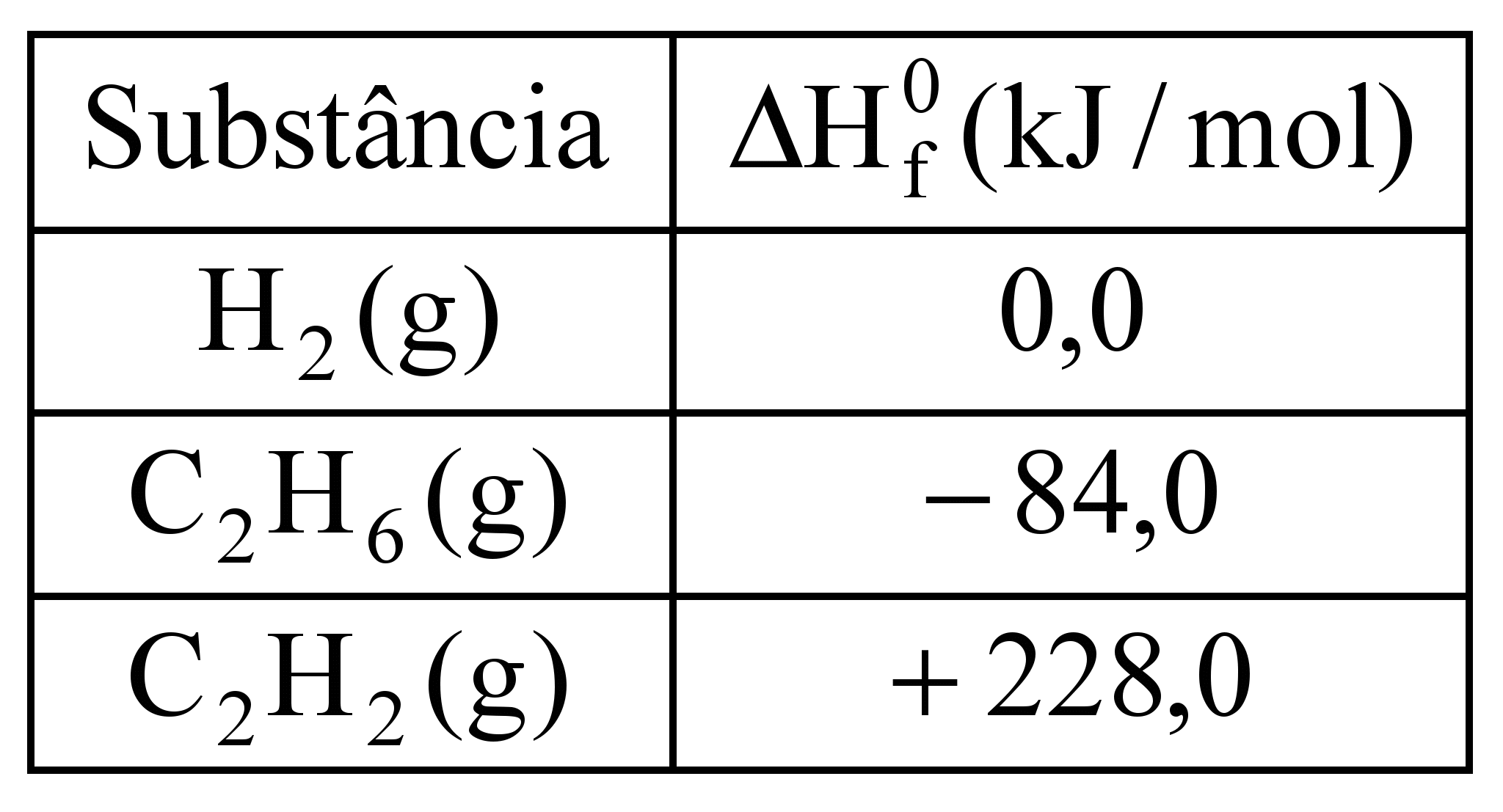
A partir da equação e dos valores apresentados na tabela, é correto afirmar que ΔH dessa reação é:
a)–312,0 kJ/mol b)+312,0 kJ/mol c)+144,0 kJ/mol d)–144,0 kJ/mol e) +228 kJ/mol
34 - (ESCS DF/2014)
Os carboidratos são a principal fonte de energia para o organismo humano. A reação global de conversão dos açúcares em energia pode ser representada pela equação abaixo.
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l) + energia
As formas abertas dos monossacarídeos podem sofrer ciclização. A depender do lado em que ocorre o ataque nucleofílico da hidroxila sobre o carbono da carbonila, a ciclização resulta em dois isômeros diferentes.
Entalpias padrão de formação (ΔH0f) a 25 ºC
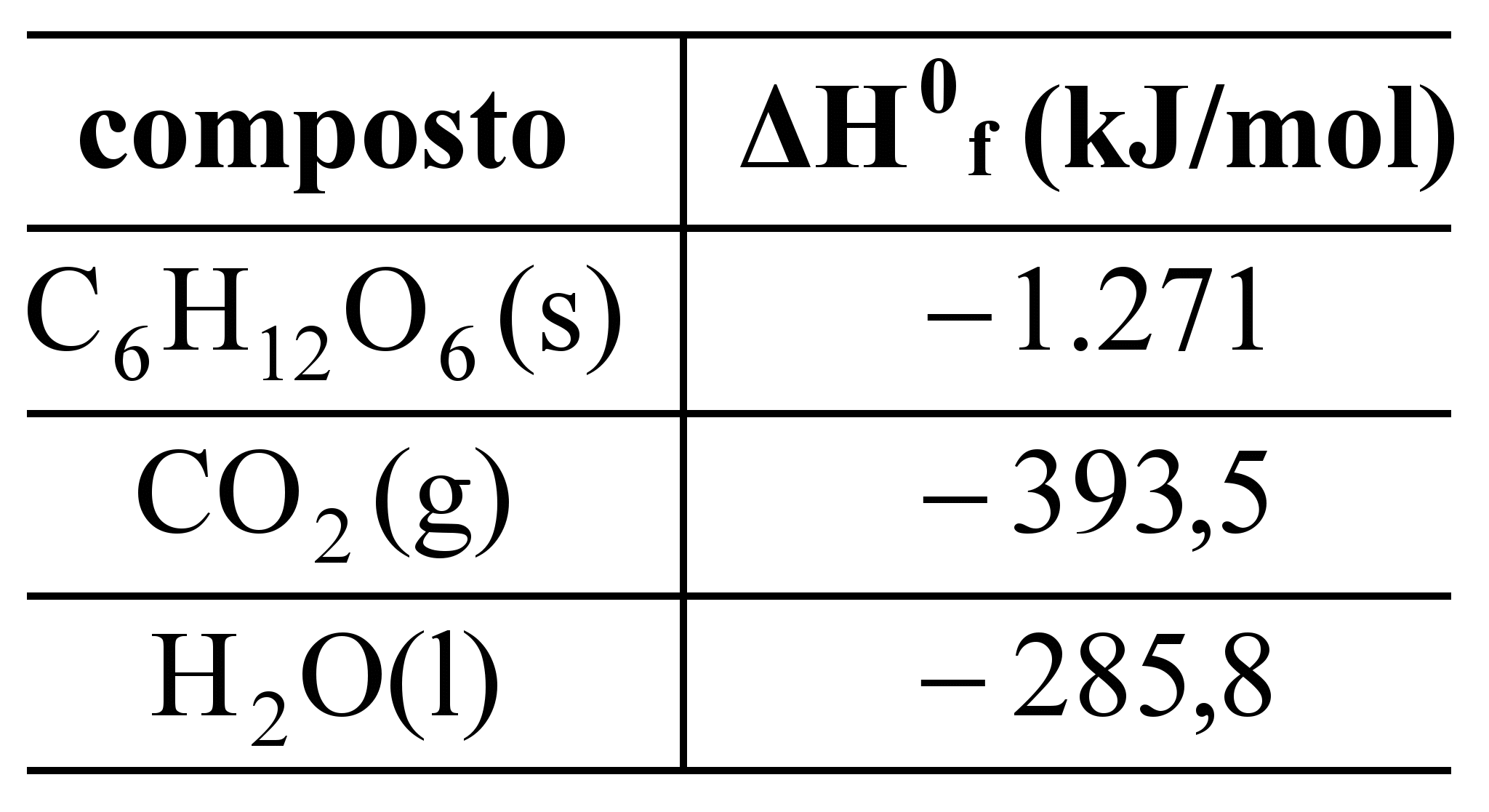
Com base nas entalpias padrão de formação apresentadas na tabela acima, assinale a opção que corresponde ao valor da entalpia padrão de combustão da glicose a 25 ºC.
a)–2.209 kJ/mol b)–2.604 kJ/mol c)–2.805 kJ/mol d)–1.508 kJ/mol
35 - (Fac. Cultura Inglesa SP/2015)
Soluções aquosas de hidróxido de amônio, NH4OH (aq), são empregadas na indústria têxtil e agrícola, no tratamento de efluentes e na limpeza doméstica.
(http://www.infoescola.com. Adaptado.)
Uma solução aquosa de hidróxido de amônio para uso em limpeza doméstica tem concentração de 8% em m/v, e admitindo que esta solução possui densidadeigual a 1g/cm3, é correto afirmar que a concentração aproximada, em mol/L, da solução de NH4OH para limpeza doméstica é
a)0,2. b)0,7. c)1,2. d)2,3. e)3,5.
GABARITO:
1) A 2) C 3) B 4) A 5) E 6) – 2877,3 kJ 7) 10 mol/L 8) 1 mol/L 9)- 3924 Kj 10)D 11) A 12) C 13)B 14) A15) 15g/L 16)40 g/L 17) D 18) 0,04 mol/L 19) 10 mol 20) 0,05 mol/L 21) 9 g/L 22) 0,7 mol/L 23) 0,66 mol/L 24) – 891 kJ/mol25) D 26) C 27) C 28) B 29) C 30) B 31) B 32) A 33) B 34) C 35) D

