GABARITO E RESOLUÇÃO COMENTADA – TERMOQUÍMICA E CINÉTICA
1- A questão fornece três reações com o valor de ΔH, indicando que envolve a LEI DE HESS.
Precisamos montar apenas a reação principal, que de acordo com o texto é de formação do propano.
Lembrando: Na entalpia de formação, sempre vai formar um mol da substância, a partir de suas substâncias simples.
3 C(grafite) + 4 H2(g) → C3H8(g) ΔHº = ?
RESOLUÇÃO
Encontramos o carbono grafite na 2º equação e na mesma posição ( reagente ). Só que na principal temos 3 mols de carbono grafite, isto indica que temos que manter e multiplicar a equação II por três ,incluindo o ΔH.
Encontramos o gás hidrogênio na 3º equação e na mesma posição ( reagente ). Só que na principal temos 4 mols de gás hidrogênio, isto indica que temos que manter e multiplicar a equação III por quatro ,incluindo o ΔH.
Encontramos o gás propano na 1º equação e na posição de reagente e na principal o gás propano é produto. Portanto temos que inverter a reação, incluindo o sinal do ΔH.
II- MANTER ( X3 ): 3 C(grafite) + 3 O2(g) → 3 CO2(g) ΔHº = 3 x (–394 kJ) = –1.182 kJ
III-MANTER (X4 ): 4H2(g) + 2O2(g) → 4H2O(l) ΔHº = 4 x (–286 kJ) = –1.144 Kj
I-INVERTER :3 CO2(g) + 4 H2O(l) → C3H8(g) + 5 O2(g) ΔHº = +2.220 Kj.
3 C(grafite) + 4 H2(g) → C3H8(g) ΔHº = ?
Após cortar as substâncias que entra reagente e sai produto é só somar os respectivos valores de ΔH, vamos encontrar a resposta da questão:
ΔH = ΔH1 + ΔH2 + ΔH3 ΔH = - 1182 + ( - 1144 ) + 2220
ΔHº = –106 kJ
2-E
A questão fornece três reações com o valor de ΔH, indicando que envolve a lei de Hess.
Primeiro vamos equacionar a combustão de 1 mol de Carbono sólido, onde esta reação será a principal.
C(s) + O2 CO2(g) ΔH=?
Encontramos o carbono sólido nos produtos da 1º equação . Precisamos inverter a equação e o sinal de ΔH, para deixar na mesma posição.
O gás oxigênio aparece em mais que uma equação, portanto, não vamos mexer com esta substância.
O gás carbônico ( CO2 ) aparece na 2º equação e na posição dos produtos, indicando que não vamos mexer com ele.
Observando as equações dadas, notamos que não utilizamos a equação III, mas o ΔHfinal será a somatória dos valores de ΔH das reações. Na reação principal não temos o H2 e a H2O, isto indica que as mesmas foram cortadas. Para que isso ocorra, será necessária manter a equação III.
I – INVERTER: H2O (g) + C(s) H2(g) + CO(g) ΔH = + 150 kJ.
II – MANTER: CO (g) + ½ O2 (g) CO2 (g) ΔH = - 273 kJ.
III – MANTER: H2(g) + ½ O2 (g) H2O (g) ΔH = - 231 kJ.
C(s) + O2 CO2(g) ΔH= - 354 kJ
3- RESP:D
Dadas as equações termoquímicas com o respectivo valor de ΔH,concluímos que a questão é sobre a LEI DE HESS.
Reação principal:
2 N2 (g ) + 5 O2(g) 2 N2O5 (g) ΔH = ?
Encontramos o N2 na equação III na posição do reagente. Temos que manter e multiplicar por 4, porque na principal temos 2 mols.
O gás oxigênio aparece em mais que uma reação, portanto não vamos “mexer” com ele.
Encontramos o N2O5 na equação II, só que na posição de reagente. Isso indica que temos que inverter a reação e multiplicar por 2, porque na principal temos 2 mols.
Vamos precisar inverter a reação I , para conseguir “cortar” o H2 e a H2O que não aparecem na reação principal
RESOLUÇÃO:
 III – MANTER ( X4 ): 2 N2(g) + 6 O2 (g) +
III – MANTER ( X4 ): 2 N2(g) + 6 O2 (g) + 2 H2 (g) → 4 HNO3 (l); ΔH = 4 ( –174) Kj = -696 Kj
 II – INVERTER ( X2):
II – INVERTER ( X2): 4 HNO3 (l) → 2 N2O5 (g) + 2 H2O (l) ; ΔH = 2(+76,6) Kj = + 153,2 Kj
 I – INVERTER:
I – INVERTER: 2H2O (l) → 2 H2 (g) + O2 (g) ; ΔH = +571,5 kJ
2 N2 (g ) + 5 O2(g) 2 N2O5 (g) ΔH = ?
ΔH = - 696 + 153,2 + 571,5 = + 28,7 Kj
4- RESP: C
Dada à reação principal
![]()
ΔH = ?
Encontramos o H2 na equação II, na posição de reagente, sendo assim vamos manter a reação.
O gás O2 aparece em mais que uma reação, portanto não vamos “mexer” com este gás.
Encontramos a H2O2 na equação I, na posição de reagente, isto indica que temos que inverter a reação e o sinal de ΔH .
RESOLUÇÃO
II – MANTER : ½ O2 (g) + H2(g) H2O(L)
ΔH = - 286 kJ
I – INVERTER: ½ O2(g) + H2O(L) H2O2(L)
ΔH = +98,0 kJ
![]()
ΔH = ?
ΔH = - 286 + 98 = - 188 kJ
5- RESP: E
Nesta questão envolvendo a LEI DE HESS, foi dada a condição de escrever a reação principal, pois ele informa que é a transformação de carbono grafite em carbono diamante.
C(grafite) C(diamante) ΔH = ?
RESOLUÇÃO
Encontramos o carbono grafite na equação I, na posição de reagente, indicando que não precisamos alterar esta equação.
Encontramos o carbono diamante na equação II, na posição de reagente, mostrando que precisamos inverter a equação e o valor de ΔH
 I- MANTER: C(grafite) +
I- MANTER: C(grafite) + O2 (g) → CO2 (g) ΔH = – 94,06 kcal.mol–1
 II – INVERTER:
II – INVERTER: CO2 (g) → C(diamante) + O2 (g) ΔH = + 94,51 kcal.mol–1
C(grafite) C(diamante) H = ?
ΔH = - 94,06 + 94,51 = + 0,45 kcal/mol
I –ERRADA. A variação de entalpia tem sinal positivo.
II- CORRETA. A combustão do carbono diamante libera 0,45 Kj a mais.
III- ERRADA. A reação é exotérmica nos dois processos H<0.
7-RESP: B
A questão forneceu a reação principal:
C2H2(g) + 2 H2(g) → C2H6(g) ΔH = ?
Encontramos o C2H2 na equação I, e está na posição de reagente.
Encontramos o H2 na equação III, na posição de reagente, porém temos que multiplicar por 2 para ficar igual a principal.
Encontramos o C2H6 na equação II, na posição de reagente, isto indica que temos que inverter a reação e o sinal de ΔH .
RESOLUÇÃO
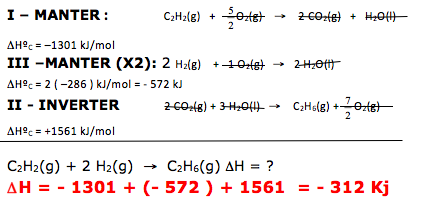
8- RESP: D
Verificando os dados, notamos que temos a energia para cada mol de ligação, indicando que a questão deve ser resolvida utilizando a somatória das entalpias.
A partir do enunciado temos o valor de ΔH= - 154 Kj.
A questão pede para calcular o valor da ligação C = C.
DICA: Os reagentes possuem entalpia positiva(quebra ligações) e os produtos possuem sinal negativo (ligações formadas).
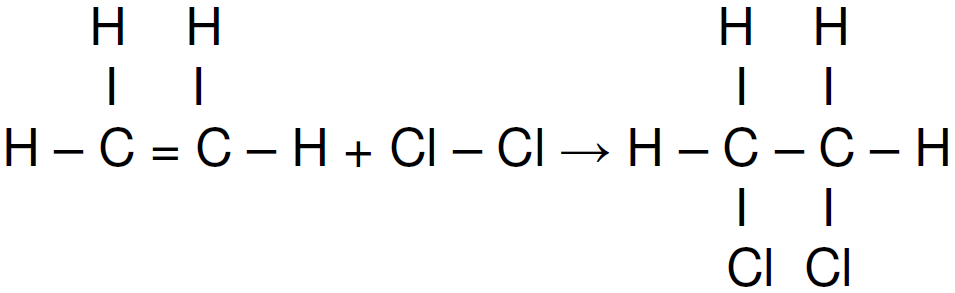
ΔH = H1 + H2 + H3 + H4 + .....
- 154 = X + 243 + (-347 ) + 2(-331) =
- 154 = X + 243 – 347 – 662
- X = 243 – 347 – 662 + 154
- X = -612 X = 612 Kj/mol
9- RESP:B
A questão fornece a reação e os valores de entalpia de cada substância. Para resolver esta questão vamosutilizar a fórmula ΔH = HP - HR
Obs:HP = ENTALPIA DOS PRODUTOS.
HR = ENTALPIA DOS REAGENTES.
CH4(g) + 3 F2(g) → CHF3(g) + 3 HF(g).
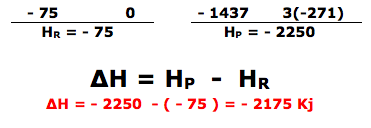
10 – RESP: D
De acordo com os dados , trata-se de energia de ligação.
Para facilitar a resolução, vamos determinar a quantidade de ligações existentes.
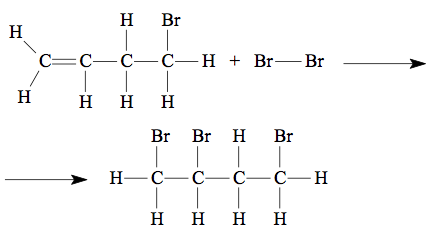
No reagentes temos:
- ligação C – H = 7 , C = C = 1 , C – C = 2 , C – Br = 1 e Br – Br = 1 .
Nos produtos temos:
- ligação C – H = 7 , C – C = 3, C- Br = 3
RESOLUÇÃO
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 7(413) + 614 + 2(347) + 281 +193 + 7(-413) +3 (-347) + 3(-281) =
ΔH = 614 +694 + 281 + 193 – 1041 – 843 =
ΔH = - 102 Kj
11- RESP: A
De acordo com os dados, trata-se de energia de ligação, conforme informação do enunciado, temos que balancear a equação.
1 C3H8 + 5 O23 CO2 + 4 H2O ΔH =?
Agora vamos abrir a reação para facilitar a visualização das ligações.
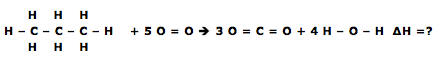
NOTA: a representação da água é angular, apenas colocamos linear para facilitar a visualização.
No reagentes temos:
- ligação C – H = 8 , C – C = 2 e O = O = 5
Nos produtos temos:
- ligação O – H = 8 e C = O = 6
RESOLUÇÃO:
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 8 (413 ) + 2(348) + 5(498) + 6(-744) + 8(-462) =
ΔH = 3304 + 696 + 2490 – 4464 -3696 =
ΔH = - 1670 Kj
12 – RESP: C
De acordo com os dados, trata-se de energia de ligação.
Agora vamos abrir a reação para facilitar a visualização das ligações.
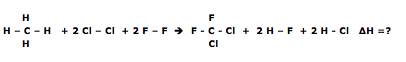
No reagentes temos:
- ligação C – H = 4 , Cl – Cl = 2 e F = F = 2
Nos produtos temos:
- ligação C – F = 2 ; C - Cl = 2 ; H – F = 2 ; H – Cl = 2
RESOLUÇÃO
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 4(413) + 2(239) + 2(154) + 2(-485) + 2(-339) + 2 (-565) + 2 (-427) =
ΔH = 1652 + 478 + 308 - 970 -678 – 1130 – 854 =
ΔH = - 1194 Kj
13 – RESP: B
De acordo com os dados, trata-se de energia de ligação, conforme informação do enunciado, temos que equacionar a reação de combustão total do butano. A combustão total de hidrocarboneto produz gás carbônico e água
1 C4H10 + 13/2 O24 CO2 + 5 H2O ΔH =?
Agora vamos abrir a reação para facilitar a visualização das ligações.
H H H H
H – C – C – C – C - H + 13/2 O = O 4 O = C = O + 5 H – O – H ΔH =?
H H H H
NOTA: a representação da água é angular, apenas colocamos linear para facilitar a visualização.
No reagentes temos:
- ligação C – H = 10 , C – C = 3 e O = O = 6,5
Nos produtos temos:
- ligação O – H = 10 e C = O = 8
RESOLUÇÃO
DICA: Nos reagentes a entalpia tem valor positivo e nos produtos tem entalpia negativa.
ΔH = 10(412) + 3(348) + 6,5(484 ) + 8(-743) + 10(-463) =
ΔH = 4120 + 1044 + 3146 -5944 – 4630 =
ΔH = - 2264 Kj
14 – RESOLUÇÃO
A questão é sobre velocidade de reação, onde a mesma pede para determinar a equação da velocidade.
Dica : A equação da velocidade é escrita em função dos reagentes. Quando a reação ocorre em várias etapas (tem uma tabela ou gráfico ), indica que a mesma não é elementar e não temos os expoentes(necessário calcular ). O expoente é a ordem. A ordem da reação será a soma dos expoentes.
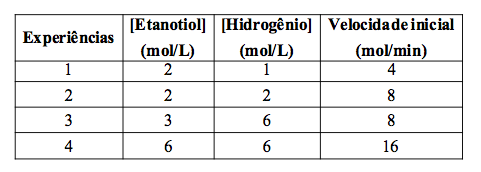
V = k [ etanotiol]x [hidrogênio]y
A reação não é elementar. Temos que encontrar o valor de x e de y que são os expoentes.
Para determinar o y, vamos deixar o x constante. Encontramos esta situação no experimento 1 e 2, onde notamos que a concentração do etanotiol permanece constante e a concentração de hidrogênio dobra, ocorrendo o mesmo com a velocidade
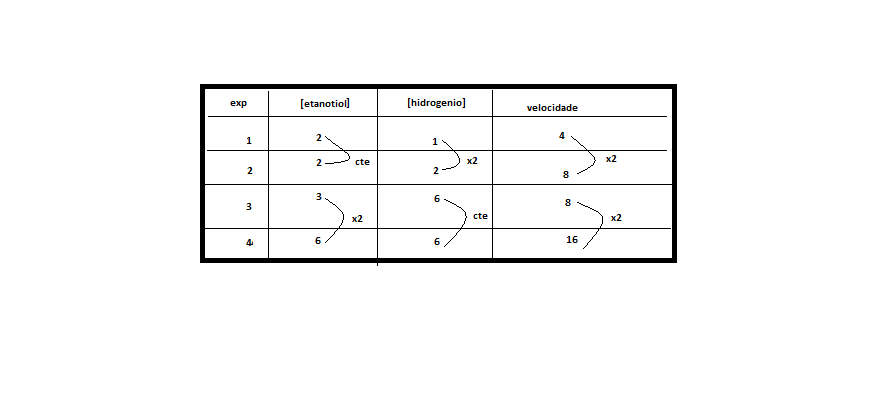
Vamos dividir v2/v1 para cortar o x e encontrar o valor de y
8 = k [2]x [2]y
4 = k [2]x [1]y
2 = 2y y = 1
Para determinar o X, vamos deixar o Y constante. Encontramos esta situação no experimento 3 e 4, onde notamos que a concentração do [H2] permanece constante e a concentração de [etanotiol] dobra, e a velocidade também dobra.
Vamos dividir v4/v3 para cortar o y e encontrar o valor de x
16 = k [6]x [6]y
8 = k [3]x [6]y
2 = 2x x = 1
PORTANTO A LEI DA VELOCIDADE É
a) V = k [ etanotiol]1 [hidrogênio]1
E ORDEM IGUAL A 2 ( SOMA DOS EXPOENTES).
b) C2H5SH(g) + H2(g) → C2H6(g) + H2S(g)
1 mol -------------------------- 34 g
10 mol ................................ x
X = 340 g/s
15 – RESP: B
A questão é sobre velocidade de reação, onde a mesma foi dada.
V = k [ A]2 [B]1
A questão (este tipo de questão) não forneceu a concentração molar inicial. Para facilitar os cálculos vamos admitir que a concentração inicial dos reagentes fosse de 1 mol/L ( poderia ser qualquer número. Escolhemos o 1 mol/L para ficar mais fácil de verificar quantas vezes aumentou ou diminuiu ) e calcular a velocidade inicial.
No início temos:
V = k [ 1]2 [1]1 V = 1K
Depois temos:
- concentração de A foi triplicada [ 3 ].
-concentração de B foi duplicada [2 ]
V = k [ 3]2 [2]1 V = 18K
O NOVO VALOR DA VELOCIDADE SERÁ 18 VEZES MAIOR.
16- RESP: B
A questão é sobre velocidade de reação, onde a mesma pede para determinar a equação da velocidade.
Dica : A equação da velocidade é escrita em função dos reagentes. Quando a reação ocorre em várias etapas (tem uma tabela ou gráfico ), indica que a mesma não é elementar e não temos os expoentes(necessário calcular ).
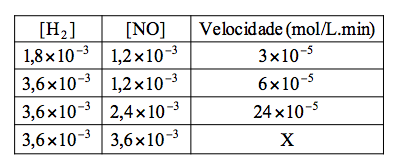
V = k [H2]x [NO]y
RESOLUÇÃO
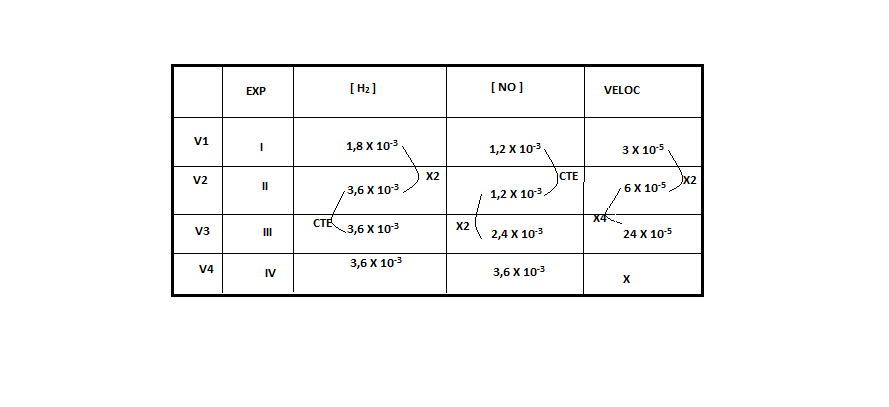
A reação não é elementar. Temos que encontrar o valor de x e de y que são os expoentes.
Para determinar o X, vamos deixar o Y constante. Encontramos esta situação no experimento 1 e 2, onde notamos que a concentração do [NO] permanece constante e a concentração de [H2] dobra, ocorrendo o mesmo com a velocidade
Vamos dividir v2/v1 para cortar o Y e encontrar o valor de X
6 X 10-5 = k [3,6 X 10-3]x [1,2 X 10-3]y
3 X 10-5 = k [1,8 X 10-3]x [1,2 X 10-3]y
2 = 2X X = 1
Para determinar o Y, vamos deixar o X constante. Encontramos esta situação no experimento 2 e 3, onde notamos que a concentração do [H2] permanece constante e a concentração de [NO] dobra, e a velocidade aumenta 4 vezes.
Vamos dividir v3/v2 para cortar o x e encontrar o valor de y
24 X 10-5 = k [3,6 X 10-3]x [2,4 X 10-3]y
6 X 10-5 = k [3,6 X 10-3]x [1,2 X 10-3]y
4 = 2Y Y = 2
PORTANTO A EQUAÇÃO DA VELOCIDADE É
V = k [H2]1 [NO]2
Para encontrar o valor da velocidade, primeiro temos que encontrar o valor da constante k.
DICA: Sempre calcular o valor da constante k, utilizando a etapa mais lenta ( menor velocidade ).
V = k [H2]1 [NO]2
3 x 10-5 = k (1,8 x 10-3 ) (1,2 x 10-3 )2 .
K = 11574,07
Calculo da velocidade ( x ). Agora temos que utilizar os dados da concentração de [H2] e [ NO ] na linha do x.
V = k [H2]1 [NO]2
V = 11574,03 (3,6 X 10-3) (3,6 X 10-3)2
V = 54 X 10-5
17 – RESP: C
RESOLUÇÃO
Para determinar o Y, vamos deixar o X constante. Encontramos esta situação no experimento 1 e 3, onde notamos que a concentração do [NO] permanece constante e a concentração de [H2] dobra, e a velocidade aumenta 2 vezes.
V = k [NO]X[H2]Y
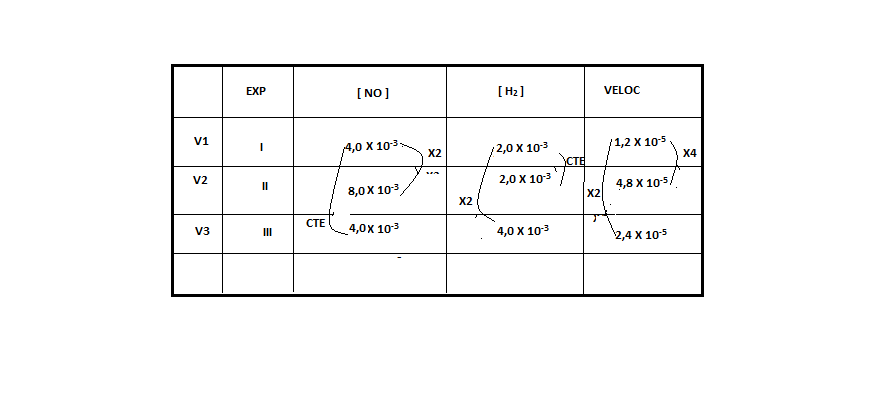
Vamos dividir v3/v1 para cortar o x e encontrar o valor de y
2,4 X 10-5 = k [4,0 X 10-3]x [4,0 X 10-3]y
1,2 X 10-5 = k [4,0 X 10-3]x [2,0 X 10-3]y
2 = 2Y Y = 1
Para determinar o x, vamos deixar o y constante. Encontramos esta situação no experimento 1 e 2, onde notamos que a concentração do [H2] permanece constante e a concentração de [NO] dobra, e a velocidade aumenta 4 vezes.
Vamos dividir v2/v1 para cortar o Y e encontrar o valor de X
4,8 X 10-5 = k [8,0 X 10-3]x [2,0 X 10-3]y
1,2 X 10-5 = k [4,0 X 10-3]x [2,0 X 10-3]y
4 = 2X X = 2
TEMOS : V = k [NO]2[H2]1
18- RESP: C
Para determinar o x, vamos deixar o y constante. Encontramos esta situação no experimento 2 e 3, onde notamos que a concentração de [B] permanece constante e a concentração de [A] divide por 2, e a velocidade também divide por dois.
IMPORTANTE:Temos que utilizar na mesma temperatura, pois a constante k sofre variação com a temperatura.
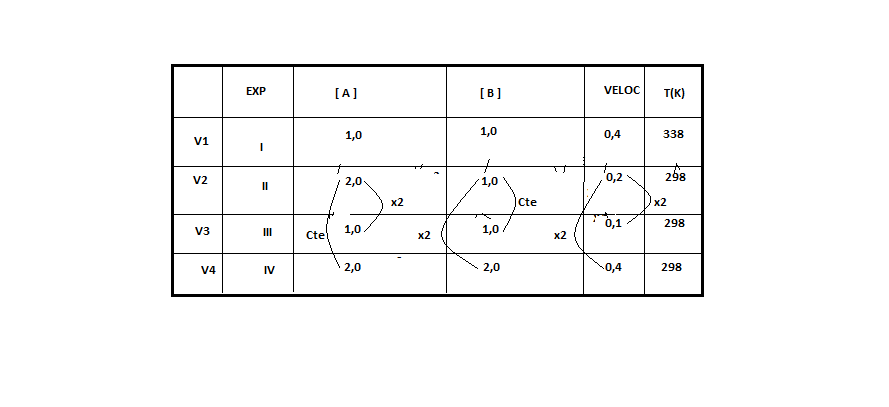
V = k [A]X[B]Y
Vamos dividir v2/v3 para cortar o Y e encontrar o valor de X
0,2 = k [2,0]x [1,0]y
0,1 = k [1,0]x [1,0]y
2 = 2X X = 1
Para determinar o y, vamos deixar o x constante. Encontramos esta situação no experimento 4 e 2, onde notamos que a concentração de [A] permanece constante e a concentração de [B] dobra 2, e a velocidade também dobra.
Vamos dividir v4/v2 para cortar o x e encontrar o valor de y
Obs: dividimos o maior pelo menor apenas para facilitar os cálculos.
0,4 = k [2,0]x [2,0]y
0,2 = k [2,0]x [1,0]y
2 = 2y y = 1
TEMOS: V = k [A]1[B]1
Interpretando a as informações temos:
I – FALSA. O valor de K não será constante em todas as reações, pois ocorreu variação da temperatura no primeiro experimento.
II – VERDADEIRA. Conforme calculamos encontramos que V = k [A]1[B]1
III- VERDADEIRA. A ordem da reação é dada pela soma dos expoentes.
IV – FALSA. Conforme os cálculos acima temos que os reagentes A e B possuem ordem 1 e 1.
19 – RESP: B
Para determinar o Y, vamos deixar o X constante. Encontramos esta situação no experimento 1 e 3, onde notamos que a concentração do [NO] permanece constante e a concentração de [O2] aumenta 4 vezes, e a velocidade também aumenta 4 vezes.
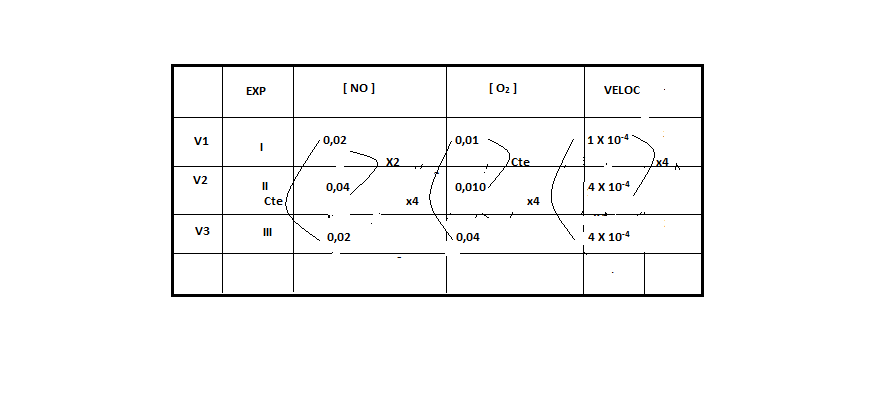
V = k [NO]X[O2]Y
Vamos dividir v3/v1 para cortar o x e encontrar o valor de y
Obs: dividimos o maior pelo menor apenas para facilitar os cálculos.
4 x 10-4 = k [0,02]x [0,04]y
1,0 x 10-4 = k [0,02]x [0,01]y
4 = 4y y = 1
Vamos dividir v2/v1 para cortar o y e encontrar o valor de x
Obs: dividimos o maior pelo menor apenas para facilitar os cálculos.
4 x 10-4 = k [0,04]x [0,01]y
1,0 x 10-4 = k [0,02]x [0,01]y
4 = 2x x = 2
TEMOS:
V = k [NO]2[O2]1ORDEM DA REAÇÃO IGUAL A 3
OBS: A ordem global da reação é a soma dos expoentes.
20 – RESP: D
A questão fornece a reação : A2 + B2 → 2 AB
HCA = 60 Kj.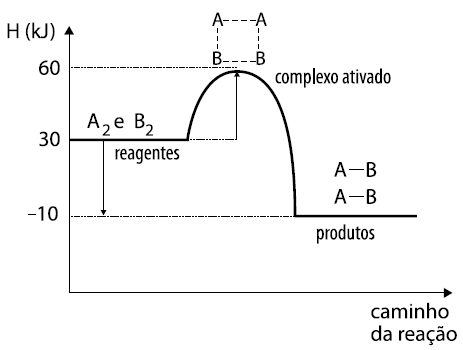
HR = 30 Kj.
HP = - 10 Kj.
OBSERVAÇÕES IMPORTANTES:
HCA = Entalpia do complexo ativado.
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = -10 – 30 ΔH = - 40 kJ ( EXOTÉRMICA ).
Ea = HCA - HR Ea = 60 – 30 Ea = 30 Kj ( reação direta).
Ea = HCA - HR Ea = 60 – (-10) Ea = 70 Kj ( reação inversa)
RESPOSTA CORRETA : D
21- RESP: D
A questão informa que a reação é: A + B C + D
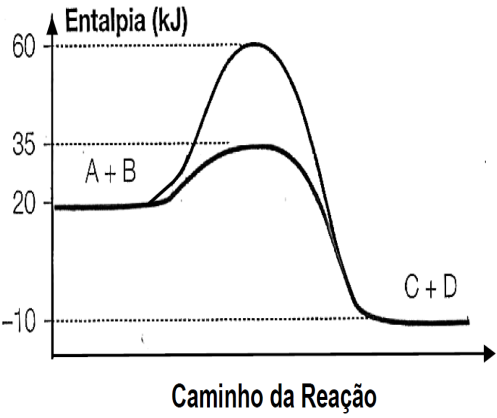
HCA = 60 Kj ( sem catalisador).
HCA = 35 Kj ( com catalisador).
HR = 20 Kj.
HP = - 10 Kj.
HCA = Entalpia do complexo ativado.
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = -10 – 20 ΔH = - 30 kJ ( EXOTÉRMICA ).
Ea = HCA - HR Ea = 60 – 20 Ea = 30 Kj ( sem catalisador).
Ea = HCA - HR Ea = 35 – 20 Ea = 15 Kj ( com catalisador).
22 – RESP: D
De acordo com o gráfico temos:
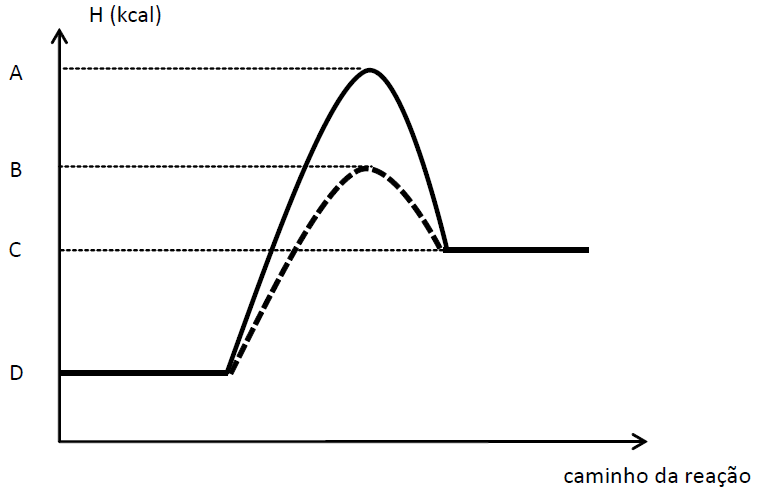
A = HCA sem catalisador
B = HCA com catalisador
C = HP Entalpia dos produtos
D = HR Entalpia dos reagentes
Obs: sabemos que os reagentes é o D, porque uma reação ocorre no sentido direto ( esquerda para a direita ) conforme o gráfico, que informa o caminho da reação.
PORTANTO:
A – B representa o abaixamento provocado pelo catalisador.
A – D representa a energia de ativação do processo não catalisado pois: Ea = HCA - HR
C – D representa a variação de entalpia
PORTANTO A RESPOSTA INCORRETA É A D
23 – RESOLUÇÃO
Através do gráfico temos:
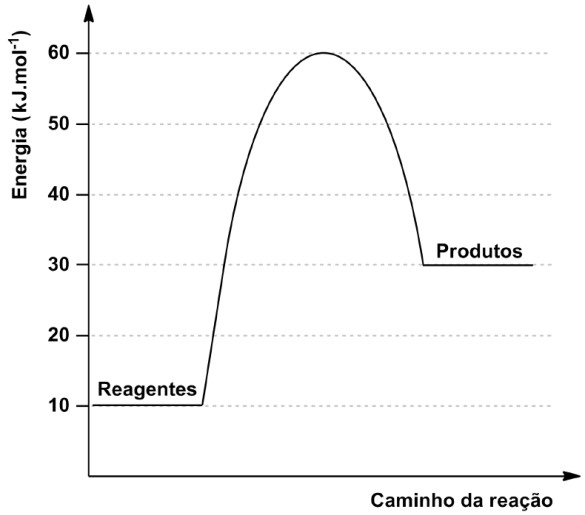
HCA = 60 Kj
HR = 10 Kj.
HP = 30 Kj.
HCA = Entalpia do complexo ativado.
HR = Entalpia dos reagentes.
HP = Entalpia dos produtos.
ΔH = HP – HR , onde ΔH>0 (ENDO) e ΔH<0 (EXO ).
ΔH = 30 – 10 ΔH = + 20 kJ ( ENDOTÉRMICA ).
Ea = HCA - HR Ea = 60 – 10 Ea = 50 Kj
24 – RESP:B
I – CERTO. Para determinar corretamente será necessário o mesmo estado de agregação ou a mesma temperatura.
II – ERRADO. A mudança de temperatura, não define que a mesma caia pela metade ou dobre. O aumento de temperatura, aumenta a energia cinética das moléculas, aumentando a velocidade da reação, pois ocorre o aumento de colisões efetivas.
III – CERTO. Quanto maior a temperatura, maior o número de colisões efetivas e maior a velocidade da reação. O aumento da superfície de contato, facilita a reação do sólido.
Concluímos que o aluno errou apenas na afirmação II
25 – RESOLUÇÃO:
Dado o diagrama notamos que:
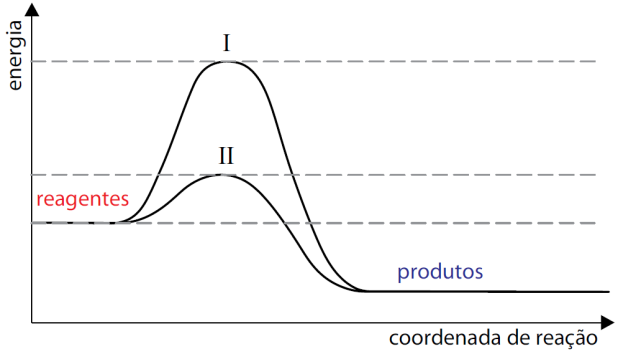
I = HCA sem catalisador
II = HCA com catalisador
HP Entalpia dos produtos
HR Entalpia dos reagentes
A curva II representa a reação na presença de catalisador. Quanto menor a energia de ativação ( dada aos reagentes até atingir o complexo ativado), maior a velocidade da reação.
O catalisador não interfere na variação de entalpia, pois a mesma é calculada pela diferença entre a entalpia dos produtos e entalpia dos reagentes, na presença ou não do catalisador.

