Resolução da Lista de Exercícios 1 - Parte 1
1 – RESP: D
Quando adicionamos sal/e ou álcool à mistura gelo/água, estamos aumentando o número de partículas. E quanto maior o número de partículas, menor será o ponto de congelamento. Portanto a resposta correta é a alternativa D.
2- RESP: A
D e acordo com o texto o NaCl ( cloreto de sódio ), quando adicionado, diminui a temperatura de congelamento. O NaCl é um composto iônico que quando sofre dissociação:
1 NaCl 1 Na+ + 1 Cl- ( possui 2 mols de íons = i ( fator de Van´t Hoff ).
Para produzir o mesmo efeito do cloreto de sódio, temos que utilizar uma substância que provoque o mesmo efeito do NaCl. Como ele não falou nada sobre as concentrações, admitimos que todas são iguais, portanto o que irá fazer a diferença entre elas é o fator de Van´t Hoff.
Na alternativa A temos o cloreto de potássio ( KCl ).
1 KCl 1 K+ + 1 Cl- ( possui 2 mols de íons = i ).
Na alternativa B temos o cloreto de cálcio ( CaCl2 ).
Nas alternativas C e D, temos a glicose ( C6H12O6 ) e sacarose ( C12H22O11), que são compostos moleculares e não dissociam ou ionizam.
Concluímos que o soluto que pode provocar o mesmo efeito do cloreto de sódio é o cloreto de potássio ( KCl ) que possui o mesmo valor de i.
3- RESP: A
O texto afirma que a adição do etilenoglicol diminui a temperatura de congelamento da água.
Este é um efeito coligativo denominado de criometria, pois quanto maior o número de partículas, menor será a temperatura de congelamento do líquido. A água pura congela o 0 ºC, adicionando o etilenoglicol, aumenta a o número de partículas, fazendo com que a água congele a uma temperatura menor (abaixo )que zero ( 0 ºC ).
4 - Em uma primeira etapa, deve-se congelar a solução contendo água e café, à pressão constante. Em uma segunda etapa, mantém-se a temperatura constante, diminui-se a pressão, de modo a manter as propriedades do pó solúvel. A água, de acordo com o gráfico, sofrerá sublimação, restando o pó outrora solubilizado em água. Lembramos que a água sublima a uma pressão abaixo do ponto triplo ( os três estados físicos em equilíbrio ).
5- RESP: D
Através do enunciado, temos a água pura com temperatura de ebulição igual a 100 ºC, uma solução de glicose ( C6H12O6 ) 3 mol/L que é molecular e não sofre dissociação. Temos também uma solução de cloreto de cálcio ( CaCl2 ) 1mol.L- que é iônica e sofre dissociação.
1 CaCl2 1 Ca+2 + 2 Cl- ( possui 3 mols de íons = i ). Como o fator de correção (Van´t Hoff ) é igual a 3, temos o produto 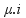 = 3 x 1 = 3 mol.L-1 .
= 3 x 1 = 3 mol.L-1 .
Obs: µ = concentração molar ( mol.L-1
Concluímos que as soluções de glicose e cloreto de cálcio possuem o mesmo número de partículas, portanto apresentam a mesma temperatura de ebulição , porém maior que a da água; pois quanto maior o número de partículas, maior será a temperatura de ebulição.
6- RESP: D
O enunciado informa que temos água pura, água do mar ( contém sais dissolvidos ) e água com açúcar ( sacarose ), na mesma pressão ( 1 atm = nível do mar ). Concluímos que a temperatura de ebulição é maior e que a temperatura de congelamento é menor em relação á água pura. Concluímos que a resposta correta é a D.
7- RESP: E
Analisando o texto, notamos que a dona de casa, consegue uma determinada temperatura utilizando o sal de cozinha ( NaCl ) que é um composto iônico e dissocia da seguinte forma:
1 NaCl 1 Na+ + 1 Cl- ( possui 2 mols de íons = i ( fator de Van´t Hoff ).
O seu marido diz que consegue o mesmo efeito, utilizando a sacarose ( C12H22O11), um composto molecular, nas mesmas condições. Para conseguir o mesmo efeito será necessário ter o mesmo número de partículas da solução de NaCl.
Primeiro vamos calcular a concentração molar do cloreto de sódio.
Dados : m = 11,7 g M = 58,5 g.mol-1 V = 2 L µ = ?
58,5 g -------------------- 1 mol
11,7 g -------------------- x
X = 11,7 x 1 / 58,5 x = 0,2 mol
Este número de mols é para 2 litros de água. Precisamos calcular para 1 ( um ) litro, pois a concentração molar é dada em mol.L-1
0,2 mol -------------------- 2 L
X --------------------- 1 L
X = 0,1 mol.L-1 de NaCl
Com o valor da concentração do cloreto de sódio, conseguimos calcular a concentração molar da sacarose
Soluto molecular C12H22O11 = soluto iônico ( NaCl )
µ = µ i
µ = 0,1 . 2
Portanto: µ = 0,2 mol.L-1 de sacarose
Determinamos a concentração molar, agora é só calcular a massa.
342 g C12H22O11 ----------------- 1 mol
X ----------------- 0,2 mol
X = 342 x 0,2 / 1 x =68,4 g em 1 litro.
Como o marido da dona de casa utilizou 2 litros é só calcular.
68,4 g ---------- 1 L
X ----------- 2 L X = 136,8 gramas de sacarose
Outra resolução.
A partir do momento que você calculou a concentração molar da sacarose ( 0,2 mol.L-1 ), podemos utilizar a fórmula abaixo:
µ = m / M . V onde µ = 0,2 mol.L-1 M = 342 g.mol-1 V = 2 L m = ?
m = 0,2 x 342 x 2 m = 136,8 g sacarose
8- RESP: A
A questão fornece o mesmo soluto e o mesmo volume para as soluções A e B. O que difere uma da outra é apenas a massa. Isto indica que a solução B com maior massa possui o maior número de partículas, maior temperatura de ebulição, menor pressão de vapor e menor temperatura de congelamento. Assim estão corretas as alternativas I e IV.
9- RESP: E
As soluções apresentam a mesma concentração molar, portanto o que difere o número de partículas é o valor de i (fator de Van´t Hoff ). Lembrando que as soluções iônicas possuem o fator de correção i (fator de Van´t Hoff).
Alternativa A,a solução de sacarose é molecular, portanto não dissocia.
Alternativa B ,o ácido etanóico é molecular, mas no meio aquoso ele ioniza.
1H3CCOOH →1 H+ +1 H3COO- i = 2 ( Nos ácidos carboxílicos, o hidrogênio ionizável é aquele ligado ao
oxigênio da carboxila.
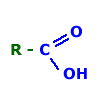 RADICAL CARBOXÍLA
RADICAL CARBOXÍLA
Alternativa C, o ácido cianídrico dissocia. 1 HCN → 1 H+1 + 1 CN-1 i = 2
Alternativa D, o hidróxido de sódio é uma base e dissocia. 1 NaOH → 1 Na+1 + 1 OH-1 i = 2
Alternativa E, o cloreto de cálcio é um sal, portanto dissocia. 1 CaCl2 → Ca+2 + 2 Cl-1 i = 3
Estando todas as soluções na mesma concentração, concluímos que aquela que apresenta o maior valor de i, tem o maior número de partículas e maior temperatura de ebulição. Lembrando que utilizamos o produto µ i (µ = concentração molar ). Sendo assim o cloreto de cálcio possui o maior valor de i ( i = 3 ).
10- RESP : A
A solução de nitrato de cálcio é iônica, portanto dissocia e tem o fator de correção (i ), denominado fator de Van´t Hoff.
Ca(NO3)2 →1 Ca+2 + 2 NO-3 3 mols de íons = i. O produto µ i = 0,2 x 3 = 0,6 mol.L-1
Para ter a mesma pressão osmótica, será necessário ter o mesmo número de partículas. A alternativa que possui um composto com a mesma concentração é a A.
Sulfato de sódio ; Na2SO4 → 2 Na+ + 1 SO4-2 = 3 mols de íons = i = µ i = 0,2 x 3 = 0,6 mol.L-1
11- RESP: E
Para separar misturas homogêneas sólido – líquido, o processo utilizado é a destilação simples, mostrada na figura 1 e na figura 2 temos a osmose reversa, que é utilizado para obter água pura, a partir da água do mar. A osmose reversa consiste na aplicação de uma pressão superior sobre a solução concentrada, para ocorrer à passagem do solvente para a solução diluída, através de uma membrana semipermeável.
12- RESP: A
As soluções isotônicas, são aquelas que apresentam a mesma pressão osmótica. Portanto possuem o mesmo número de partículas. Encontramos esta condição na alternativa A, pois a glicose (0,30 mol.L-1 ) é molecular e não dissocia. Já o cloreto de sódio 0,15 mol.L-1 é iônica e dissocia, portanto tem o fator de correção ( i ).
1 NaCl 1 Na+ + 1 Cl- ( possui 2 mols de íons = i ( fator de Van´t Hoff ).
O produto µ i = 0,15 x 2 = 0,3 mol.L-
13 – a) Dada a fórmula p = c Rti π = 7,6 atm T = 310 K C = ? R = 0,082
C = 7,6/0,082 X 310 X 2 = 0,149 mol.L-1
Temos : µ = 0,149 mol.L-1 M = 58,5 g.mol-1 d = 1000 g/L ( considerar a densidade como 1g/mL já que não foi dada) Ʈ =?
Fórmula : µ.M =Ʈd Ʈ = 0149 x 58,5 / 1000 Ʈ = 0,0087 x 100 = 0,87% (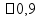 )
)
b) Sabendo que a concentração molar (µ = 0,149 mol.L-1, V = 0,5 L M = 58,5 g/mol m = ? )
0,149 mol ----------------- 1 L
X ------------------0,5 L
X = 0,0745 mol
Cálculo da massa de cloreto de sódio.
1 mol ------------- 58,5 g/mol
0,0745 mol ------------- x
X = 4,358 g 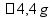
Voltar para Lista de Exercícios - Parte 1

