Lista de exercícios–Química – prof. Raimundo. 1º. Trimestre - 3º. Ens. Médio 2017
- Equilíbrio químico.
- Deslocamento de equilibrio
- pH e pOH.
- Hidrólise salina.
- Produto de solubilidade.
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Ba = 137
01 - (Fac. Israelita de C. da Saúde Albert Einstein SP/2016)
O NO, óxido nítrico, é um poluente atmosférico formado em câmaras de combustão ou devido à ação de descargas elétricas. A reação a partir dos gases nitrogênio e oxigênio pode ser representada pela equação:
N2(g) + O2(g) ![]() 2 NO(g)
2 NO(g) ![]() = 180 kJ
= 180 kJ
Sobre a formação do óxido nítrico é possível afirmar que:
I. Se a reação for realizada em recipiente rígido e fechado, mantendo-se a temperatura constante, a pressão também se manterá constante.
II. O aumento de temperatura aumenta o rendimento da formação do NO.
III. Trata-se de um processo exotérmico, pois o produto apresenta maior energia do que os reagentes.
Pode-se dizer que
a) apenas as afirmações I e II estão corretas.
b) apenas as afirmações I e III estão corretas.
c) apenas as afirmações II e III estão corretas.
d) todas as afirmações estão corretas.
02 - (FAMERP SP/2016)
Considere o equilíbrio químico representado por
C (s) + CO2 (g)![]() 2CO (g) ;
2CO (g) ; ![]() = + 88 kJ / mol de CO (g)
= + 88 kJ / mol de CO (g)
O rendimento em CO (g) desse equilíbrio aumenta com o aumento da ____________, com a diminuição da ____________ e não se altera pela adição de ____________.
As lacunas do texto são, correta e respectivamente, preenchidas por:
a) temperatura – pressão – catalisador.
b) temperatura – pressão – CO2 (g).
c) pressão – temperatura – catalisador.
d) pressão – temperatura – CO2 (g).
e) pressão – temperatura – C (s).
03 - (FUVEST SP/2016)
Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta pH 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que a solução resultante apresente pH 8 é
a) 2
b) 6
c) 10
d) 14
e) 18
04 - (UNCISAL/2016)
O uso de água sanitária é muito comum no nosso cotidiano e seu princípio ativo está baseado nas propriedades oxidantes do ânion do ácido hipocloroso, que é um ácido fraco. O hipoclorito de sódio é obtido pela eletrólise de uma solução de cloreto de sódio, onde são produzidos também gás hidrogênio e gás cloro.
Química Nova na Escola. v. 30, p. 66-69, 2008.
Com respeito à água sanitária e com base nas informações apresentadas, que alternativa traduz a condição real quanto ao seu pH e do meio em que se forma?
a) A água sanitária exibe diversas faixas de pH, podendo variar desde ácido, neutro ou básico, dependendo de como ela foi obtida.
b) No processo de obtenção da água sanitária, o meio na qual ela se forma estará ácido devido à formação de gás cloro e hidrogênio.
c) A água sanitária, além de ser oxidante, também possui características ácidas, visto que seu princípio ativo é derivado de um ácido.
d) A água sanitária apresenta propriedades oxidantes e seu pH deve ser neutro, visto que em solução aquosa o meio é neutro, não variando.
e) A água sanitária apresenta propriedades básicas porque a hidrólise prevalece e como resultado teremos uma solução com pH acima de 7,0.
05 - (Centro Universitário de Franca SP/2016)
Uma etapa importante na produção industrial de ácido sulfúrico é a obtenção do trióxido de enxofre a partir da seguinte reação:
2SO2 (g) + O2 (g)![]() 2SO3 (g)
2SO3 (g) ![]() < 0
< 0
Para aumentar o rendimento da produção de ácido sulfúrico, a formação do gás trióxido de enxofre é uma etapa crítica, sendo importante favorecer o deslocamento do equilíbrio no sentido da formação desse gás. Considere que esse sistema sofre, separadamente, as seguintes ações:
1: aumento da pressão
2: adição de um catalisador
3: aumento da concentração de oxigênio
4: aumento da temperatura
As duas ações que favorecem o rendimento da produção de ácido sulfúrico são as de números
a) 1 e 2.
b) 1 e 3.
c) 1 e 4.
d) 2 e 3.
e) 2 e 4.
06 - (UFSCAR SP/2016)
O caxiri é uma tradicional bebida alcoólica fermentada indígena produzida pelos índios (Juruna) Yudjá, habitantes do Parque Indígena do Xingu, localizado no estado do Mato Grosso. Essa bebida é preparada à base de mandioca e batata-doce, e é originalmente fermentada por micro-organismos que estão presentes nas matérias-primas utilizadas para a sua produção. (...) Observando-se as alterações físico-químicas durante a fermentação, pode-se notar uma progressiva variação de pH de 4,76 para 3,15. O etanol foi o metabólito da fermentação produzido em maior quantidade, apresentando concentração, ao final do processo fermentativo, de 83,9 g/L da bebida. (...)
A variação do pH mostra que, durante o processo fermentativo, ocorreu
a) acidificação, com aumento da concentração dos íons H+.
b) acidificação, com aumento da concentração dos íons OH–.
c) acidificação, com diminuição da concentração dos íons H+.
d) alcalinização, com diminuição da concentração dos íons OH–.
e) alcalinização, com aumento da concentração dos íons OH–.
07 - (UDESC SC/2015)
Um estudante de química obteve uma solução indicadora ácido-base, triturando no liquidificador algumas folhas de repolho roxo com água. Em seguida, ele dividiu a solução obtida em três tubos de ensaio (A, B e C) e no primeiro tubo adicionou uma pequena quantidade de vinagre (solução de ácido acético); no segundo alguns cristais de soda cáustica (NaOH), e no terceiro alguns cristais de sal para churrasco (NaCl), obtendo o resultado conforme mostra o quadro:
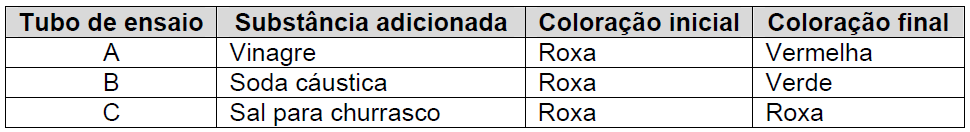
Se o estudante realizar outro experimento adicionando no tubo A KOH, no B HNO3 e no C KNO3, contendo a solução inicial extraída do repolho roxo, a coloração final, respectivamente será:
a) roxa, verde, roxa.
b) roxa, vermelha, verde.
c) verde, roxa, vermelha.
d) vermelha, verde, roxa.
e) verde, vermelha, roxa.
08 - (Unioeste PR/2015)
Os sais estão presentes em nosso cotidiano e são de suma importância para a sobrevivência dos seres humanos. Dos sais abaixo, aquele que em solução aquosa apresenta pH igual a 7 é:
a) carbonato ácido de sódio
b) sulfato de amônio
c) cianeto de potássio
d) cloreto de sódio
e) carbonato de sódio
09 - (UERN/2015)
Toda reação de neutralização de um ácido com uma base forma sal e água. Considerando a reação de ácido sulfúrico e hidróxido de zinco, pode-se obter sulfato de zinco e água. É correto afirmar que a solução aquosa desse sal é de caráter
a) ácido.
b) básico.
c) neutro.
d) anfótero.
10 - (UERN/2014)
A solubilidade do nitrato de cálcio em água e 2,0. 10–3 mol/litro em uma determinada temperatura. O Kps deste sal à mesma temperatura é:
a) 8 . 10–8.
b) 8 . 10–10.
c) 3,2 . 10–10.
d) 3,2 . 10–8.
11 - (UNESP SP/2015)
Chama-se titulação a operação de laboratório realizada com a finalidade de determinar a concentração de uma substância em determinada solução, por meio do uso de outra solução de concentração conhecida. Para tanto, adiciona-se uma solução-padrão, gota a gota, a uma solução-problema (solução contendo uma substância a ser analisada) até o término da reação, evidenciada, por exemplo, com uma substância indicadora. Uma estudante realizou uma titulação ácido-base típica, titulando 25,0 mL de uma solução aquosa de hidróxido de cálcio e gastando 20,0 mL de uma solução padrão de ácido nítrico de concentração igual a 0,10 mol · L–1.
Para preparar 200 mL da solução-padrão de concentração 0,10 mol![]() L–1 utilizada na titulação, a estudante utilizou uma determinada alíquota de uma solução concentrada de HNO3, cujo título era de 65,0% (m/m) e a densidade de 1,50 g
L–1 utilizada na titulação, a estudante utilizou uma determinada alíquota de uma solução concentrada de HNO3, cujo título era de 65,0% (m/m) e a densidade de 1,50 g![]() mL–1. Admitindo-se a ionização de 100% do ácido nítrico, expresse sua equação de ionização em água, calcule o volume da alíquota da solução concentrada, em mL, e calcule o pH da solução-padrão preparada.
mL–1. Admitindo-se a ionização de 100% do ácido nítrico, expresse sua equação de ionização em água, calcule o volume da alíquota da solução concentrada, em mL, e calcule o pH da solução-padrão preparada.
Dados:
• Massa molar do HNO3 = 63,0 g![]() mol–1
mol–1
• pH = – log [H+]
12- (UNICAMP SP)
Nos Jogos Olímpicos de Beijing houve uma preocupação em se evitar a ocorrência de chuvas durante a cerimônia de abertura. Utilizou-se o iodeto de prata no bombardeamento de nuvens nas vizinhanças da cidade para provocar chuva nesses locais e, assim, evitá-la no Estádio Olímpico. O iodeto de prata tem uma estrutura cristalina similar à do gelo, o que induz a formação de gelo e chuva sob condições específicas. Escreva a expressão da constante do produto de solubilidade do iodeto de prata e calcule sua concentração em mol L–1 numa solução aquosa saturada a 25 ºC.
Dado: A constante do produto de solubilidade do iodeto de prata é 8,1 x 10–17 a 25 ºC.
13 - (FUVEST SP)
O cultivo de flores é uma atividade que envolve desde produtores rurais, que fazem dele seu sustento econômico, até amantes da jardinagem que dedicam suas horas de lazer em colecionar e propagar plantasornamentais.
O professor Fernandinho que é um amante da jardinagem ( gosta tanto, que mora no residencial Portal das flores), observou que uma mesma espécie de planta podia gerar flores azuis ou rosadas. Decidiu então estudar se a natureza do solo poderia influenciar a cor das flores. Para isso, fez alguns experimentos e anotou as seguintes observações:
I. Transplantada para um solo cujo pH era 5,6 , uma planta com flores rosadas passou a gerar flores azuis.
II. Ao adicionar um pouco de nitrato de sódio ao solo, em que estava a planta com flores azuis, a cor das flores permaneceu a mesma.
III. Ao adicionar calcário moído (carbonato de cálcio) ao solo, em que estava a planta com flores azuis, ela passou a gerar flores rosadas.
Considerando essas observações, qual seria a coloração das flores obtida pelo professor Fernandinho em um solo mais ácido do que aquele de pH 5,6 ?
Justifique a sua resposta, demonstrando o processo completo de hidrólise nas observações II e III.
14– (PUC/MG)
Para realizar um experimento, 200 gramas de gás hidrogênio e 100 mol de Br2 são colocados em um recipiente de 10 L de capacidade, a 575 °C. Atingindo-se o equilíbrio, a análise do sistema mostrou que 324 g/L de HBr está presente. Calcule o valor de Kc, a 575°C, para o equilíbrio: H2 (g) + Br2(g) ![]() 2 HBr (g )
2 HBr (g )
15 - (MACK SP/2014)
Considere o processo representado pela transformação reversível equacionada abaixo.
A2(g) + B2(g) ![]() 2 AB(g)
2 AB(g) ![]() > 0
> 0
Inicialmente, foram colocados em um frasco com volume de 10 L, 1 mol de cada um dos reagentes. Após atingir o equilíbrio, a uma determinada temperatura T, verificou-se experimentalmente que a concentração da espécie AB(g) era de 0,10 mol/L.
São feitas as seguintes afirmações, a respeito do processo acima descrito.
I. A constante KC para esse processo, calculada a uma dada temperatura T, é 4.
II. A concentração da espécie A2(g) no equilíbrio é de 0,05 mol/L.
III. Um aumento de temperatura faria com que o equilíbrio do processo fosse deslocado no sentido da reação direta.
Assim, pode-se confirmar que
a) é correta somente a afirmação I.
b) são corretas somente as afirmações I e II.
c) são corretas somente as afirmações I e III.
d) são corretas somente as afirmações II e III.
e) são corretas as afirmações I, II e III.
16 - (MACK SP/2013)
Sob condições adequadas de temperatura e pressão, ocorre à formação do gás amônia. Assim, em um recipiente de capacidade igual a 10 L, foram colocados 5 mol de gás hidrogênio junto com 2 mol de gás nitrogênio. Ao ser atingido o equilíbrio químico, verificou-se que a concentração do gás amônia produzido era de 0,3 mol/L. Dessa forma, o valor da constante de equilíbrio (KC) é igual a
a) 1,80 · 10–4
b) 3,00 · 10–2
c) 6,00 · 10–1
d) 3,60 · 101
e) 1,44 · 104
17 - (ACAFE SC/2013)
Dois litros de ácido etanóico (1,0 mol/L) foram misturados com dois litros de etanol (1,0 mol/L). Estabelecido o equilíbrio, 60% do álcool foi esterificado. O nome do éster formado e o valor de Kc desse equilíbrio são:
a) metanoato de metila e 1,88.
b) etanoato de etila e 0,44.
c) etanoato de etila e 2,25.
d) etanoato de etila e 0,53.
18 - (UEPA/2013)
Até o início do século XX, a principal fonte natural de compostos nitrogenados era o NaNO3 (salitre do Chile), que resultava da transformação de excrementos de aves marinhas em regiões de clima seco, como acontece no Chile. O salitre natural não seria suficiente para suprir a necessidade atual de compostos nitrogenados. Assim a síntese do amoníaco, descrita abaixo, solucionou o problema da produção de salitre:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
Considerando que em um sistema, a mistura dos gases tem pressões parciais de 0,01atm, 0,1atm e 0,5atm para o NH3, H2e N2, respectivamente, em altas temperaturas, o valor de Kp é igual a:
a) 0,15
b) 0,18
c) 0,20
d) 0,24
e) 0,25
19 - (FAVIP PE/2012)
Uma amostra de 0,10 mol de H2S é colocada em um recipiente de reação de 10,0 litros e aquecida até 1.130ºC. No equilíbrio, 0,040 mol de H2 está presente. Calcule o valor de Kc para a reação:
2H2S(g) ![]() 2 H2(g) + S2(g)
2 H2(g) + S2(g)
a) 8,9 x 10–4.
b) 2,5 x 10–4.
c) 4,7 x 10–3.
d) 6,1 x 10–3.
e) 3,3 x 10–2.
20 - (FM Petrópolis RJ/2012)
O corpo humano é uma fábrica química, e, mesmo assim, aparentemente, permanece inalterado dia após dia. Tal situação está relacionada com as inúmeras reações químicas reversíveis, que estão em equilíbrios dinâmicos.
Considere a seguinte reação química, dentro de um recipiente fechado, a temperatura constante:
H2(g) + I2(g) ![]() 2Hl(g)
2Hl(g)
O gráfico abaixo apresenta as concentrações das substâncias envolvidas ao longo do tempo.
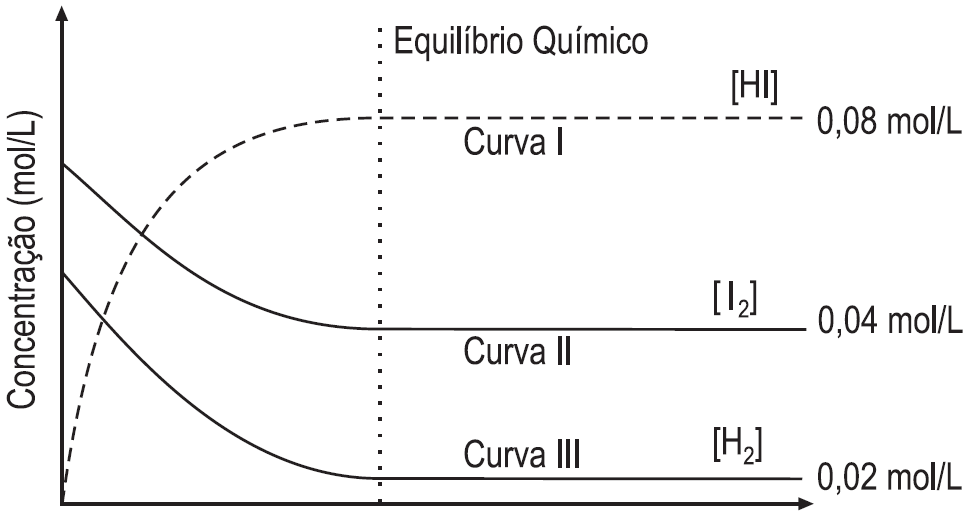
Com base no gráfico e nos respectivos valores do estado de equilíbrio químico alcançado por cada componente da reação, afirma-se que o valor da constante de equilíbrio para a reação é
a) 8
b) 10
c) 16
d) 25
e) 100
21 - (UNIFICADO RJ)
No equilíbrio químico, o deslocamento provoca um aumento do rendimento da reação e tem grande importância, principalmente para a indústria, pois, quanto maior a produção em curto tempo com a diminuição dos custos, melhor será o processo. Os fatores externos que podem deslocar o equilíbrio químico são: concentração, pressão e temperatura. Seja uma mistura de N2, H2 e NH3 em equilíbrio (síntese da amônia). Nesse momento, as concentrações do N2 e H2 são:
[N2] = 1,0 x 10–12 mol.L–1 e [H2] = 2,0 x 10–8 mol.L–1
Considere o valor da constante de equilíbrio a 298 K como 6,125´104. O valor da concentração da amônia, nessas condições, em mol/L, é
a) 4 x 10–12
b) 5 x 1012
c) 6 x 10–32
d) 7 x 10–16
e) 8 x 10–14
22 - (UFG GO/2014)
Em um laboratório, um analista misturou 1 L de uma solução de ácido clorídrico 0,1 mol/L com 1 L de uma solução de hidróxido de sódio 0,2 mol/L.
A partir das informações fornecidas,
a) escreva a equação química balanceada.
b) calcule a concentração molar e o valor do pH da solução resultante. Use log 5 = 0,70.
23 - (UNIRG TO/2013)
Um analista preparou uma solução de NaOH e outra de HCl, ambas na concentração de 0,100 mol/L. Ao misturar 10 mL da solução de HCl com 90 mL da solução de NaOH, o pH da solução final foi, aproximadamente, igual a: Dados: log 8 = 0,9
a) 13,0
b) 10,0
c) 4,0
d) 1,0
24 - (FMABC SP/2013)
Considere duas soluções armazenadas em frascos distintos, A e B. No frasco A encontra-se uma solução aquosa de ácido sulfúrico de concentração 0,30 mol/L, enquanto no frasco B tem-se uma solução aquosa de hidróxido de sódio de concentração 0,10 mol/L. Para neutralizar completamente 5,0 mL da solução A são necessários quantos mL da solução B?
25 - (PUC Camp SP/2013)
O cardiologista John Kheir, do Hospital Infantil de Boston (EUA), liderou um estudo em que coelhos com a traqueia bloqueada sobreviveram por até 15 minutos sem respiração natural, apenas por meio de injeção de oxigênio na corrente sanguínea. A técnica poderá prevenir
parada cardíaca e danos cerebrais induzidos pela privação de oxigênio, além de evitar a paralisia cerebral quando há comprometimento de oxigenação fetal.
(Revista Quanta, ano 2, n. 6, agosto e setembro de 2012.
Coelhos com respiração natural possuem pH do sangue igual a 7,4.
(Revista Brasileira de Anestesiologia, v. 53, n. 1,
Janeiro-Fevereiro, 2003. p. 25-31).
Esse valor mostra que o sangue dos coelhos é
a) ácido, porque possui [H+] = [OH–].
b) ácido, porque possui [H+] < [OH–].
c) neutro, porque possui [H+] =[OH–].
d) básico, porque possui [H+] >[OH–].
e) básico, porque possui [H+] <[OH–].
26 - (Univag MT/2014)
Amplamente usado no tratamento da anemia, o sulfato ferroso (FeSO4) é um sal originário de uma base fraca e um ácido forte. Dissolvendo uma amostra desse sal na água, conclui-se corretamente que essa solução tem
a) caráter básico, logo pH < 7. b)caráter ácido, logo [H+] < [OH–]. c) caráter neutro, logo pH = 7.
d) caráter ácido, logo [H+] > [OH–]. e) caráter básico, logo pH > 7.
27 - (UNESP SP/2013)
Em um estudo sobre extração de enzimas vegetais para uma indústria de alimentos, o professor solicitou que um estudante escolhesse, entre cinco soluções salinas disponíveis no laboratório, aquela que apresentasse o mais baixo valor de pH. Sabendo que todas as soluções disponíveis no laboratório são aquosas e equimolares, o estudante deve escolher a solução de
a) oxalato de amônio. b) fosfato de potássio c) carbonato de sódio.
d) nitrato de potássio. e) sulfato de amônio.
28 - (Fac. Santa Marcelina SP/2013)
O creme dental é um produto de higiene bucal que contém diversas substâncias na sua composição. A figura representa um tubo de creme dental com a indicação de dois de seus ingredientes.
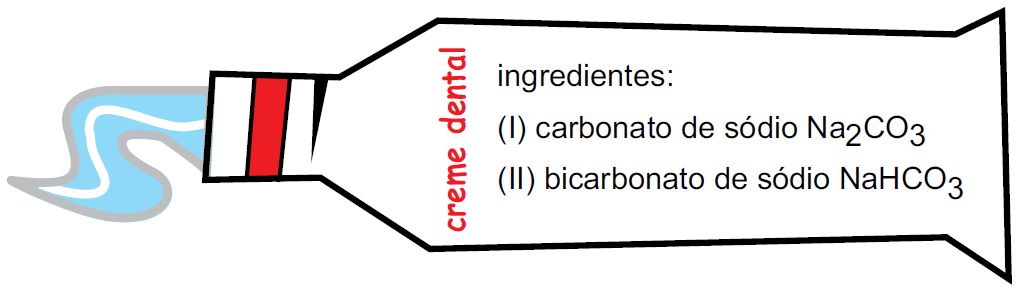
As interações dos ingredientes I e II com a água destilada, separadamente, resultam em soluções com caráter, respectivamente,
a) básico e ácido. b) básico e básico. c) ácido e neutro. d) neutro e básico. e) ácido e básico.
29 - (UERJ/2012)
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução. Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
a) ácido clorídrico b) cloreto de sódio c) hidróxido de sódio d) bicarbonato de sódio
30 - (FATEC SP/2012)
Considere as seguintes misturas:
I. leite de magnésia (suspensão aquosa de hidróxido de magnésio);
II. limonada ( suco de limão, água e açúcar);
III. salmoura ( cloreto de sódio dissolvido em água).
Assinale a alternativa que classifica, corretamente, essas três misturas.
31 - (FMJ SP/2012)
Em uma aula de laboratório, utilizando-se água destilada (pH = 7,0), foram preparadas separadamente soluções 0,1 mol/L de
I. cloreto de potássio;
II. nitrato de amônio;
III. acetato de sódio;
IV. nitrato de alumínio.
O pH das soluções foi medido com papel indicador universal.
Apresentaram valores de pH menor que 7 apenas as soluções
a) I e III. b) I e IV. c) II e III. d) II e IV. e) III e IV.
32 - (UNICAMP SP/2012)
Uma solução de luminol e água oxigenada, em meio básico, sofre uma transformação química que pode ser utilizada para algumas finalidades. Se essa transformação ocorre lentamente, nada se observa visualmente; no entanto, na presença de pequenas quantidades de íons de crômio, ou de zinco, ou de ferro, ou mesmo substâncias como hipoclorito de sódio e iodeto de potássio, ocorre uma emissão de luz azul, que pode ser observada em ambientes com pouca iluminação.
a) De acordo com as informações dadas, pode-se afirmar que essa solução é útil na identificação de uma das possíveis fontes de contaminação e infecção hospitalar. Que fonte seria essa? Explique por que essa fonte poderia ser identificada com esse teste.
b) Na preparação da solução de luminol, geralmente se usa NaOH para tornar o meio básico. Não havendo disponibilidade de NaOH, pode-se usar apenas uma das seguintes substâncias: CH3OH, Na2CO3, Al2(SO4)3 ou FeCl3. Escolha a substância correta e justifique, do ponto de vista químico, apenas a sua escolha.
33 - (UFSM RS)
Cerca de 70% da superfície do planeta Terra estão cobertos de água, sendo menos de 1% água doce. A adição de NaCl em água produz
a) uma solução de pH<7. b) um ácido fraco e uma base forte.
c) os íons H+, Cl–, Na+ e OH–. d) um ácido forte e uma base fraca.
e) uma reação de hidrólise salina.
34 - (MACK SP)
O pH dos solos varia de 3,0 a 9,0 e para a grande maioria das plantas a faixa de pH de 6,0 a 6,5 é a ideal, porque ocorre um ponto de equilíbrio no qual a maioria dos nutrientes permanecem disponíveis às raízes. A planta Camellia japônica, cuja flor é conhecida como camélia, prefere solos ácidos para o seu desenvolvimento. Uma dona de casa plantou, em seu jardim, uma cameleira e a mesma não se desenvolveu satisfatoriamente, pois o solo de seu jardim estava muito alcalino. Sendo assim, foi-lhe recomendado que usasse uma substância química que diminuísse o pH do solo para obter o desenvolvimento pleno dessa planta. De acordo com as informações acima, essa substância química poderá ser
a) carbonato de cálcio. b) nitrato de potássio. c) sulfato de amônio. d) nitrato de sódio. e) carbonato de magnésio.
35 - (ACAFE SC/2014)
Cálculo renal também, conhecido como pedra nos rins, são formações sólidas contendo várias espécies químicas, entre elas o fosfato de cálcio, que se acumula nos rins, causando enfermidades.
Assinale a alternativa que contém a concentração dos íons Ca2+ em uma solução aquosa saturada de fosfato de cálcio.
Dado: Considere que a temperatura seja constante e o produto de solubilidade (Ks) do fosfato de cálcio em água seja 1,08x10–33.
a) 3x10–7mol/L b) 1x10–7mol/L c) 2x10–7mol/L d) 27x10–7 mol/L
36 - (UNIUBE MG/2013)
Os íons cálcio e ácido oxálico presentes na alimentação humana podem, através de uma reação de precipitação oriunda das atividades fisiológicas do organismo, produzir o oxalato de cálcio, um dos principais constituintes dos cálculos renais (pedra nos rins). As medidas laboratoriais indicam que a concentração média desse sal na urina de uma pessoa adulta sem distúrbios metabólicos é da ordem de 6,7 mg/L. Sendo assim, podemos afirmar que, à temperatura corpórea, 37ºC, o produto de solubilidade (Kps ) do oxalato de cálcio para um paciente metabolicamente compensado é de, aproximadamente:
Dados: CaC2O4 M = 128g/mol
a) 2,7 x 10–9 b) 7,3 x 10–18 c) 2,8 x 10–8 d) 5,2 x 10–5 e) 1,1 x 10–4
37 - (UFGD MS/2013)
Sabe-se a solubilidade de algumas substâncias variam em função da temperatura, a fim de evitar-se erros experimentais os químicos normalmente mantêm a temperatura constante durante os experimentos. Em uma determinada temperatura, a solubilidade do sulfato de prata (Ag2SO4) em água é 2,0x10–2 mol/L. Qual é o valor do produto de solubilidade (Kps) deste sal considerando esta mesma temperatura?
a) Kps = 6,4x10–5 b) Kps = 3,2x10–5 c) Kps = 32x10–5 d) Kps = 64x10–5 e) Kps = 0,64x10–5
38 - (UFAL)
Um estudo efetuado para detectar as causas da poluição numa baía concluiu que parte da poluição observada era devido à qualidade das águas de um certo rio que ali desembocava. Esse rio recebia grande quantidade de resíduos industriais ricos em chumbo e desaguava na baía. Uma amostra coletada na foz desse rio, à temperatura de 25 °C, apresentou concentração de íons cloreto igual a 0,30 mol/L.
Sabendo que o produto de solubilidade do cloreto de chumbo, PbCl2, é 1,6 x 10−5 a 25 °C determine a concentração máxima (em mol/L) de íons chumbo presente nessa amostra.
a) 4,3 x 10−3 b) 6,5 x 10−4 c) 1,8 x 10−4 d) 2,0 x 10−5 e) 9,3 x10−5

