Lista de exercícios – Química – prof. Raimundo. 1º. trimestre
3º. Ens. Médio 2018
- Equilíbrio químico.
-pH e pOH.
-Deslocamento de equilíbrio.
-Hidrólise salina
-Equilíbrio ácido-base
Resolução comentada no final da lista .
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Ba = 137
01 - (UECE/2017)
Um estudante de química retirou água do seguinte sistema em equilíbrio:
2NO2(g) + CH4(g) ![]() CO2(g) + 2H2O(l) + N2(g)
CO2(g) + 2H2O(l) + N2(g)
Em seguida, esse aluno constatou acertadamente que
a) a concentração de metano diminuiu.
b) o equilíbrio se desloca para a esquerda.
c) a concentração do dióxido de carbono diminuiu.
d) a concentração do nitrogênio gasoso diminuiu.
02 - (UEFS BA/2017)
O principal constituinte do esmalte dos dentes é a hidroxiapatita, Ca5OH(PO4)3(s), que é praticamente insolúvel em água, mas, por estar em contato com a saliva, ocorre o seguinte equilíbrio de dissociação de seus íons:
Ca5OH(PO4)3(s) ![]() 5Ca2+(aq) + OH– (aq) + 3PO
5Ca2+(aq) + OH– (aq) + 3PO![]() (aq)
(aq)
Sobre a equação de equilíbrio, analise as afirmativas e marque com V as verdadeiras e com F, as falsas.
( ) Ao consumir bebidas e/ou alimentos ácidos, a deterioração dos dentes é favorecida devido à fragilização do esmalte dos dentes, pois ocorre deslocamento do equilíbrio no sentido da dissociação da hidroxiapatita.
( ) Águas que contêm íons fluoreto, quando ingeridas, decrescem o pH da saliva, fazendo com que o equilíbrio se desloque no sentido da dissociação da hidroxiapatita e, com isso, favorece a formação de cáries.
( ) Se for adicionado hidróxido de magnésio ao creme dental, o equilíbrio será deslocado no sentido da formação da hidroxiapatita, ajudando a tornar os dentes mais resistentes.
( ) A hidroxiapatita é um sal ácido que tende a se dissolver em meio básico, produzindo íons fosfato, que contribuem para diminuir o pH do meio.
A alternativa que contém a sequência correta, de cima para baixo, é a
a) V F V F
b) V V F F
c) V F F V
d) F F V V
e) F V V F
03 - (UFRR/2017)
Em 1888, Henri Le Chatelier formulou o chamado princípio de Le Chatelier que afirma: “se uma perturbação externa for aplicada a um sistema em equilíbrio, o sistema reagirá de tal modo a aliviar parcialmente essa perturbação”. Sobre essa afirmação é CORRETO afirmar:
a) O aumento da pressão desloca a reação na direção do lado com mais mols de gás;
b) Remoção de um reagente desloca o equilíbrio para a formação do produto;
c) Adição de um produto desloca o equilíbrio para a formação do produto;
d) Remoção de um produto desloca o equilíbrio para a formação do reagente;
e) Adição de um reagente desloca o equilíbrio para a formação do produto.
04 - (UEG GO/2017)
Uma solução de hidróxido de potássio foi preparada pela dissolução de 0,056 g de KOH em água destilada, obtendo-se 100 mL dessa mistura homogênea.
Dado: MM (KOH) = 56 g.mol–1
De acordo com as informações apresentadas, verifica-se que essa solução apresenta
a) pH = 2
b) pH < 7
c) pH = 10
d)pH = 12
e) pH > 13
05 - (UEA AM/2017)
Considere as seguintes informações, obtidas de um rótulo de água mineral da cidade de Porto Seguro (BA):
nitrato --------------1,45 mg/L
pH a 25 ºC-------- 4,51
Essa água mineral é
a) ácida e tem [H+] < [ OH–].
b) ácida e tem [H+] > [ OH–].
c) neutra e tem [H+] = [ OH–].
d) básica e tem [H+] > [ OH–].
e) básica e tem [H+] < [ OH–].
06 - (Mackenzie SP/2017)
Certo ácido diprótico fraco de concentração igual a 1 mol.L–1 apresenta, no equilíbrio, grau de ionização de ordem de 2 %. Considerando-se tais informações, é correto afirmar que a concentração em mol.L–1 dos íons H+ e o potencial hidroxiliônico da solução são, respectivamente,
Dados: log10 2 = 0,3; log10 4 = 0,6; log10 6 = 0,78 e log10 8 = 0,9
a) 2![]() 10–2 e 1,4
10–2 e 1,4
b) 2![]() 10–4 e 12,6
10–4 e 12,6
c) 2![]() 10–3 e 1,4
10–3 e 1,4
d) 4![]() 10–2 e 1,4
10–2 e 1,4
e) 4![]() 10–2 e 12,6
10–2 e 12,6
07 - (FPS PE/2017)
Estudos ecológicos e toxicológicos revelam uma forte relação entre baixos níveis de pH e a perda de populações de peixes em lagos. Com pH inferior a 4,5, praticamente, nenhum peixe sobrevive, enquanto níveis iguais ou superiores a 6,0 promovem populações saudáveis. Considerando o texto acima, analise as afirmações seguintes.
1. pH inferior a 4,5 indica que a água do lago está ácida.
2. pH superior a 6,0 indica que a água do lago está alcalina.
3. pH = 6,0 corresponde a uma concentração de
H3O+ = 1,0![]() 10–6 mol
10–6 mol![]() L–1
L–1
Está(ão) correta(s):
a) 1 apenas.
b) 2 apenas.
c) 1 e 3 apenas.
d) 2 e 3 apenas.
e) 1, 2 e 3.
08 - (FCM PB/2017)
Alimentos ácidos, condimentados e gordurosos costumam cair como uma bomba em estômagos mais sensíveis. É comer para logo sentir aquela azia ou queimação. Cafeína, bebidas alcoólicas, cigarro e até o nervosismo também podem piorar problemas como gastrite e úlcera. Isso ocorre porque, em situações de tensão, o sistema nervoso é acionado e estimula a produção de ácido clorídrico no estômago. Assim, o suco gástrico fica mais ácido e a agressão é maior. O suco gástrico é formado basicamente por água, de ácido clorídrico, muco, enzimas e sais. Com gastrite ele fica ainda mais ácido. A gastrite é uma inflamação da parede do estômago e acontece quando a acidez aumenta tanto que começa a agredir o órgão. Quando essa inflamação evolui, pode causar uma ferida mais grave, a úlcera. Sendo o ácido clorídrico um ácido forte, a sua ionização é total em meio aquoso, e a concentração de H+ em quantidade de matéria nesse meio será a mesma do ácido de origem. Assim, uma solução aquosa de ácido clorídrico em concentração 0,01 mol L–1 terá pH igual a:
Fonte: https://yessaude.com/wp-content/uploads/2016/07/ulcera-no-estomago.jpg
a) 4
b) 5
c) 7
d) 9
e) 2
09 - (UNIUBE MG/2016)
A hidrólise salina é um processo no qual o(s) íon(s) do sal formado(s) pela neutralização entre ácido e base pode(m) reagir com a água do meio deixando a solução ácida, básica ou mantendo-a neutra. Um grupo de alunos misturou uma solução de hidróxido de amônio com uma de ácido cianídrico, ambas de mesma concentração, e fez as seguintes afirmações:
Dados: HCN (Ka = 4,9![]() 10–10); NH4OH (Kb = 1,8
10–10); NH4OH (Kb = 1,8![]() 10–5)
10–5)
I. A hidrólise ocorre com o íon NH4+, deixando o meio básico.
II. A reação envolvida seria
CN–(aq) + H2O(l) ![]() HCN(aq) + OH–(aq), pois a base é mais forte.
HCN(aq) + OH–(aq), pois a base é mais forte.
III. O sal formado será neutro, pois o ácido e a base são fracos.
É(São) VERDADEIRA(S) a(s) afirmação(ões) contida(s) em:
a) I, apenas
b) II, apenas
c) III, apenas
d) I e II, apenas
e) II e III, apenas
10 - (Faculdade Santo Agostinho BA/2016)
Muitas substâncias químicas são mais conhecidas pelo nome usual do que pelo nome recomendado pela IUPAC, a exemplo do nitrato de potássio, conhecido como salitre, carbonato de sódio, como barrilha, ácido clorídrico, denominado usualmente de ácido muriático e a suspensão aquosa de hidróxido de magnésio, o leite de magnésia.
Considerando-se as propriedades das substâncias químicas relacionadas no texto, é correto afirmar:
01. O hidróxido de magnésio, Mg(OH)2, presente no leite de magnésia, é uma base fraca e solúvel em água.
02. A dissolução completa de uma amostra de carbonato de sódio, Na2CO3(s), em água, forma uma solução de pH < 7,0.
03. O nitrato de potássio, constituinte do salitre, é um sal inorgânico representado pela fórmula química KNO2(s).
04. A mistura entre o ácido muriático, HCl(aq), e o leite de magnésia, Mg(OH)2(aq), leva à formação do cloreto de magnésio, MgCl2(aq) e da água, H2O(l).
05. O HCl(aq), ao ser usado na limpeza de pisos de mármore, que contém carbonato de cálcio, CaCO3(s), retira as impurezas sem alterar a constituição do material.
11 - (UNESP SP/2017)
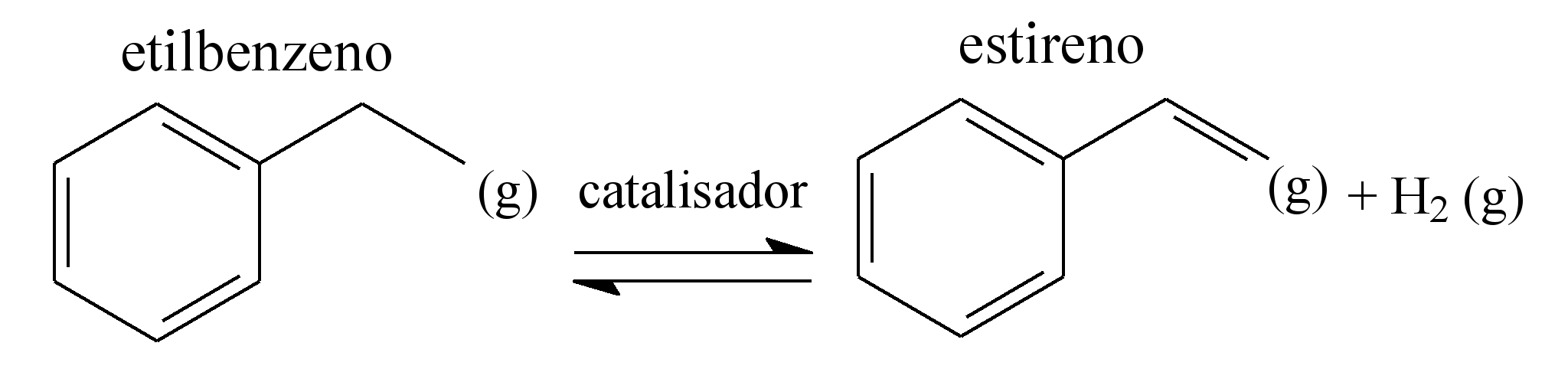
O estireno, matéria-prima indispensável para a produção do poliestireno, é obtido industrialmente pela desidrogenação catalítica do etilbenzeno, que se dá por meio do seguinte equilíbrio químico:
![]()
Analisando-se a equação de obtenção do estireno e considerando o princípio de Le Châtelier, é correto afirmar que
a) a entalpia da reação aumenta com o emprego do catalisador.
b) a entalpia da reação diminui com o emprego do catalisador.
c) o aumento de temperatura favorece a formação de estireno.
d) o aumento de pressão não interfere na formação de estireno.
e) o aumento de temperatura não interfere na formação de estireno.
12 - (Fac. Israelita de C. da Saúde Albert Einstein SP/2016)
O NO, óxido nítrico, é um poluente atmosférico formado em câmaras de combustão ou devido à ação de descargas elétricas. A reação a partir dos gases nitrogênio e oxigênio pode ser representada pela equação:
N2(g) + O2(g) ![]() 2 NO(g)
2 NO(g) ![]() = 180 kJ
= 180 kJ
Sobre a formação do óxido nítrico é possível afirmar que:
I. Se a reação for realizada em recipiente rígido e fechado, mantendo-se a temperatura constante, a pressão também se manterá constante.
II. O aumento de temperatura aumenta o rendimento da formação do NO.
III. Trata-se de um processo exotérmico, pois o produto apresenta maior energia do que os reagentes.
Pode-se dizer que
a) apenas as afirmações I e II estão corretas.
b) apenas as afirmações I e III estão corretas.
c) apenas as afirmações II e III estão corretas.
d) todas as afirmações estão corretas.
13 - (FAMERP SP/2016)
Considere o equilíbrio químico representado por
C (s) + CO2 (g)![]() 2CO (g) ;
2CO (g) ; ![]() = +88 kJ/mol de CO (g)
= +88 kJ/mol de CO (g)
O rendimento em CO (g) desse equilíbrio aumenta com o aumento da ____________, com a diminuição da ____________ e não se altera pela adição de ____________.
As lacunas do texto são, correta e respectivamente, preenchidas por:
a) temperatura – pressão – catalisador.
b) temperatura – pressão – CO2 (g).
c) pressão – temperatura – catalisador.
d) pressão – temperatura – CO2 (g).
e) pressão – temperatura – C (s).
14 - (FUVEST SP/2016)
Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta pH 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que a solução resultante apresente pH 8 é
a) 2
b) 6
c) 10
d) 14
e) 18
15 - (UNCISAL/2016)
O uso de água sanitária é muito comum no nosso cotidiano e seu princípio ativo está baseado nas propriedades oxidantes do ânion do ácido hipocloroso, que é um ácido fraco. O hipoclorito de sódio é obtido pela eletrólise de uma solução de cloreto de sódio, onde são produzidos também gás hidrogênio e gás cloro.
Química Nova na Escola. v. 30, p. 66-69, 2008.
Com respeito à água sanitária e com base nas informações apresentadas, que alternativa traduz a condição real quanto ao seu pH e do meio em que se forma?
a) A água sanitária exibe diversas faixas de pH, podendo variar desde ácido, neutro ou básico, dependendo de como ela foi obtida.
b) No processo de obtenção da água sanitária, o meio na qual ela se forma estará ácido devido à formação de gás cloro e hidrogênio.
c) A água sanitária, além de ser oxidante, também possui características ácidas, visto que seu princípio ativo é derivado de um ácido.
d) A água sanitária apresenta propriedades oxidantes e seu pH deve ser neutro, visto que em solução aquosa o meio é neutro, não variando.
e) A água sanitária apresenta propriedades básicas porque a hidrólise prevalece e como resultado teremos uma solução com pH acima de 7,0.
16 - (Centro Universitário de Franca SP/2016)
Uma etapa importante na produção industrial de ácido sulfúrico é a obtenção do trióxido de enxofre a partir da seguinte reação:
2SO2 (g) + O2 (g)![]() 2SO3 (g)
2SO3 (g) ![]() < 0
< 0
Para aumentar o rendimento da produção de ácido sulfúrico, a formação do gás trióxido de enxofre é uma etapa crítica, sendo importante favorecer o deslocamento do equilíbrio no sentido da formação desse gás. Considere que esse sistema sofre, separadamente, as seguintes ações:
1: aumento da pressão
2: adição de um catalisador
3: aumento da concentração de oxigênio
4: aumento da temperatura
As duas ações que favorecem o rendimento da produção de ácido sulfúrico são as de números
a) 1 e 2.
b) 1 e 3.
c) 1 e 4.
d) 2 e 3.
e) 2 e 4.
17 - (UFSCAR SP/2016)
O caxiri é uma tradicional bebida alcoólica fermentada indígena produzida pelos índios (Juruna) Yudjá, habitantes do Parque Indígena do Xingu, localizado no estado do Mato Grosso. Essa bebida é preparada à base de mandioca e batata-doce, e é originalmente fermentada por micro-organismos que estão presentes nas matérias-primas utilizadas para a sua produção. (...) Observando-se as alterações físico-químicas durante a fermentação, pode-se notar uma progressiva variação de pH de 4,76 para 3,15. O etanol foi o metabólito da fermentação produzido em maior quantidade, apresentando concentração, ao final do processo fermentativo, de 83,9 g/L da bebida. (...)
(http://repositorio.ufla.br/jspui/handle/1/4765.
A variação do pH mostra que, durante o processo fermentativo, ocorreu
a) acidificação, com aumento da concentração dos íons H+.
b) acidificação, com aumento da concentração dos íons OH–.
c) acidificação, com diminuição da concentração dos íons H+.
d) alcalinização, com diminuição da concentração dos íons OH–.
e) alcalinização, com aumento da concentração dos íons OH–.
18 - (UDESC SC/2015)
Um estudante de química obteve uma solução indicadora ácido-base, triturando no liquidificador algumas folhas de repolho roxo com água. Em seguida, ele dividiu a solução obtida em três tubos de ensaio (A, B e C) e no primeiro tubo adicionou uma pequena quantidade de vinagre (solução de ácido acético); no segundo alguns cristais de soda cáustica (NaOH), e no terceiro alguns cristais de sal para churrasco (NaCl), obtendo o resultado conforme mostra o quadro:
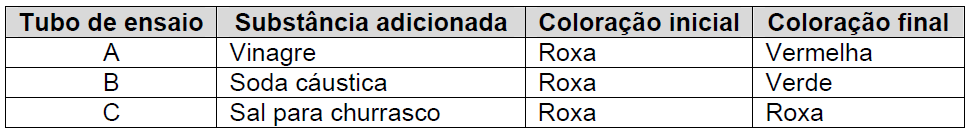
Se o estudante realizar outro experimento adicionando no tubo A KOH, no B HNO3 e no C KNO3, contendo a solução inicial extraída do repolho roxo, a coloração final, respectivamente será:
a) roxa, verde, roxa.
b) roxa, vermelha, verde.
c) verde, roxa, vermelha.
d) vermelha, verde, roxa.
e) verde, vermelha, roxa.
19 - (Unioeste PR/2015)
Os sais estão presentes em nosso cotidiano e são de suma importância para a sobrevivência dos seres humanos. Dos sais abaixo, aquele que em solução aquosa apresenta pH igual a 7 é:
a) carbonato ácido de sódio
b) sulfato de amônio
c) cianeto de potássio
d) cloreto de sódio
e) carbonato de sódio
20 - (UERN/2015)
Toda reação de neutralização de um ácido com uma base forma sal e água. Considerando a reação de ácido sulfúrico e hidróxido de zinco, pode-se obter sulfato de zinco e água. É correto afirmar que a solução aquosa desse sal é de caráter
a) ácido.
b) básico.
c) neutro.
d) anfótero.
21 - (UNESP SP/2015)
Chama-se titulação a operação de laboratório realizada com a finalidade de determinar a concentração de uma substância em determinada solução, por meio do uso de outra solução de concentração conhecida. Para tanto, adiciona-se uma solução-padrão, gota a gota, a uma solução-problema (solução contendo uma substância a ser analisada) até o término da reação, evidenciada, por exemplo, com uma substância indicadora. Uma estudante realizou uma titulação ácido-base típica, titulando 25,0 mL de uma solução aquosa de hidróxido de cálcio e gastando 20,0 mL de uma solução padrão de ácido nítrico de concentração igual a 0,10 mol · L–1.
Para preparar 200 mL da solução-padrão de concentração 0,10 mol![]() L–1 utilizada na titulação, a estudante utilizou uma determinada alíquota de uma solução concentrada de HNO3, cujo título era de 65,0% (m/m) e a densidade de 1,50 g
L–1 utilizada na titulação, a estudante utilizou uma determinada alíquota de uma solução concentrada de HNO3, cujo título era de 65,0% (m/m) e a densidade de 1,50 g![]() mL–1. Admitindo-se a ionização de 100% do ácido nítrico, expresse sua equação de ionização em água, calcule o volume da alíquota da solução concentrada, em mL, e calcule o pH da solução-padrão preparada.
mL–1. Admitindo-se a ionização de 100% do ácido nítrico, expresse sua equação de ionização em água, calcule o volume da alíquota da solução concentrada, em mL, e calcule o pH da solução-padrão preparada.
Dados:
• Massa molar do HNO3 = 63,0 g![]() mol–1
mol–1
• pH = – log [H+]
22 - (FUVEST SP)
O cultivo de flores é uma atividade que envolve desde produtores rurais, que fazem dele seu sustento econômico, até amantes da jardinagem que dedicam suas horas de lazer em colecionar e propagar plantas ornamentais.
O professor Fernandinho que é um amante da jardinagem ( gosta tanto, que mora no residencialPortal das flores), observou que uma mesma espécie de planta podia gerar flores azuis ou rosadas. Decidiu então estudar se a natureza do solo poderia influenciar a cor das flores. Para isso, fez alguns experimentos e anotou as seguintes observações:
I. Transplantada para um solo cujo pH era 5,6 , uma planta com flores rosadas passou a gerar flores azuis.
II. Ao adicionar um pouco de nitrato de sódio ao solo, em que estava a planta com flores azuis, a cor das flores permaneceu a mesma.
III. Ao adicionar calcário moído (carbonato de cálcio) ao solo, em que estava a planta com flores azuis, ela passou a gerar flores rosadas.
Considerando essas observações, qual seria a coloração das flores obtida pelo professor Fernandinho em um solo mais ácido do que aquele de pH 5,6 ?
Justifique a sua resposta, demonstranto o processo completo de hidrólise nas observações II e III.
23– (PUC/MG)
Para realizar um experimento, 200 gramas de gás hidrogênio e 100 mol de Br2 são colocados em um recipiente de 10 L de capacidade, a 575 °C. Atingindo-se o equilíbrio, a análise do sistema mostrou que 324 g/L de HBr está presente. Calcule o valor de Kc, a 575°C, para o equilíbrio: H2 (g) + Br2(g) ⇄ 2 HBr (g )
24 - (MACK SP)
Considere o processo representado pela transformação reversível equacionada abaixo.
A2(g) + B2(g) ![]() 2 AB(g) ΔH > 0
2 AB(g) ΔH > 0
Inicialmente, foram colocados em um frasco com volume de 10 L, 1 mol de cada um dos reagentes. Após atingir o equilíbrio, a uma determinada temperatura T, verificou-se experimentalmente que a concentração da espécie AB(g) era de 0,10 mol/L.
São feitas as seguintes afirmações, a respeito do processo acima descrito.
I. A constante KC para esse processo, calculada a uma dada temperatura T, é 4.
II. A concentração da espécie A2(g) no equilíbrio é de 0,05 mol/L.
III. Um aumento de temperatura faria com que o equilíbrio do processo fosse deslocado no sentido da reação direta.
Assim, pode-se confirmar que
a) é correta somente a afirmação I.
b) são corretas somente as afirmações I e II.
c) são corretas somente as afirmações I e III.
d) são corretas somente as afirmações II e III.
e) são corretas as afirmações I, II e III.
25 - (MACK SP)
Sob condições adequadas de temperatura e pressão, ocorre à formação do gás amônia. Assim, em um recipiente de capacidade igual a 10 L, foram colocados 5 mol de gás hidrogênio junto com 2 mol de gás nitrogênio. Ao ser atingido o equilíbrio químico, verificou-se que a concentração do gás amônia produzido era de 0,3 mol/L. Dessa forma, o valor da constante de equilíbrio (KC) é igual a
a) 1,80 · 10–4
b) 3,00 · 10–2
c) 6,00 · 10–1
d) 3,60 · 101
e) 1,44 · 104
26 - (ACAFE SC)
Dois litros de ácido etanóico (1,0 mol/L) foram misturados com dois litros de etanol (1,0 mol/L). Estabelecido o equilíbrio, 60% do álcool foi esterificado. O nome do éster formado e o valor de Kc desse equilíbrio são:
a) metanoato de metila e 1,88.
b) etanoato de etila e 0,44.
c) etanoato de etila e 2,25.
d) etanoato de etila e 0,53.
27 - (UEPA)
Até o início do século XX, a principal fonte natural de compostos nitrogenados era o NaNO3 (salitre do Chile), que resultava da transformação de excrementos de aves marinhas em regiões de clima seco, como acontece no Chile. O salitre natural não seria suficiente para suprir a necessidade atual de compostos nitrogenados. Assim a síntese do amoníaco, descrita abaixo, solucionou o problema da produção de salitre:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
Considerando que em um sistema, a mistura dos gases tem pressões parciais de 0,01atm, 0,1atm e 0,5atm para o NH3, H2 e N2, respectivamente, em altas temperaturas, o valor de Kp é igual a:
a) 0,15
b) 0,18
c) 0,20
d) 0,24
e) 0,25
28 - (FAVIP PE)
Uma amostra de 0,10 mol de H2S é colocada em um recipiente de reação de 10,0 litros e aquecida até 1.130ºC. No equilíbrio, 0,040 mol de H2 está presente. Calcule o valor de Kc para a reação:
2H2S(g) ![]() 2 H2(g) + S2(g)
2 H2(g) + S2(g)
a) 8,9 x 10–4.
b) 2,5 x 10–4.
c) 4,7 x 10–3.
d) 6,1 x 10–3.
e) 3,3 x 10–2.
29 - (FM Petrópolis RJ)
O corpo humano é uma fábrica química, e, mesmo assim, aparentemente, permanece inalterado dia após dia. Tal situação está relacionada com as inúmeras reações químicas reversíveis, que estão em equilíbrios dinâmicos.
Considere a seguinte reação química, dentro de um recipiente fechado, a temperatura constante:
H2(g) + I2(g) ![]() 2Hl(g)
2Hl(g)
O gráfico abaixo apresenta as concentrações das substâncias envolvidas ao longo do tempo.
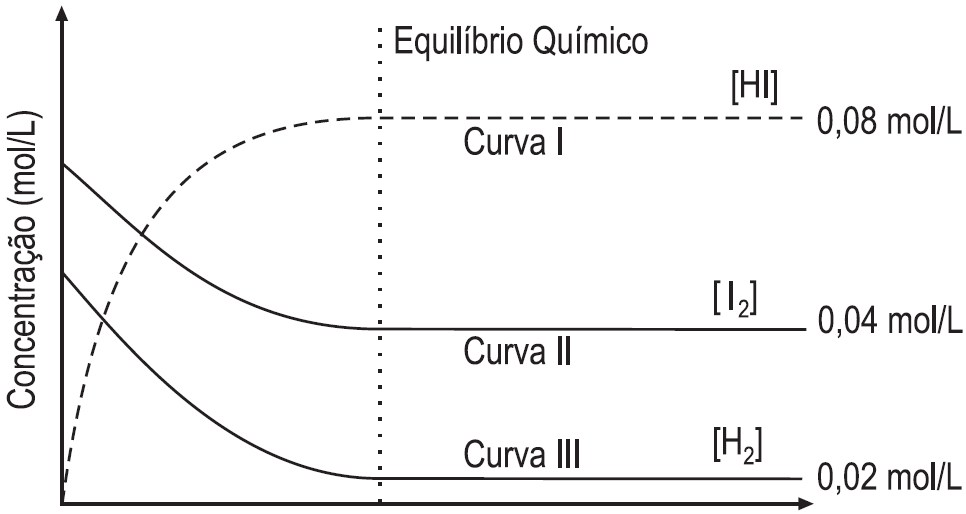
Com base no gráfico e nos respectivos valores do estado de equilíbrio químico alcançado por cada componente da reação, afirma-se que o valor da constante de equilíbrio para a reação é
a) 8
b) 10
c) 16
d) 25
e) 100
30 - (UNIFICADO RJ)
No equilíbrio químico, o deslocamento provoca um aumento do rendimento da reação e tem grande importância, principalmente para a indústria, pois, quanto maior a produção em curto tempo com a diminuição dos custos, melhor será o processo. Os fatores externos que podem deslocar o equilíbrio químico são: concentração, pressão e temperatura. Seja uma mistura de N2, H2 e NH3 em equilíbrio (síntese da amônia). Nesse momento, as concentrações do N2 e H2 são:
[N2] = 1,0 x 10–12 mol.L–1 e [H2] = 2,0 x 10–8 mol.L–1
Considere o valor da constante de equilíbrio a 298 K como 6,125´104. O valor da concentração da amônia, nessas condições, em mol/L, é
a) 4 x 10–12
b) 5 x 1012
c) 6 x 10–32
d) 7 x 10–16
e) 8 x 10–14
31 - (UFG GO)
Em um laboratório, um analista misturou 1 L de uma solução de ácido clorídrico 0,1 mol/L com 1 L de uma solução de hidróxido de sódio 0,2 mol/L.
A partir das informações fornecidas,
a) escreva a equação química balanceada.
b) calcule a concentração molar e o valor do pH da solução resultante. Use log 5 = 0,70.
32 - (UNIRG TO)
Um analista preparou uma solução de NaOH e outra de HCl, ambas na concentração de 0,100 mol/L. Ao misturar 10 mL da solução de HCl com 90 mL da solução de NaOH, o pH da solução final foi, aproximadamente, igual a: Dados: log 8 = 0,9
a) 13,0
b) 10,0
c) 4,0
d) 1,0
33 - (FMABC SP)
Considere duas soluções armazenadas em frascos distintos, A e B. No frasco A encontra-se uma solução aquosa de ácido sulfúrico de concentração 0,30 mol/L, enquanto no frasco B tem-se uma solução aquosa de hidróxido de sódio de concentração 0,10 mol/L. Para neutralizar completamente 5,0 mL da solução A são necessários quantos mL da solução B?
34 - (PUC Camp SP)
O cardiologista John Kheir, do Hospital Infantil de Boston (EUA), liderou um estudo em que coelhos com a traqueia bloqueada sobreviveram por até 15 minutos sem respiração natural, apenas por meio de injeção de oxigênio na corrente sanguínea. A técnica poderá prevenir
parada cardíaca e danos cerebrais induzidos pela privação de oxigênio, além de evitar a paralisia cerebral quando há comprometimento de oxigenação fetal.
(Revista Quanta, ano 2, n. 6, agosto e setembro de 2012.
Coelhos com respiração natural possuem pH do sangue igual a 7,4.
(Revista Brasileira de Anestesiologia, v. 53, n. 1,
Janeiro-Fevereiro, 2003. p. 25-31).
Esse valor mostra que o sangue dos coelhos é
a) ácido, porque possui [H+] = [OH–].
b) ácido, porque possui [H+] < [OH–].
c) neutro, porque possui [H+] =[OH–].
d) básico, porque possui [H+] >[OH–].
e) básico, porque possui [H+] <[OH–].
35 - (Univag MT)
Amplamente usado no tratamento da anemia, o sulfato ferroso (FeSO4) é um sal originário de uma base fraca e um ácido forte. Dissolvendo uma amostra desse sal na água, conclui-se corretamente que essa solução tem
a) caráter básico, logo pH < 7. b)caráter ácido, logo [H+] < [OH–]. c) caráter neutro, logo pH = 7.
d) caráter ácido, logo [H+] > [OH–]. e) caráter básico, logo pH > 7.
36 - (UNESP SP)
Em um estudo sobre extração de enzimas vegetais para uma indústria de alimentos, o professor solicitou que um estudante escolhesse, entre cinco soluções salinas disponíveis no laboratório, aquela que apresentasse o mais baixo valor de pH. Sabendo que todas as soluções disponíveis no laboratório são aquosas e equimolares, o estudante deve escolher a solução de
a) oxalato de amônio. b) fosfato de potássio c) carbonato de sódio.
d) nitrato de potássio. e) sulfato de amônio.
37 - (Fac. Santa Marcelina SP)
O creme dental é um produto de higiene bucal que contém diversas substâncias na sua composição. A figura representa um tubo de creme dental com a indicação de dois de seus ingredientes.
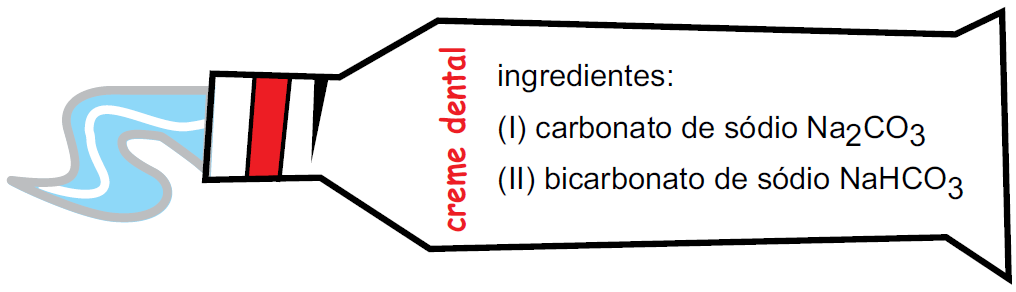
As interações dos ingredientes I e II com a água destilada, separadamente, resultam em soluções com caráter, respectivamente,
a) básico e ácido. b) básico e básico. c) ácido e neutro. d) neutro e básico. e) ácido e básico.
38 - (UERJ)
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução. Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
a) ácido clorídrico b) cloreto de sódio c) hidróxido de sódio d) bicarbonato de sódio
39 - (FATEC SP)
Considere as seguintes misturas:
I. leite de magnésia (suspensão aquosa de hidróxido de magnésio);
II. limonada ( suco de limão, água e açúcar);
III. salmoura ( cloreto de sódio dissolvido em água).
Assinale a alternativa que classifica, corretamente, essas três misturas.
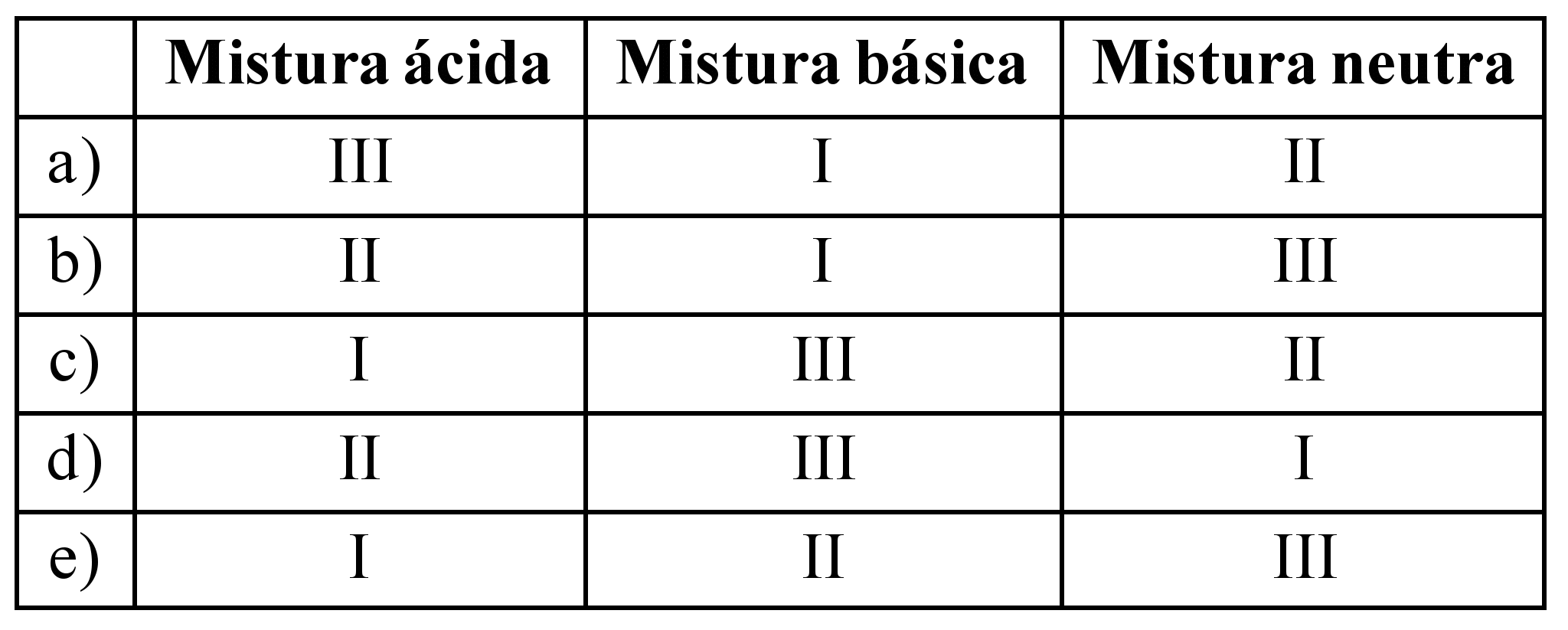
40 - (FMJ SP)
Em uma aula de laboratório, utilizando-se água destilada (pH = 7,0), foram preparadas separadamente soluções 0,1 mol/L de
I. cloreto de potássio;
II. nitrato de amônio;
III. acetato de sódio;
IV. nitrato de alumínio.
O pH das soluções foi medido com papel indicador universal.
Apresentaram valores de pH menor que 7 apenas as soluções
a) I e III. b) I e IV. c) II e III. d) II e IV. e) III e IV.
41 - (UNICAMP SP)
Uma solução de luminol e água oxigenada, em meio básico, sofre uma transformação química que pode ser utilizada para algumas finalidades. Se essa transformação ocorre lentamente, nada se observa visualmente; no entanto, na presença de pequenas quantidades de íons de crômio, ou de zinco, ou de ferro, ou mesmo substâncias como hipoclorito de sódio e iodeto de potássio, ocorre uma emissão de luz azul, que pode ser observada em ambientes com pouca iluminação.
a) De acordo com as informações dadas, pode-se afirmar que essa solução é útil na identificação de uma das possíveis fontes de contaminação e infecção hospitalar. Que fonte seria essa? Explique por que essa fonte poderia ser identificada com esse teste.
b) Na preparação da solução de luminol, geralmente se usa NaOH para tornar o meio básico. Não havendo disponibilidade de NaOH, pode-se usar apenas uma das seguintes substâncias: CH3OH, Na2CO3, Al2(SO4)3 ou FeCl3. Escolha a substância correta e justifique, do ponto de vista químico, apenas a sua escolha.
42 - (UFSM RS)
Cerca de 70% da superfície do planeta Terra estão cobertos de água, sendo menos de 1% água doce. A adição de NaCl em água produz
a) uma solução de pH<7. b) um ácido fraco e uma base forte.
c) os íons H+, Cl–, Na+ e OH–. d) um ácido forte e uma base fraca.
e) uma reação de hidrólise salina.
43 - (MACK SP)
O pH dos solos varia de 3,0 a 9,0 e para a grande maioria das plantas a faixa de pH de 6,0 a 6,5 é a ideal, porque ocorre um ponto de equilíbrio no qual a maioria dos nutrientes permanecem disponíveis às raízes. A planta Camellia japonica, cuja flor é conhecida como camélia, prefere solos ácidos para o seu desenvolvimento. Uma dona de casa plantou, em seu jardim, uma cameleira e a mesma não se desenvolveu satisfatoriamente, pois o solo de seu jardim estava muito alcalino. Sendo assim, foi-lhe recomendado que usasse uma substância química que diminuísse o pH do solo para obter o desenvolvimento pleno dessa planta. De acordo com as informações acima, essa substância química poderá ser
a)carbonato de cálcio. b)nitrato de potássio. c)sulfato de amônio. d)nitrato de sódio. e) carbonato de magnésio.
GABARITO: 1) A 2)A 3)E 4)D 5) B 6) E 7)C 8) E 9)B 10)04 11)C 12)A 13)A 14)E 15)E 16)B 17)A 18) E 19) D 20) A 21)HNO3(aq) + H2O(l) ![]() H3O+(aq) + NO–3(aq) ou HNO3(aq)
H3O+(aq) + NO–3(aq) ou HNO3(aq) ![]() H+(aq) + NO–3(aq)
H+(aq) + NO–3(aq)
Volume da solução concentrada: 1,29 mL pH = 1
22) azul 23) 0,25
24) E 25) E 26) C 27) C 28) A 29) A 30) D
31) a) HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (aq)
b) Concentração molar: 5x10–2 mol/L pH = 12,70 32) A 33) 30 mL 34) E 35) D
36) E 37) B 38) B 39) B 40) D
41) a) A fonte é o sangue. O íon ferro nele contido (presente na hemoglobina), ao ser posto em contato com a solução de luminol e água oxigenada em meio básico, promoverá uma reação na qual se nota a emissão de uma luz azul, observável em ambientes com essa contaminação e com pouca iluminação.
b)De acordo com o texto, a solução de água oxigenada e luminol deve ser básica. Entre as substâncias fornecidas, apenas o Na2CO3 deixa o meio básico, devido à hidrólise do íon carbonato, de acordo com equação a seguir: ![]() + H2O(l)
+ H2O(l) ![]() + OH(aq)
+ OH(aq)
42) C 43) C

