Lista de exercícios – Química – prof. Raimundo 2º. Trimestre – 2018 – 3º Ensino Médio
-Produto de solubilidade
-Efeitos coligativos
-Radioatividade ( reações nucleares , meia-vida )
Resolução comentada no final da lista
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200 Ba = 137
Matéria da Prova Oficial: Produto de solubilidade, efeitos coligativos e radioatividade.
1 - (FAMERP SP/2018)
Uma amostra de certo radioisótopo do elemento iodo teve sua atividade radioativa reduzida a 12,5% da atividade inicial após um período de 24 dias. A meia-vida desse radioisótopo é de
a)4 dias.
b)6 dias.
c)10 dias.
d)8 dias.
e)2 dias.
2 - (FPS PE/2017)
A radioterapia envolve a aplicação de radiações ionizantes capazes de criar íons e radicais livres nas células situadas no campo de irradiação. Como a capacidade de reparo das células tumorais é menor do que das células saudáveis, os íons formados e os radicais livres danificam o DNA da célula tumoral levando-a à morte. O cobalto-60 foi muito utilizado em radioterapia, entre os anos de 1950 a 1980. As máquinas de cobalto eram relativamente baratas, robustas e simples de usar. No entanto, devido ao tempo de meia-vida do cobalto de 5,3 anos, a máquina tinha de ser substituída a cada 5 anos, devido à perda de potência para emissão de raios gama.
Qual é o tempo necessário para que a massa de uma amostra de Cobalto-60 seja reduzida para 1/16 da massa inicial?
a)5,3 anos.
b)21,2 anos.
c)26,5 anos.
d)15,6 anos.
e)10,6 anos.
3 - (PUC SP/2018)
No dia 13 de setembro desse ano, completaram-se 30 anos do acidente com o Césio - 137.
Observe a equação a seguir:
![]()
O X pode ser corretamente substituído por
a)partícula ![]() .
.
b)partícula ![]() .
.
c)radiação ![]() .
.
d)raio X.
4 - (UNICAMP SP/2017)
Um filme de ficção muito recente destaca o isótopo ![]() , muito abundante na Lua, como uma solução para a produção de energia limpa na Terra. Uma das transformações que esse elemento pode sofrer, e que justificaria seu uso como combustível, está esquematicamente representada na reação abaixo, em que o
, muito abundante na Lua, como uma solução para a produção de energia limpa na Terra. Uma das transformações que esse elemento pode sofrer, e que justificaria seu uso como combustível, está esquematicamente representada na reação abaixo, em que o ![]() aparece como reagente.
aparece como reagente.
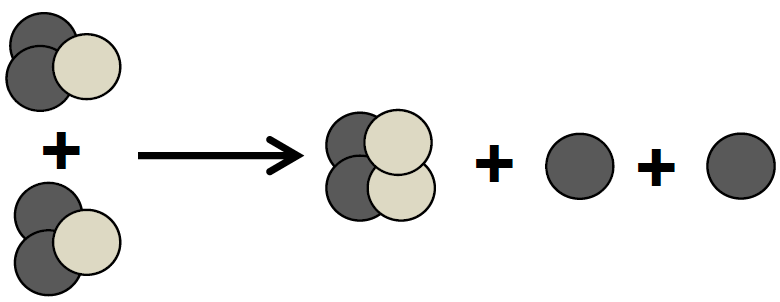
De acordo com esse esquema, pode-se concluir que essa transformação, que liberaria muita energia, é uma
a) fissão nuclear, e, no esquema, as esferas mais escuras representam os nêutrons e as mais claras os prótons.
b) fusão nuclear, e, no esquema, as esferas mais escuras representam os nêutrons e as mais claras os prótons.
c) fusão nuclear, e, no esquema, as esferas mais escuras representam os prótons e as mais claras os nêutrons.
d) fissão nuclear, e, no esquema, as esferas mais escuras são os prótons e as mais claras os nêutrons.
5 - (UniRV GO/2017)
A respeito das propriedades das soluções e substâncias, abaixo mencionadas, marque V para as afirmativas verdadeiras e F para as falsas.
a) A água do mar ferve a uma temperatura mais baixa que a água pura, ambas ao nível do mar.
b) Uma amostra de gelo seco se fundirá a 0ºC, não importa se você tem um cubo de gelo ou um iceberg.
c) Uma solução aquosa de sacarose é capaz de conduzir corrente elétrica.
d) Uma solução aquosa de cloreto de sódio conduz corrente elétrica porque possui íons Na+ e Cl– dissolvidos.
6 - (UEMG/2017)
Ebulioscopia é a propriedade coligativa, relacionada ao aumento da temperatura de ebulição de um líquido, quando se acrescenta a ele um soluto não volátil.
Considere as três soluções aquosas a seguir:
Solução A = NaCl 0,1 mol/L
Solução B = sacarose 0,1 mol/L
Solução C = CaCl2 0,1 mol/L
As soluções foram colocadas em ordem crescente de temperatura de ebulição em
a) C, A, B.
b) B, A, C.
c) A, B, C.
d) C, B, A.
7 - (UERJ/2018)
Um medicamento utilizado como laxante apresenta em sua composição química os sais Na2HPO4 e NaH2PO4, nas concentrações de 142 g/L e 60 g/L, respectivamente. A eficácia do medicamento está relacionada à alta concentração salina, que provoca perda de água das células presentes no intestino.
Admitindo que cada um dos sais encontra-se 100% dissociado, calcule a concentração de íons Na+, em mol/L, no medicamento.
Em seguida, também em relação ao medicamento, nomeie o sal com menor concentração e a propriedade coligativa correspondente à sua ação laxante.
8 - (UCS RS/2017)
Há muito tempo, habitantes de regiões áridas perceberam que lagos de água salgada têm _______ tendência para secar que lagos de água doce. Isso se deve ao efeito _______ produzido pela grande quantidade de sais presentes na água desses lagos.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas acima.
a) menor – tonoscópico
b) maior – crioscópico
c) menor – ebulioscópico
d) menor – osmótico
e) maior – ebulioscópico
9 - (UNIUBE MG/2017)
Elementos químicos que possuem número de prótons acima de 92 são artificiais e gerados a partir das transmutações realizadas nos aceleradores de partículas, onde núcleos de átomos são bombardeados por prótons (1p1), nêutrons (0n1), partículas alfa ![]() e beta
e beta ![]() .
.
Imagine que em 2015 uma massa de 109,6 g de bário-133 foi exposta emitindo radiação. Sabendo-se que o tempo de meia-vida desse radioisótopo é, aproximadamente, de 10 anos, em 2045 o número de mols que restariam seria de:
Dados: Massa Atômica do Ba = 137
a)0,01 mol
b)0,1 mol
c)2![]() 10–1 mol
10–1 mol
d)10 mol
e)13,7 mol
10 - (UNIUBE MG/2017)
Em uma reação nuclear, o elemento Urânio (92U235) foi bombardeado com uma partícula de nêutron formando o elemento Bário (56Ba133), um outro elemento genérico “X” e ainda emitindo três nêutrons. Com base nessas informações, os números de massa, prótons e nêutrons do átomo “X” serão, respectivamente:
a)100; 36; 64
b)102; 56; 46
c)136; 92; 44
d)235; 92; 143
e)237; 148; 89
11 - (FATEC SP/2018)
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c>
Acesso em: 13.11.2017. Adaptado.
É correto afirmar que os compostos orgânicos responsáveis pelo cheiro de carro novo apresentam
a)alta resistência ao calor.
b)alta pressão de vapor.
c)alta condutividade elétrica.
d)elevada condutividade térmica.
e)elevada maleabilidade.
12 - (UNICAMP SP/2017)
O etilenoglicol é uma substância muito solúvel em água, largamente utilizado como aditivo em radiadores de motores de automóveis, tanto em países frios como em países quentes.
Considerando a função principal de um radiador, pode-se inferir corretamente que
a) a solidificação de uma solução aquosa de etilenoglicol deve começar a uma temperatura mais elevada que a da água pura e sua ebulição, a uma temperatura mais baixa que a da água pura.
b) a solidificação de uma solução aquosa de etilenoglicol deve começar a uma temperatura mais baixa que a da água pura e sua ebulição, a uma temperatura mais elevada que a da água pura.
c) tanto a solidificação de uma solução aquosa de etilenoglicol quanto a sua ebulição devem começar em temperaturas mais baixas que as da água pura.
d) tanto a solidificação de uma solução aquosa de etilenoglicol quanto a sua ebulição devem começar em temperaturas mais altas que as da água pura.
13 - (Mackenzie SP/2016)
Ao investigar as propriedades coligativas das soluções, um estudante promoveu o congelamento e a ebulição de três soluções aquosas de solutos não voláteis (A, B e C), ao nível do mar. O resultado obtido foi registrado na tabela abaixo.

Após a análise dos resultados obtidos, o estudante fez as seguintes afirmações:
I.a solução A é aquela que, dentre as soluções analisadas, apresenta maior concentração em mol.L–1.
II.a solução B é aquela que, dentre as soluções analisadas, apresenta menor pressão de vapor.
III.a solução C é aquela que, dentre as soluções analisadas, apresenta menor volatilidade.
De acordo com os dados fornecidos e com seus conhecimentos, pode-se dizer que apenas
a)a afirmação I está correta.
b)a afirmação II está correta.
c)a afirmação III está correta.
d)as afirmações I e II estão corretas.
e)as afirmações II e III estão corretas.
14 - (ACAFE SC/2017)
Considere soluções aquosas diluídas e de mesma concentração das seguintes soluções:
1:fosfato de magnésio
2:dicromato de potássio
3:Na2S2O3 . 5H2O
4:nitrato de alumínio
A ordem crescente do ponto de ebulição dessas soluções é:
a)2 ![]() 3 > 4 > 1
3 > 4 > 1
b)2 < 4 < 1 < 3
c)2 > 4 > 1 > 3
d)2 ![]() 3 < 4 < 1
3 < 4 < 1
15 - (USF SP/2016)
A adição de determinados solutos em meio aquoso muda algumas das propriedades físicas do solvente. Considere três recipientes que contenham 1,0 L de soluções aquosas com concentração molar igual a 0,5 mol/L das seguintes substâncias:
I.Sacarose
II.Cloreto de sódio
III.Nitrato de cálcio
Ao medir algumas das propriedades físicas dessas soluções, foi observado que
a)a solução de sacarose apresentava pontos de fusão e ebulição superiores ao da água pura.
b)a solução de cloreto de sódio apresentava ponto de congelamento inferior à solução de nitrato de cálcio.
c)a solução de nitrato de cálcio é que apresentava o menor valor de pressão de vapor.
d)apenas as soluções iônicas possuíam pontos de ebulição superiores ao da água pura.
e)a maior variação entre os pontos de fusão e ebulição para essas substâncias será observada para a soluçãode sacarose.
16 - (UDESC SC/2016)
Quando um soluto não volátil é adicionado a um determinado solvente puro, uma solução é formada e suas propriedades físico-químicas podem ser alteradas. Este fenômeno é denominado efeito coligativo das soluções.
Considere estes efeitos e analise as proposições.
I. O abaixamento da pressão máxima de vapor de um líquido faz com que este tenha um maior ponto de ebulição. Tal fato é possível quando uma colher de sopa de açúcar (sacarose) é adicionada a uma panela contendo 1 litro de água, por exemplo. Este fenômeno é conhecido como ebulioscopia ou ebuliometria.
II. Uma tática interessante para acelerar o resfriamento de bebidas consiste na adição de sal de cozinha ao recipiente com gelo em que elas estão imersas. Neste caso, o efeito crioscópico está presente. Considerando um número idêntico de mols de cloreto de sódio e brometo de magnésio em experimentos distintos, o efeito coligativo resultante será o mesmo, pois este independe da natureza da substância utilizada.
III. A pressão osmótica do sangue humano é da ordem de 7,8 atm devido às substâncias nele dissolvidas. Desta forma, é fundamental que, ao se administrar uma determinada solução contendo um medicamento via intravenosa, a pressão osmótica deste último seja hipotônica em relação à da corrente sanguínea, sob o risco de que as hemácias possam se romper ao absorverem um excesso de partículas administradas.
Assinale a alternativa correta.
a)Somente a afirmativa I é verdadeira.
b)Somente as afirmativas I e III são verdadeiras.
c)Somente as afirmativas I e II são verdadeiras.
d)Somente as afirmativas II e III são verdadeiras.
e)Somente a afirmativa III é verdadeira.
17 - (FPS PE/2017)
O tálio-201, na forma de cloreto de tálio, é um radioisótopo usado em medicina nuclear para diagnosticar doenças coronárias e para a detecção de tumores. Sabendo que o tempo de meia-vida deste isótopo é, aproximadamente 3 dias, qual fração da concentração inicial de tálio permanece após 21 dias?
a)1/8
b)1/16
c)1/32
d)1/64
e)1/128
18 - (IFGO/2016)
Considerando que uma espécie radioativa tem meia-vida média de 30 anos, o tempo, em anos, necessário para que uma determinada massa desse material radioativo seja reduzida a menos de 5% da massa inicial é
a)30.
b)90.
c)150.
d)180.
e)210.
19 - (Mackenzie SP/2017)
Recentemente, a União Internacional de Química Pura e Aplicada (IUPAC) nomeou dois novos elementos químicos: o fleróvio (Fl) e o livermório (Lv). O livermório foi obtido a partir de uma reação de fusão nuclear do elemento cúrio com o cálcio, de acordo com a equação abaixo.
![]()
Por sua vez, o livermório sofre decaimento. Em 47 milissegundos, forma o fleróvio, como mostra a equação de decaimento abaixo.
![]()
Assim, x e y, presentes nas equações acima, representam, respectivamente,
a)pósitrons e o elemento hélio.
b)elétrons e partícula beta.
c)prótons e radiação gama.
d)deutério e nêutron.
e)nêutrons e partícula alfa.
20 - (ACAFE SC/2015)
Em um laboratório de química existem 4 frascos:
- frasco 1: água
- frasco 2: solução aquosa de CaCl2 0,3 mol/L
- frasco 3: solução aquosa de NaCl 0,3 mol/L
- frasco 4: solução aquosa de glicose 0,3 mol/L
Assinale a alternativa correta que contem a ordem crescente da pressão de vapor do solvente.
a)frasco 2 > frasco 3 > frasco 4 > frasco 1
b)frasco 1 > frasco 4 > frasco 3 > frasco 2
c)frasco 1 < frasco 4 < frasco 3 < frasco 2
d)frasco 2 < frasco 3 < frasco 4 < frasco 1
21 - (UCS RS/2015)
Em cinco anos, se não faltarem recursos orçamentários, o Brasil poderá se tornar autossuficiente na produção de radioisótopos, substâncias radioativas que podem ser usadas no diagnóstico e no tratamento de várias doenças, além de ter aplicações na indústria, na agricultura e no meio ambiente. O ouro-198, por exemplo, é um radioisótopo que tem sido frequentemente empregado pela chamada “Medicina Nuclear” no diagnóstico de problemas no fígado.
Supondo que um paciente tenha ingerido uma substância contendo 5,6 mg de 198Au, a massa (em miligramas) remanescente no organismo do mesmo depois de 10,8 dias será igual a
Dado: t1/2 do 198Au = 2,7 dias
a)0,175.
b)0,35.
c)0,7.
d)1,4.
e)2,8.
Observação: Admita que não tenha ocorrido excreção do radioisótopo pelo paciente durante o período de tempo descrito no texto.
22 - (UNCISAL/2015)
Um dos maiores acidentes com o isótopo 137Cs aconteceu em setembro de 1987, na cidade de Goiânia, Goiás, quando um aparelho de radioterapia desativado foi desmontado em um ferro velho. O desastre fez centenas de vítimas, todas contaminadas através de radiações emitidas por uma cápsula que continha 137Cs, sendo o maior acidente radioativo do Brasil e o maior ocorrido fora das usinas nucleares. O lixo radioativo encontra-se confinado em contêineres (revestidos com concreto e aço) em um depósito que foi construído para este fim. Se no lixo radioativo encontra-se 20 g de 137Cs e o seu tempo de meia vida é 30 anos, depois de quantos anos teremos aproximadamente 0,15 g de 137Cs?
a)90
b)120
c)150
d)180
e)210
23 - (PUC Camp SP/2016)
O isótopo do elemento césio de número de massa 137 sofre decaimento segundo a equação:
![]()
O número atômico do isótopo que X representa é igual a
a)54.
b)56.
c)57.
d)136.
e)138.
24 - (PUC MG/2013)
Nas mesmas condições de pressão e temperatura foram preparadas uma solução aquosa 0,1 mol L–1 de cloreto de sódio , uma solução aquosa 0,1 mol L–1 de sacarose e uma solução aquosa 0,1 mol L–1 de sulfato de potássio .
Sobre essas soluções, é INCORRETO afirmar que:
a)as soluções de cloreto de sódio e sulfato de potássio se vaporizam na mesma temperatura.
b)a solução de sulfato de potássio entra em ebulição a uma temperatura mais alta que a solução de NaCl.
c)a solução de sacarose se congela a uma temperatura mais baixa que a água pura.
d)a solução de NaCl tem menor pressão de vapor que a solução de sacarose.
25 - (Mackenzie SP/2015)
Em um experimento de laboratório, realizado sob pressão constante e ao nível do mar, foram utilizadas duas soluções, A e B, ambas apresentando a água como solvente e mesmo sal como soluto não volátil, as quais, estando inicialmente na fase líquida, foram aquecidas até ebulição. Desse experimento, foram coletados os dados que constam da tabela abaixo:

Um analista, baseando-se nos resultados obtidos, fez as seguintes afirmações:
I.A pressão de vapor de ambas as soluções é menor do que a pressão de vapor da água pura.
II.A solução A apresenta menor concentração de sal em relação à concentração salina da solução B.
III.As forças de interação intermoleculares na solução B apresentam maior intensidade do que as forças de interação existentes, tanto na solução A como na água.
É correto dizer que
a)nenhuma afirmação é verdadeira.
b)as afirmações I e II são verdadeiras.
c)as afirmações I e III são verdadeiras.
d)as afirmações II e III são verdadeiras.
e)todas as afirmações são verdadeiras.
26 - (Unievangélica GO/2015)
Em determinadas condições, as soluções possuem comportamentos coligativos diferentes em relação aos solventes puros, pois o número de partículas de soluto dissolvidas em solventes pode alterar significativamente as suas propriedades coligativas. Ao se dissolver em diferentes tipos de solutos em água, formar-se-ão soluções com diferentes comportamentos.
Nessas condições, a temperatura de ebulição será maior ao dissolver 1,0 mol de
a)cloreto de sódio em 100 mL de água.
b)sacarose em 100 mL de água.
c)etanol em 100 mL de água.
d)glicose em 200 mL de água.
27 - (FGV SP)
Considerando a água pura, uma solução aquosa de glicose de concentração igual a 3,0 mol L–1 e uma solução aquosa de cloreto de cálcio de concentração igual a 1,0 mol L–1, assinale a alternativa que apresenta a ordem correta para as temperaturas de ebulição (Te ) desses líquidos.
a) Te água > Te da solução contendo glicose > Te da solução contendo cloreto de cálcio.
b) Te água < Te da solução contendo glicose < Te da solução contendo cloreto de cálcio.
c) Te água = Te da solução contendo glicose = Te da solução contendo cloreto de cálcio.
d) Te água < Te da solução contendo glicose = Te da solução contendo cloreto de cálcio.
e) Te água > Te da solução contendo glicose = Te da solução contendo cloreto de cálcio.
28 - (UEG GO)
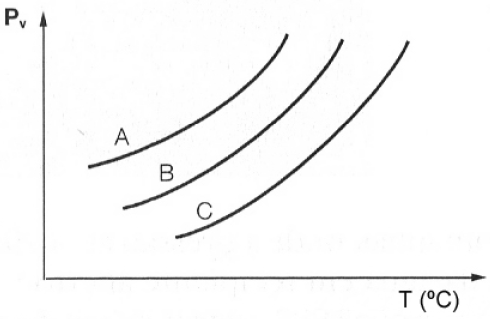
A análise da figura acima, que representa o gráfico da pressão de vapor versus a temperatura para três líquidos puros hipotéticos, permite concluir que
a) a adição de NaCl aos líquidos diminui as suas temperaturas de ebulição.
b) na mesma temperatura o líquido B apresenta maior pressão de vapor.
c) o líquido C apresenta a menor temperatura de ebulição.
d) o líquido A é o mais volátil.
29 - (UECE)
A descoberta do fenômeno da osmose foi atribuída a René Joachim Henri Dutrochet (1776 – 1847), físico e botânico francês, autor do termo "osmose". Sua pesquisa teve fundamental importância para explicar o processo da respiração celular. A pressão osmótica utilizada para interromper a osmose de uma determinada solução de glicose (C6H12O6) contendo 10 g/L a 15 ºC é
a)2,62 atm. b)1,83 atm. c)2,92 atm. d)1,31 atm.
30 - (FAMECA SP)
Soluções isotônicas são aquelas que apresentam a mesma concentração de partículas (moléculas ou íons).
Se uma solução de Ca(NO3)2 apresenta concentração igual a 0,2 mol L–1, ela será isotônica de uma solução de
a)sulfato de sódio de concentração 0,2 mol L–1.
b)cloreto de cálcio de concentração 0,3 mol L–1.
c)nitrato de cálcio de concentração 0,3 mol L–1.
d)nitrato de alumínio de concentração 0,2 mol L–1.
e)glicose de concentração 0,2 mol L–1.
31 - (UEM PR)
Sabendo-se que o sangue humano possui uma pressão osmótica de 7,8 atm a 37ºC, a massa de glicose (C6H12O6) usada para preparar um litro de uma solução isotônica a essa temperatura é, aproximadamente,
a)5,5 gramas. b)110 gramas. c)55 gramas. d)220 gramas. e)11 gramas.
32- (UEPB)
A pressão osmótica é um efeito coligativo verificado em vários fenômenos biológicos: no sangue humano; na desidratação infantil; na ascensão da água do solo até as partes mais altas dos vegetais; e até na conservação dos alimentos. Qual é a pressão osmótica, a 27ºC, de uma solução aquosa que contém 11g de glicose em 1 de solução?
a)0,01 atm b)0,82 atm c)0,15 atm d)0,08 atm e)1,50 atm
33 - (UNISC RS)
As soluções coligativas de solventes puros são modificadas quando se adiciona um soluto não volátil a eles. Essas propriedades, portanto, não são explicadas pela natureza da substância, mas pela quantidade de moléculas, partículas ou átomos adicionados. Atuam mais especificamente sobre as propriedades físicas, pressão de vapor (tonoscopia), ponto de ebulição, PE (ebulioscopia), ponto de congelamento (crioscopia) e pressão osmótica (osmoscopia). Pode se afirmar que a adição de cloreto de sódio (sal de cozinha) em água provoca
a) a diminuição da pressão de vapor, aumento do PE e diminuição da temperatura de congelamento.
b) a diminuição da pressão de vapor, diminuição do PE e diminuição da temperatura de congelamento.
c) a diminuição da pressão de vapor, aumento do PE e aumento da temperatura de congelamento.
d) o aumento da pressão de vapor, aumento do PE e diminuição da temperatura de congelamento.
e) o aumento da pressão de vapor, aumento do PE e aumento da temperatura de congelamento.
34 – (UFU MG)
A tecnologia nuclear possui diversas aplicações, das quais se destacam a esterilização de alimentos, a determinação da idade das rochas, entre outras. O tório ( Th ) é um dos elementos utilizados na tecnologia nuclear cuja transmutação natural, a partir do radioisótopo 90Th232, emite partículas alfa e beta e termina com o isótopo 82Pb208. Escreva a reação nuclear citada no enunciado, devidamente balanceada.
35 –(PUC MG/2013)
Nas mesmas condições de pressão e temperatura foram preparadas diversas soluções, tais como: solução aquosa 0,1 mol L–1 de cloreto de sódio, uma solução aquosa 34,2 g/L de sacarose e uma solução aquosa 0,1 mol L–1 de sulfato de potássio. Qual delas apresenta a maior temperatura de ebulição? Justifique a sua resposta
36 – (ESCS DF)
As emissões radioativas são empregadas na radioterapia para destruir células doentes ou impedi-las de se reproduzirem. Em 1987, uma cápsula contendo cloreto de césio-137 foi abandonada junto a um equipamento nas antigas instalações do Instituto Goiano de Radioterapia, em Goiânia. A cápsula foi encontrada e aberta pelo dono de um ferro-velho, o que causou o maior acidente radioativo da história do Brasil. Considere que o tempo de meia-vida do césio-137 é de trinta anos Quanto tempo levará para a atividade do radioisótopo 137Cs cair para 3,125% de seu valor inicial?
37 - (FATEC SP/2015)
Em 2014, na Alemanha, um elemento pesado foi confirmado por experimentos com um colisor de partículas e ocupará sua justa posição como Elemento 117 na Tabela Periódica.
Bombardeando amostras de berquélio radioativo com átomos de cálcio, pesquisadores criaram átomos com 117 prótons, originando um elemento químico, aproximadamente, 42% mais pesado que o chumbo e com meia-vida relativamente longa. Os físicos apelidaram, temporariamente, o novo integrante da Tabela Periódica como “ununséptio” (Uus), alusão direta ao numeral 117, que é a soma dos 20 prótons do cálcio com os 97 do berquélio.
(http://tinyurl.com/m8nlkq2 Acesso em: 13.06.2014. Adaptado)
De acordo com o texto, a massa atômica aproximada do ununséptio é
Dado: ![]()
a) 294. b)207. c)166. d)117. e)42.
38 - (FM Petrópolis RJ)
O iodo é um elemento importante da dieta humana, uma vez que é necessário para a produção dos hormônios tireoidianos. A falta de iodo na alimentação é uma das principais causas de hipotireoidismo. A atividade exacerbada da glândula tireoide causa o hipertireoidismo, que é tratado com a administração de iodo radioativo ![]() . Após a ingestão, o
. Após a ingestão, o ![]() tende a se depositar na glândula tireoide, diminuindo a sua atividade excessiva e regularizando a sua função. Esse efeito é produzido pela capacidade de o iodo radioativo emitir partículas beta.
tende a se depositar na glândula tireoide, diminuindo a sua atividade excessiva e regularizando a sua função. Esse efeito é produzido pela capacidade de o iodo radioativo emitir partículas beta.
Sobre o iodo, o iodo radioativo e a função tireoidiana, considere as seguintes assertivas:
I. A suplementação do sal de cozinha com iodo reduziu os casos de bócio no Brasil.
II. A equação de emissão de uma partícula beta do ![]() é
é ![]()
![]() +
+ ![]() .
.
III. Em crianças, a falta de iodo causa retardo mental em uma síndrome conhecida como cretinismo.
IV. O iodo é um halogênio que é bastante encontrado na natureza sob a forma de íon iodeto (I–).
Está correto o que se afirma em
a) I e II, apenas. b) III e IV, apenas. c) I, II e III, apenas.
d) II, III e IV, apenas. e) I, II, III e IV.
39 - (UFSCAR SP)
A radioterapia é um método capaz de destruir células tumorais, empregando feixe de radiações ionizantes. Os isótopos radioativos dos elementos cobalto, césio, irídio e outros são utilizados sob a forma de tubos, agulhas, fios, sementes ou placas e geram radiações, habitualmente do tipo gama, de diferentes energias, dependendo do elemento radioativo empregado. A reação nuclear envolvendo isótopos de cobalto é representada na equação:
![]()
(www.inca.gov.br. Adaptado.)
Na equação, o número atômico do elemento X é
a)26. b)27. c)28. d)59. e)60.
40 - (PUC Camp SP)
A Era Atômica foi marcada por várias descobertas. Entre elas, a cisão do núcleo de urânio realizada pelos físicos alemães Otto Hahn e Fritz Strassman, em 22 de dezembro de 1922. A equação que representa esse processo é
U + ![]() n
n ![]() Ba +
Ba + ![]() Kr + 3
Kr + 3 ![]() n
n
O número de nêutrons para o elemento urânio, nessa equação é
a)235 b)143 c)92 d)90 e)20
41 - (UNESP SP)
Água coletada em Fukushima em 2013 revela radioatividade recorde
A empresa responsável pela operação da usina nuclear de Fukushima, Tokyo Electric Power (Tepco), informou que as amostras de água coletadas na central em julho de 2013 continham um nível recorde de radioatividade, cinco vezes maior que o detectado originalmente. A Tepco explicou que uma nova medição revelou que o líquido, coletado de um poço de observação entre os reatores 1 e 2 da fábrica, continha nível recorde do isótopo radioativo estrôncio-90.
O isótopo radioativo Sr-90 não existe na natureza, sua formação ocorre principalmente em virtude da desintegração do Br-90 resultante do processo de fissão do urânio e do plutônio em reatores nucleares ou em explosões de bombas atômicas. Observe a série radioativa, a partir do Br-90, até a formação do Sr-90:
![]()
A análise dos dados exibidos nessa série permite concluir que, nesse processo de desintegração, são emitidas
a)partículas alfa. b)partículas alfa e partículas beta. c)apenas radiações gama.
d) partículas alfa e nêutrons. e)partículas beta.
42 - (UERN)
A solubilidade do nitrato de cálcio em água e 2,0 . 10–3 mol/litro em uma determinada temperatura. O Kps deste sal à mesma temperatura é:
a) 8 . 10–8.
b) 8 . 10–10.
c) 3,2 . 10–10.
d) 3,2 . 10–8.
43- (UNICAMP SP)
Nos Jogos Olímpicos de Beijing houve uma preocupação em se evitar a ocorrência de chuvas durante a cerimônia de abertura. Utilizou-se o iodeto de prata no bombardeamento de nuvens nas vizinhanças da cidade para provocar chuva nesses locais e, assim, evitá-la no Estádio Olímpico. O iodeto de prata tem uma estrutura cristalina similar à do gelo, o que induz a formação de gelo e chuva sob condições específicas. Escreva a expressão da constante do produto de solubilidade do iodeto de prata e calcule sua concentração em mol L–1 numa solução aquosa saturada a 25 ºC.
Dado: A constante do produto de solubilidade do iodeto de prata é 8,1 ´ 10–17 a 25 ºC.
44 - (ACAFE SC)
Cálculo renal também, conhecido como pedra nos rins, são formações sólidas contendo várias espécies químicas, entre elas o fosfato de cálcio, que se acumula nos rins, causando enfermidades.
Assinale a alternativa que contém a concentração dos íons Ca2+ em uma solução aquosa saturada de fosfato de cálcio.
Dado: Considere que a temperatura seja constante e o produto de solubilidade (Ks) do fosfato de cálcio em água seja 1,0810–33.
a) 310–7mol/L b) 110–7mol/L c) 210–7mol/L d) 2710–7 mol/L
45 - (UNIUBE MG)
Os íons cálcio e ácido oxálico presentes na alimentação humana podem, através de uma reação de precipitação oriunda das atividades fisiológicas do organismo, produzir o oxalato de cálcio, um dos principais constituintes dos cálculos renais (pedra nos rins). As medidas laboratoriais indicam que a concentração média desse sal na urina de uma pessoa adulta sem distúrbios metabólicos é da ordem de 6,7 mg/L. Sendo assim, podemos afirmar que, à temperatura corpórea, 37ºC, o produto de solubilidade (Kps ) do oxalato de cálcio para um paciente metabolicamente compensado é de, aproximadamente:
Dados: CaC2O4 M = 128g/mol
a) 2,7 x 10–9 b) 7,3 x 10–18 c) 2,8 x 10–8 d) 5,2 x 10–5 e) 1,1 x 10–4
46 - (UFGD MS)
Sabe-se a solubilidade de algumas substâncias variam em função da temperatura, a fim de evitar-se erros experimentais os químicos normalmente mantêm a temperatura constante durante os experimentos. Em uma determinada temperatura, a solubilidade do sulfato de prata (Ag2SO4) em água é 2,010–2 mol/L. Qual é o valor do produto de solubilidade (Kps) deste sal considerando esta mesma temperatura?
a) Kps = 6,410–5 b) Kps = 3,210–5 c) Kps = 3210–5 d) Kps = 6410–5 e) Kps = 0,6410–5
47 - (UFAL)
Um estudo efetuado para detectar as causas da poluição numa baía concluiu que parte da poluição observada era devido à qualidade das águas de um certo rio que ali desembocava. Esse rio recebia grande quantidade de resíduos industriais ricos em chumbo e desaguava na baía. Uma amostra coletada na foz desse rio, à temperatura de 25 °C, apresentou concentração de íons cloreto igual a 0,30 mol/L.
Sabendo que o produto de solubilidade do cloreto de chumbo, PbCl2, é 1,6 ´10−5 a 25 °C determine a concentração máxima (em mol/L) de íons chumbo presente nessa amostra.
a) 4,3 ´10−3 b) 6,5 ´10−4 c) 1,8 ´10−4 d) 2,0 ´10−5 e) 9,3 ´10−5
GABARITO:
1) D 2) B 3) B 4) C 5) VVFV 06) B 07) NaH2PO4 - osmotica 08) A
09) B 10) A 11) B 12) B 13) C 14) D 15) C 16) A 17) E 18) C 19) E20) D 21) B 22) E 23) B 24) A 25) E 26) A 27) D 28) D 29) D 30) A 31) C 32) E 33) A 34)90Th232è 6 ![]() + 4
+ 4 ![]() + 82Pb20835) Aconcentração das soluções são todas iguais. Portanto as soluções iônicas possuem o fator de correção e o produto µ.i será maior na solução de K2SO4 – 3 mols íons = i. Portanto 0,1 . 3 = 0,3 mol/L. Portanto a resposta correta é o K2SO4. 36) 150 anos
+ 82Pb20835) Aconcentração das soluções são todas iguais. Portanto as soluções iônicas possuem o fator de correção e o produto µ.i será maior na solução de K2SO4 – 3 mols íons = i. Portanto 0,1 . 3 = 0,3 mol/L. Portanto a resposta correta é o K2SO4. 36) 150 anos
37) A 38) E 39) C 40) B 41) E 42) D 43) Kps = [ Ag+] [ I-] , 9 x 10-9 mol/L 44) A 45) A 46) B 47) C

