Lista de exercícios–Química – prof. Raimundo. 1º. Trimestre - 2º. Ens. Médio 2018
- REAÇÕES INORGÂNICAS
- CONCENTRAÇÃO COMUM.
- TEORIA ATÔMICA MOLECULAR.
- COEFICIENTE DE SOLUBILIDADE
- CONCENTRAÇÃO MOLAR.
Dados: C = 12 H = 1 O = 16 Ca = 40 S = 32 Na = 23 N = 14 Cl = 35,5 Mn = 55 Mg = 24 K = 39 He = 4 Br = 80 Cu = 63,5 Ag = 108 P = 31 Hg = 200
A resolução comentada está no final da lista
01 - (UCS RS/2017)
Curvas de solubilidade, como as representadas no gráfico abaixo, descrevem como os coeficientes de solubilidade de substâncias químicas, em um determinado solvente, variam em função da temperatura.
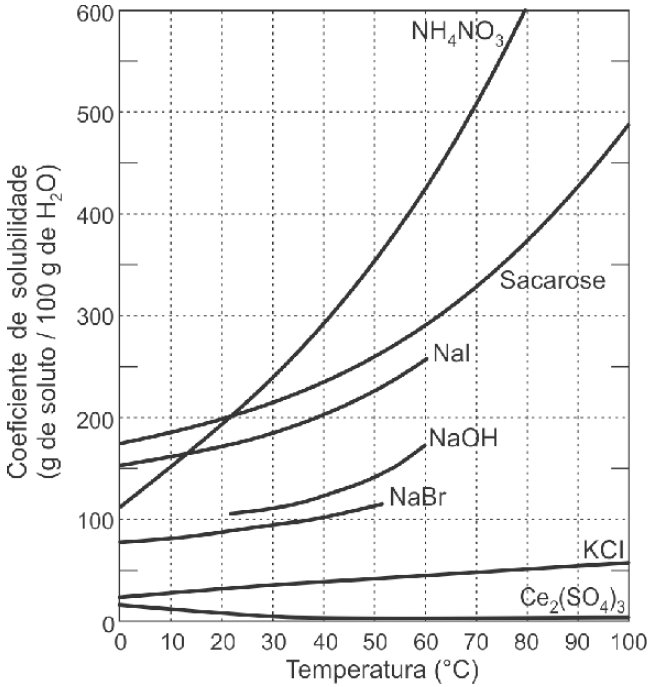
Fonte: BRADY, James E., RUSSELL, Joel W., HOLUM, John R.
Química: a matéria e suas transformações.
3. ed. LTC: Rio de Janeiro, V. 1, 2002. p. 385.
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
a) Todas as substâncias químicas são sais, com exceção da sacarose.
b) O aumento da temperatura de 10 ºC para 40 ºC favorece a solubilização do sulfato de cério (III) em água.
c) A massa de nitrato de amônio que permanece em solução, quando a temperatura da água é reduzida de 80 ºC para 40 ºC, é de aproximadamente 100 g.
d) O aumento da temperatura, favorece a dissolução do iodeto de sódio.
e) A 0 ºC, todas as substâncias químicas são insolúveis em água.
02 - (UEG GO/2016)
Considere 5 L de uma solução aquosa contendo 146 g de cloreto de sódio que será utilizada como solução de partida para outras de mais baixa concentração. Uma quantidade de 2 mL dessa solução contém uma massa de soluto, em miligramas, de aproximadamente
a) 3
b) 29
c) 58
d) 73
e) 292
03 - (FPS PE/2017)
Formol, também conhecido como formalina, é uma solução aquosa de metanal ou formaldeído. Em altas concentrações, essa solução é utilizada para conservar cadáveres ou peças anatômicas. Determine a quantidade de formaldeído (CH2O) presente em 5,0 L de uma solução 12 mol.L–1 de formol. Dados: Massas molares em g.mol–1: H= 1; C= 12; O= 16.
a) 1,8 kg
b) 2,5 kg
c) 3,7 kg
d) 4,6 kg
e) 5,0 kg
04 - (UECE/2016)
O magnésio subministrado na forma de cloreto de magnésio tem papel importante para o fortalecimento dos músculos e nervos, função imunológica, reforça a estrutura óssea, regula os níveis de pressão arterial e o açúcar do sangue, etc. A título experimental, um estudante de bioquímica preparou uma solução de cloreto de magnésio utilizando 200 g de água e 20 g de cloreto de magnésio que passou a ter densidade de 1,10 g/mL. Para essa solução, a concentração em quantidade de matéria é, aproximadamente,
a) 1,05 mol/L.
b) 1,20 mol/L.
c) 1,30 mol/L.
d) 1,50 mol/L.
05 - (IFPE/2016)
O ácido bórico (H3BO3) ou seus sais, como borato de sódio e borato de cálcio, são bastante usados como antissépticos, inseticidas e como retardantes de chamas. Na medicina oftalmológica, é usado como água boricada, que consiste em uma solução de ácido bórico em água destilada.
Sabendo-se que a concentração em quantidade de matéria (mol/L) do ácido bórico, nessa solução, é 0,5mol/L, assinale a alternativa correta para massa de ácido bórico, em gramas, que deve ser pesada para preparar 200 litros desse medicamento.
Dados: Massas molares, em g/moL: H =1; B =11; O = 16
a) 9500
b) 1200
c) 6200
d) 4500
e) 3900
06 - (UNIRG TO/2016)
O hidróxido de magnésio pode ser usado para neutralizar excesso de ácido clorídrico presente no suco gástrico. Considerando a equação balanceada com os menores coeficientes inteiros possíveis para essa reação, são feitas as seguintes afirmações:
I. O valor da soma dos coeficientes dos reagentes dessa reação é igual a 3.
II. Um dos produtos formados a partir dessa reação é o sal cloreto de magnésio.
III. Ocorre uma reação de neutralização envolvendo uma base fraca e um ácido fraco.
Assinale a única alternativa que apresenta todos os itens corretos:
a) I apenas.
b) II e III, apenas.
c) I e II, apenas.
d) I e III, apenas.
07 - (PUC Camp SP/2016)
O consumo excessivo de sal pode acarretar o aumento da pressão das artérias, também chamada de hipertensão. Para evitar esse problema, o Ministério da Saúde recomenda o consumo diário máximo de 5 g de sal (1,7 g de sódio). Uma pessoa que consome a quantidade de sal máxima recomendada está ingerindo um número de íons sódio igual a
Dados: Massa molar do Na = 23,0 g/mol.
a) 1,0![]() 1021
1021
b) 2,4![]() 1021
1021
c) 3,8![]() 1022
1022
d) 4,4![]() 1022
1022
e) 6,0![]() 1023
1023
08 - (Centro Universitário de Franca SP/2016)
O quadro apresenta a estrutura da vitamina C e sua solubilidade em água em função da temperatura.
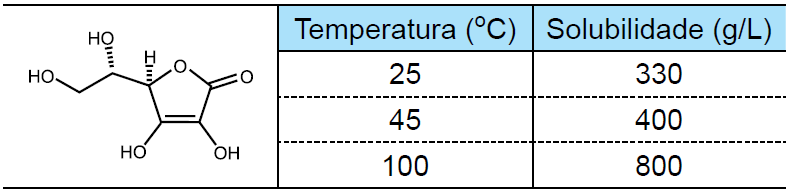
Qual a massa de vitamina C, em gramas, que pode ser cristalizada quando 2 litros de solução saturada dessa vitamina a 100 ºC são resfriados para 45 ºC?
09 - (FEI SP)
Tem-se 180g de uma solução aquosa de sacarose (C12H22O11), saturada a 50°C. Qual a massa de cristais que se separam da solução, quando ela é resfriada até 30°C? Dados: Coeficiente de solubilidade (Cs) da sacarose em água: Cs à 30°C = 220g/100g de água Cs à 50°C = 260g/100g de água
10 - (UNESP SP/2015)
Em um laboratório didático, um aluno montou pilhas elétricas usando placas metálicas de zinco e cobre, separadas com pedaços de papel-toalha, como mostra a figura.
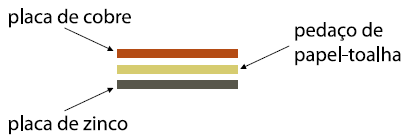
Com o conjunto e os contatos devidamente fixados, o aluno adicionou uma solução de sulfato de cobre II (CuSO4) aos pedaços de papel-toalha de modo a umedecê-los e, instantaneamente, houve o acendimento da lâmpada.
Sabe-se que o aluno utilizou 63,8g de sulfato de cobre II para preparar uma solução de concentração igual a 1,00 mol x L–1. Calcule o volume em mL de água necessária para o preparo desta solução.
11 - (UFPEL RS/2015)
Segundo algumas orientações nutricionais, a dose diária recomendada de vitamina C (C6H8O6), a ser ingerida por uma pessoa adulta, é de 2,5 X 10–4 mol. Se uma pessoa consome, diariamente, uma cápsula de 440 mg dessa vitamina, a dose consumida por esse paciente é X vezes maior do que a recomendada. Nesse caso, X equivale a quanto?
12 - (IFPE/2015)
O sulfato ferroso faz parte da composição de remédios indicados para combater a anemia (deficiência de ferro). Esses remédios são usados para combater a deficiência alimentar de ferro, prevenção de anemia e reposição das perdas de ferro por dificuldades na absorção. Considere um vidro de remédio de 200mL que contém 3,04g de sulfato ferroso dissolvido na solução. Assinale a alternativa que indica corretamente a concentração, em quantidade de matéria por litro (mol/L), do ferro (II) no sulfato ferroso, presente neste remédio.
-
0,05 b) 0,20 c) 0,60 d) 0,10 e) 0,40
13 - (Unimontes MG/2015)
Os dados abaixo se referem às substâncias, carbono, eteno, dióxido de carbono e glicose. Essas substâncias encontram-se representadas por I, II, III e IV, respectivamente.
I. 12,0 g de C.
II. 8 mols de C2H2.
III. 9,0 x 1023 moléculas de CO2.
IV. 180,0 g de C6H12O6.
Em relação aos dados fornecidos, apresenta maior número de átomos de carbono a substância representada em
-
I. b)III. c) IV. d) II.
TEXTO: - Comum às questões: 14, 15
As informações destacadas abaixo foram retiradas do rótulo de um refrigerante “zero açúcar”:

A água gaseificada apresenta o seguinte equilíbrio químico:
CO2(aq) + 2 H2O(l) ![]() HCO3–(aq) + H3O+(aq)
HCO3–(aq) + H3O+(aq)
E ainda estão presentes acidulantes utilizados para realçar o sabor e para inibir o desenvolvimento de microrganismos. Os acidulantes, comumente usados pela indústria alimentícia, são os ácidos cítrico (C6H8O7) e fosfórico (H3PO4). Para regular a acidez do meio usa-se o citrato de sódio (C6H7O7Na) e para substituir o açúcar usa-se o aspartame (C14H18N2O5) e o ciclamato de sódio (NaC6H12SNO3).
14- (UEPA/2015)
Sobre a presença do aspartame em 100 mL do refrigerante, é correto afirmar que a concentração desse adoçante no meio é:
a) 0,0012 g/L b) 0,012g/L c) 0,12 g/L d) 12,0 g/L e)120,0 g/L
15 - (UEPA/2015)
Em 100 mL do refrigerante, exposto no Texto XXV, a concentração em mol/L de ciclamato de sódio (NaC6H12SNO3), conforme o rótulo, é:
Dados: considere a massa molar do ciclamato de sódio=201 g/mol.
a) 5,0 x10–4 mol/L b) 1,2 x10–3 mol/L c) 3,5 x10–3 mol/L d) 4,7 x10–3 mol/L e) 5,5 x10–3 mol/L
16 - (UNIFICADO RJ/2015)
Aciclovir é um antiviral indicado no tratamento do vírus do herpes humano, incluindo o vírus do herpes simplex, tipos 1 e 2, e o vírus varicella zoster.
Há, no mercado, comprimidos de aciclovir de 200 mg, 400 mg e 800 mg. Há também a forma em xarope, com apresentação de 200 mg/5 mL. Portanto, a concentração em quantidade de matéria do aciclovir no xarope é, em mol.L–1, Dado: A massa molar do aciclovir é 225 g/mol.
a) 0,18 b)0,28 c)0,58 d) 0,88 e)0,98
17 - (UDESC SC)
A figura abaixo representa a curva de solubilidade de alguns sais.
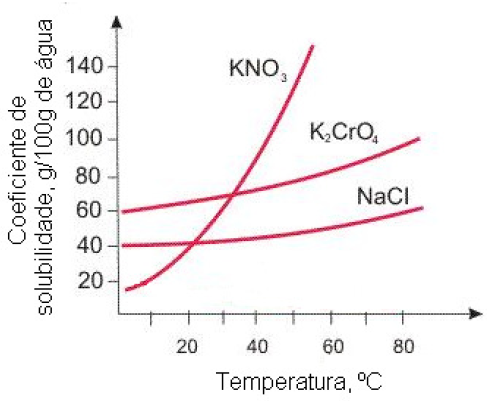
Assinale a alternativa que representa, sequencialmente, a massa (em gramas) de nitrato de potássio que é cristalizada e a massa que permanece na solução, quando uma solução aquosa saturada desse sal a 50ºC é resfriada para 20ºC.
a) 90g e 40g b)40g e 90g c) 90g e 130g d) 10g e 65g e)05g e 40g
18 - (Univag MT)
A solubilidade em água do glutamato monossódico mono-hidratado, sal muito utilizado na culinária oriental para reforçar o sabor dos alimentos, é cerca de 60 g/100 mL a 20 ºC. Sabendo que a fórmula molecular dessa substância é C5H8NNaO4.H2O, conclui-se que a concentração aproximada, em mol/L, de uma solução saturada desse sal a 20 ºC é
a) 4.
b) 5.
c) 2.
d) 1.
e) 3.
19 - (UESPI)
Certa substância X pode ser dissolvida em até 53g a cada 100 mL de água (H2O). As soluções formadas por essa substância, descritas a seguir, podem ser classificadas, respectivamente, como:
1. 26,5g de X em 50 mL de H2O
2. 28g de X em 100 mL de H2O
3. 57,3g de X em 150 mL de H2O
4. 55g de X em 100 mL de H2O
a) Insaturada, Insaturada, Saturada com precipitado e Saturada.
b) Saturada, Saturada, Saturada com precipitado e Insaturada.
c) Saturada com precipitado, Insaturada, Saturada e Saturada.
d) Saturada com precipitado, Insaturada, Insaturada e Saturada.
e) Saturada, Insaturada, Insaturada e Saturada com precipitado.
20 - (UNESP SP)
No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em gramas de soluto por 1000 g de água).
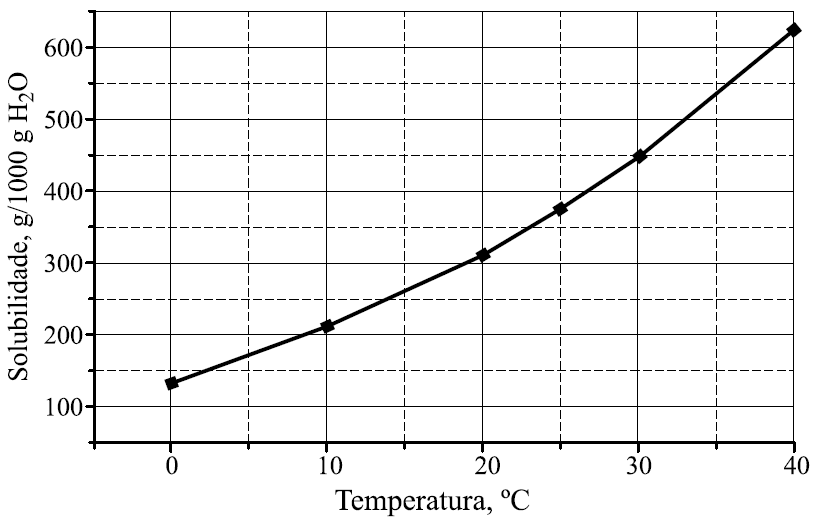
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução deve estar a uma temperatura, aproximadamente, igual a
a) 12 °C. b)17 °C. c)22 °C. d)27 ºC. e)32 °C.
21 - (UFV MG)
A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico abaixo:
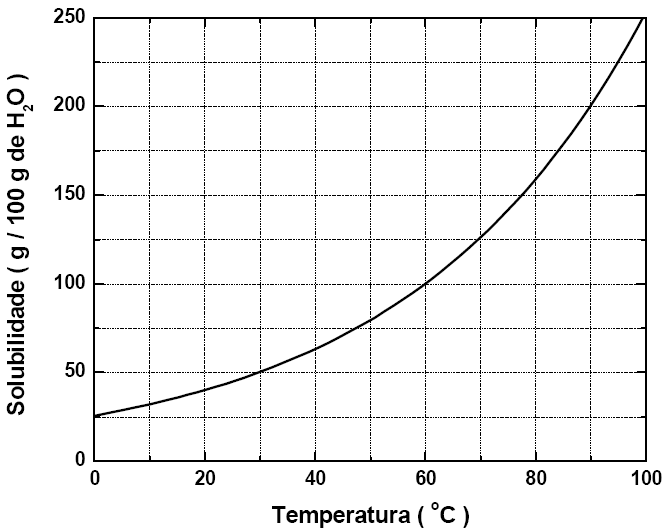
De acordo com o gráfico, assinale a alternativa que indica CORRETAMENTE a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 °C:
a) 250 b) 375 c)150 d)100 e) 500
22 - (UFSCAR SP)
Após a conclusão do ensino médio, uma jovem estudante começou a se preparar para a realização das provas de vestibulares de algumas universidades. Em certo dia, durante os estudos, sentiu azia estomacal. Preocupada, sua mãe dissolveu todo o conteúdo de um envelope de medicamento num copo d’água (200 mL) e deu para a filha tomar. Após o alívio estomacal, a estudante pediu para ver o envelope do medicamento e anotou a sua composição:
• bicarbonato de sódio: 2,10 g
• carbonato de sódio: 0,50 g
• ácido cítrico: 2,25 g
A estudante, entusiasmada, recordou das aulas de química e lembrou-se de alguns conceitos, como soluções e reações químicas, especialmente da reação entre o carbonato de sódio e o ácido produzido pelo estômago, o HCl:
xHCl+ yNa2CO3 → zNaCl+ wCO2 + uH2O
Se o envelope do medicamento contivesse somente bicarbonato de sódio (2,10 g) e se o volume final do conteúdo do copo d’água não se alterasse após a dissolução do medicamento, é correto afirmar que a concentração, em mol/L, de bicarbonato de sódio (massa molar 84 g/mol) nesta solução seria de
a) 0,025.
b) 0,050.
c) 0,075.
d) 0,100.
e) 0,125.
23 - (ESCS DF)
Para tentar explicar a presença de clorometano e diclorometano em amostras recolhidas em Marte pela sonda Viking, cientistas aqueceram uma mistura de percloratos com o solo do deserto do Atacama, no Chile, possivelmente similar ao solo marciano. As reações químicas da experiência destruíram os compostos orgânicos do solo, liberando traços de clorometano e diclorometano como os encontrados pela sonda.
Considerando que em uma amostra foram encontradas 6 x 1015 moléculas de clorometano e 1,2 x 1017 moléculas de diclorometano, os números de mols aproximados de clorometano e de diclorometano são, respectivamente:
a) 1 x 10–9 e 2 x 10–7;
b) 1 x 10–8 e 2 x 10–7;
c) 1 x 10–6 e 5 x 10–6;
d) 1 x 106 e 2 x 108;
e) 1 x 108 e 5 x 106.
24 - (ACAFE SC)
No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem sobre o ataque com armas químicas na Síria ´´[...] O gás sarin é inodoro e invisível. Além da inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio miligrama. […]”.
Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140g/mol.
a) 1,68x1026 moléculas.
b) 3,00x1023 moléculas.
c) 2,14x1021 moléculas.
d) 2,14x1018 moléculas.
25 - (UFTM MG)
Os “cianokits”, que são utilizados por socorristas em outros países nos casos de envenenamento por cianeto, geralmente contêm 5 g de hidroxocobalamina ( massa molar igual a 1,3 x 103 g/mol ) injetável. Considerando a constante de Avogadro igual a 6 x 1023 mol–1, calcula-se que o número aproximado de moléculas existentes nessa massa de hidroxocobalamina é
a) 2 x 1021.
b) 2 x 1025.
c) 3 x 1025.
d) 3 x 1021.
e) 1 x 1021.
GABARITO:
1)D 2) C 3) A 4) A 5) C 6)C 7)D 8) 800g 9)20g 10)400 mL 11)10 vezes 12)D 13)D 14)C 15)B 16)A 17)A 18)E 19)E 20)D 21)A 22)E 23)B 24)D 25)A

