RESOLUÇÃO COMENTADA
1-RESP: D
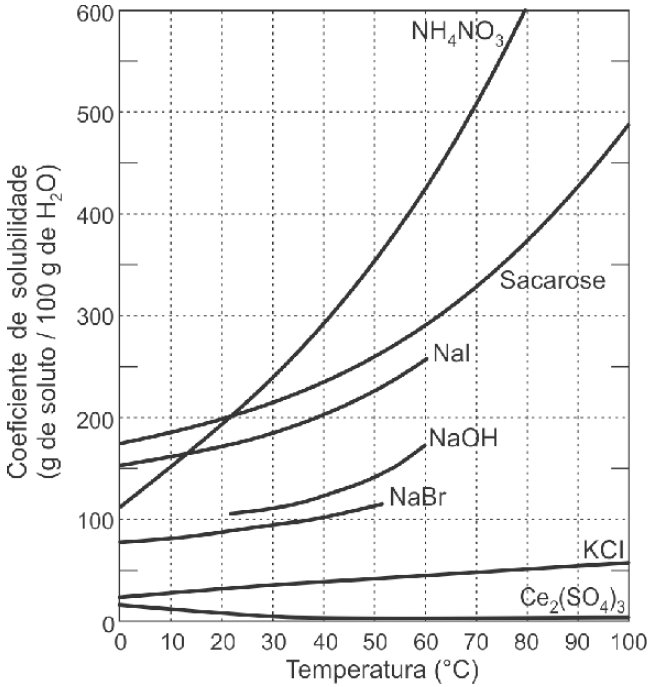
Afirmativa a é falsa : temos a presença do NaOH que é uma base.
Afirmativa b é falsa: de acordo com o gráfico, notamos que o aumento de temperatura, diminui a solubilidade do Ce2(SO4)3.
Afirmativa c é falsa: em 80ºC, temos 600g dissolvido. Quando diminuímos a temperatura para 40ºC, verificamos no gráfico que o coeficiente é de 300g dissolvido. Portanto quando diminuímos a temperatura de 80ºC para 40ºC, irá permanecer dissolvido 300g ( 600 – 300 ).
Afirmativa d é verdadeira: O aumento de temperatura favorece a dissolução do iodeto de sódio.
Afirmativa e é falsa: podemos notar no gráfico que a 0ºC, a solubilidade do nitrato de amônio é maior que 100g
2-RESP: C
3-RESP: A
Temos que ler, grifar e retirar os dados da questão.
4-RESP: A
Temos que ler, grifar e retirar os dados da questão.
Dica:
A fórmula química do cloreto de magnésio é MgCl2. Com a fórmula da substância, podemos calcular a sua massa molar (dados no inicio das questões).
Sabemos que a densidade da água é igual a 1g/ml, portanto 200g de água será igual a 200 mL.
5-RESP: C
Temos que ler, grifar e retirar os dados da questão.
6-RESP: C
Esta questão é de reação de neutralização total entre um ácido e uma base.
Para ocorrer a neutralização total, a quantidade de H+ do ácido tem que ser igual a quantidade de OH- da base.
Reagentes:Ác. Clorídrico (forte)e Hidróxido de magnésio(fraca)
Produtos: cloreto de magnésio e água
7-RESP: D
O sal é o cloreto de sódio ( NaCl ) que é um composto iônico que em meio aquoso sofre dissociação. A questão refere-se aos íons sódio.
NaCl(s) Na+(aq) + Cl(aq)
MASSA ATÔMICA -- 1 MOL –- 6,0 X 1023(moléculas, íons )
Portanto:
23 g íons sódio ----- 6,0 x 1023 íons
1,7 g íons sódio ----- x
X = 4,43 x 1022 íons
8-Resolução
Dica: Esta questão pede a massa de vitamina C cristalizada, porém a questão forneceu a concentração em g/L
De acordo com a tabela
9-Resolução
A questão é sobre coeficiente de solubilidade
Dado o coeficiente
Foi dado no enunciado a quantidade de 180g de solução e pede a massa que irá cristaliza, após o resfriamento
OBS: para calcular a massa que cristaliza, temos que saber a quantidade de soluto e solvente existente em 180 gramas de solução.
10-Resolução
Temos um enunciado “longo”, porém a resolução é simples. Temos que ler, grifar e retirar os dados da questão
11-Resolução:
1º. PASSO
12-Resp: D
Esta questão refere-se ao cálculo da concentração molar de uma solução de sulfato ferroso.
1º. PASSO
Determinar a fórmula da substância citada.
Sulfato ferroso (FeSO4)
FeSO4 = 152g/mol.
2º. PASSO
Separar os dados fornecidos na questão.
13-Resp: D
Esta questão é sobre teoria atômica molecular, a qual se refere ao cálculo do número de átomos.
14-RESP:C
A questão fornece a quantidade de cada ingrediente presente no refrigerante.
Esta questão fala sobre a presença do aspartame e pede para calcular a concentração em g/L.
No enunciado, não foi especificado em qual unidade deve-se calcular a concentração,porém conseguimos identificar através das alternativas.
Dados da questão: m=12 . 10-3g V= 0,1L C=?
15-RESP:B
A questão fornece a quantidade de cada ingrediente presente no refrigerante.
Esta questão fala sobre a presença do ciclamato de sódio e pede para calcular a concentração em mol/L.
Dados da questão:
16-RESP:A
A questão é sobre concentração molar (mol/L).
O xarope é vendido no mercado, sob diversas formas, porém a concentração é sobre o xarope.
17-RESP:A
Analisando o gráfico, notamos que :
18-RESP:E
A questão fornece a massa ( 60g) presente em 100 mL (0,1L) de solução.
A questão pede a concentração em mol/L, ou seja, quantos mols de glumato em um litro de solução.
Para resolver, primeiro vamos determinar a massa molar do glutamato.
1)Massa molar
C5H8NNaO4 . H2O = 60 + 8 = 14 + 23 +64 + 18 = 177 g/mol
2) Determinar o número de mols em 60g de glutamato.
177g glutamato .............. 1 mol
60g glutamato .............. x
X = 0,338 mol de glutamato.
3) Calculo da concentração molar em 1 litro.$
0,338 mol ............... 0,1L
X mol ............... 1,0L
X= 3,38 mol/L
19-RESP:E
Pelo enunciando temos que o coeficiente de solubilidade da substância X é de 53g em 100 mL de água.
Dica: Como a questão fornece valores diferentes de água, temos que calcular a quantidade de sal dissolvida nestas quantidades.
Conhecimento para a resolução:
Solução insaturada: quantidade de soluto dissolvido é menor que o estipulado pelo coeficiente.
Solução saturada: quantidade de soluto dissolvido é igual ao estipulado pelo coeficiente.
Solução supersaturada: quantidade de soluto dissolvido é maior que o estipulado pelo coeficiente.
Soluções:
1- Saturada pois a quantidade dissolvida é igual ao coeficiente para 50 mL de água.
2- Insaturada, pois a quantidade dissolvida é menor que a determinada para 100 mL de água.
3- Insaturada, pois a quantidade dissolvida é menor que a determinada para 150 mL de água.
4-Saturada com precipitado, pois a quantidade estipulada é maior que o coeficiente para 100 mL de água.
20-RESP:D
Para determinar a temperatura, vamos calcular a massa de soluto necessária para atingir o coeficiente de solubilidade. De acordo com o gráfico, a quantidade de água é de 1000g.
O enunciado fornece 500g de água e 200g de soluto.
21-RESP:A
Através do gráfico podemos determinar o coeficiente a 30ºC e determinar a quantidade de soluto e solvente.
Dica: A questão fornece 750g de solução, isto indica que: soluto + solvente = solução (750g).
22-RESP:E
A questão fornece um enunciado longo que não interfere na resolução do exercício.
Dica: A reação dada não será utilizada, pois foi apenas uma maneira da aluna recordar as aulas de química. Se você não ficar atento ao enunciado, vai querer balancear a equação que não será usada. O que vamos utilizar é apenas a massa molar do Bicarbonato ( 84 g/mol), o volume do copo d´água ( 200 Ml = 0,2L) e a massa contida no envelope de 2,10 g.
23-RESP: B
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de mols do clorometano
1mol ------------ 6 x 1023 moléculas.
X ------------ 6 x 1015 moléculas
X= 1 x 10-8 moléculas de clorometano.
Cálculo do número de mols do diclorometano
1mol ------------ 6 x 1023 moléculas.
X ------------ 1,2 x 1017 moléculas
X= 2 x 10-7 moléculas de diclorometano.
24-RESP: D
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de moléculas do gás sarin
140 g sarin ------------ 6 x 1023 moléculas.
0,5 x 10-3 g ------------ x
X= 2,14 x 1018 moléculas de gás sarin
25-RESP: A
Dica: massa molar ---- 1 mol ---- 6 x 1023 moléculas
Cálculo do número de moléculas do hidroxocobalamina
1300 g ------------ 6 x 1023 moléculas.
5,0 g ------------ x
X= 2,3 x 1021 moléculas hidroxocobalamina





















