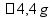Lista de Exercícios 1 - Parte 2
01 - (UFSCAR SP/2013)
Examine o diagrama de fases da água.
Considere os fenômenos descritos nos itens I e II:
I. Na panela de pressão, os alimentos são cozidos mais rapidamente porque a ebulição da água ocorre a uma temperatura mais elevada.
II. A liofilização é um processo de desidratação usado para preservação de alimentos perecíveis, em que a água é retirada dos alimentos congelados por sublimação.
Na figura, as curvas que representam o equilíbrio entre os estados físicos da água descritos nos itens I e II são, respectivamente,
a) 1 e 2. b) 2 e 1. c) 1 e 3. d) 2 e 3. e) 3 e 2.
02 - (UESC BA/2011)
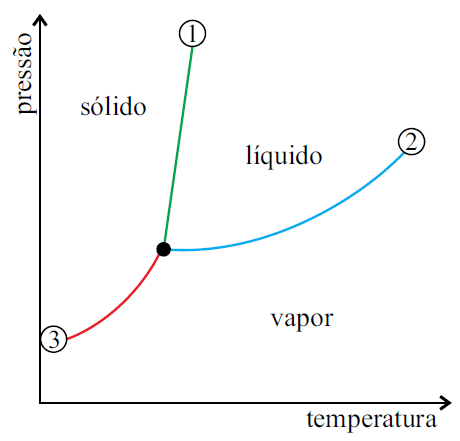
O diagrama representa o equilíbrio entre fases da água pura em função da temperatura.
A análise desse diagrama permite afirmar:
01. O ponto C representa o equilíbrio entre a fase líquida e a de vapor de água pura.
02. O ponto B representa a ebulição da água a 1,0atm.
03. O ponto A representa o equilíbrio entre a fase sólida e a de vapor.
05. A água na fase sólida sublima quando a temperatura atinge 0,0098ºC à pressão de 4,58torr.
03 - (Fac. Anhembi Morumbi SP/2014)
Considere as seguintes soluções aquosas:
• citrato de sódio, Na3C6H5O7 0,1 mol/L.
• nitrato de potássio 0,1 mol/L.
• glicerina, C3H8O3 0,2 mol/L.
• cloreto de sódio 0,15 mol/L.
• ureia, (NH2)2CO 1,2 g/L.
Dentre as soluções relacionadas, são isotônicas as soluções de
a) citrato de sódio, glicerina e ureia. b) citrato de sódio e nitrato de potássio.
c) ureia, glicerina e nitrato de potássio. d) glicerina e nitrato de potássio.
e) ureia e cloreto de sódio.
04 - (FPS PE/2013)
As propriedades coligativas das soluções são dependentes apenas do número de partículas (moléculas ou íons) existentes na solução, não dependendo da natureza dessas partículas. Baseando-se nas propriedades coligativas, são feitas as seguintes afirmações:
1. a água pura congela a 0 ºC e ferve a 100 ºC, sob pressão normal de 1 atm. No entanto, se for dissolvido um pouco de sal comum em água, ela passa a congelar acima de 0 ºC e ferve abaixo de 100 ºC, sob pressão de 1 atm.
2. quando se coloca sal comum em verduras cruas, elas murcham após certo tempo. Isso ocorre porque o sal força a saída de água das células vegetais.
3. se um peixe de água doce for colocado na água do mar, ele morre porque entra água no seu corpo.
4. as soluções que são injetadas na circulação sanguínea (para transfusões de sangue e alimentação intravenosa) devem ser isotônicas com o sangue (quer dizer, ter a mesma pressão osmótica). Se a solução injetada é muito diluída (chamada de hipotônica), o solvente flui para as células para igualar a pressão osmótica. As células rompem-se e morrem. Se a solução injetada é muito concentrada (chamada de hipertônica), o solvente flui para fora das células para igualar a pressão osmótica. As células murcham e morrem.
Estão corretas, apenas:
a) 1, 2 e 4. b) 1, 2 e 3. c) 1, 3 e 4. d) 2 e 3. e) 2 e 4.
08 - (UFU MG/2013)
Nas águas dos oceanos, encontram-se diversos íons dissolvidos, como cloretos, sódio, sulfatos, bicarbonatos, magnésio, potássio entre outros, que contribuem para a sua constante salinidade. Um estudante extraiu uma amostra de aproximadamente 200 mL de água do mar, acrescentou 10 g de açúcar (sacarose) e fez algumas verificações quanto às propriedades desta nova solução.
Com base em seus conhecimentos químicos, marque, para as afirmativas abaixo, (V) Verdadeira, (F) Falsa ou (SO) Sem Opção.
1. A pressão de vapor do sistema diminui a partir da adição do açúcar.
2. O ponto de fusão da solução final é maior que o da inicial.
3. A condutibilidade elétrica da solução resultante aumentou.
4. A concentração dos íons presentes na solução final permanece a mesma da solução inicial.
09 - (FGV SP/2013)
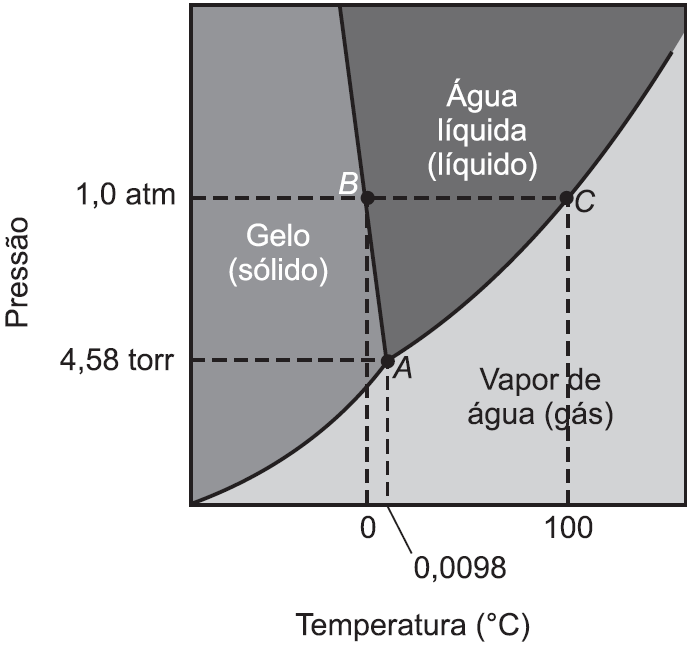
O ítrio-90, meia vida = 3 dias, emissor 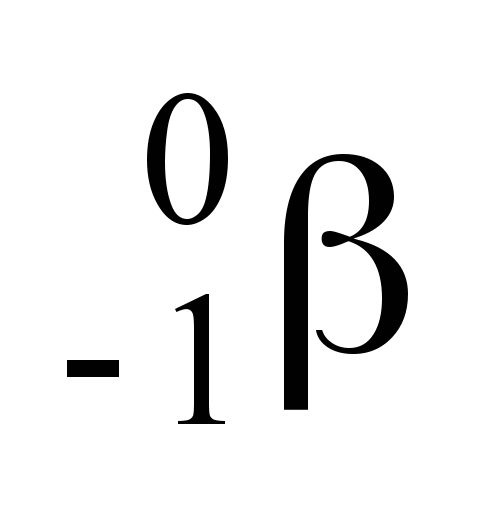 , é empregado como radiofármaco no tratamento de artrite reumatoide. O percentual de Y-90, que permanece após 9 dias em que ele foi empregado no paciente, e o produto de seu decaimento radiativo são, respectivamente: ( consulte uma tabela )
, é empregado como radiofármaco no tratamento de artrite reumatoide. O percentual de Y-90, que permanece após 9 dias em que ele foi empregado no paciente, e o produto de seu decaimento radiativo são, respectivamente: ( consulte uma tabela )
a) 12,5% e ítrio-89. b) 12,5% e zircônio-90. c) 12,5% e estrôncio-90.
d) 33% e estrôncio-90. e) 33% e zircônio-90.
11 - (FMJ SP/2013)
O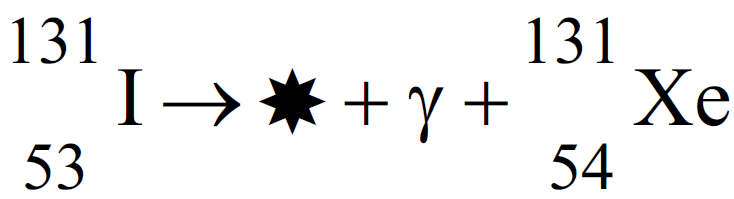 isótopo do iodo, que apresenta número de massa 131, pode ser utilizado na medicina nuclear para avaliar o tamanho, a forma e a atividade da glândula tireoide. Uma das etapas de seu decaimento radioativo é:
isótopo do iodo, que apresenta número de massa 131, pode ser utilizado na medicina nuclear para avaliar o tamanho, a forma e a atividade da glândula tireoide. Uma das etapas de seu decaimento radioativo é:
Nessa reação,  representa
representa
-
uma partícula beta. b) um próton. c) uma partícula alfa. d) um pósitron. e) um nêutron.
12 - (UFSCAR SP/2013)
A radioterapia é um método capaz de destruir células tumorais, empregando feixe de radiações ionizantes. Os isótopos radioativos dos elementos cobalto, césio, irídio e outros são utilizados sob a forma de tubos, agulhas, fios, sementes ou placas e geram radiações, habitualmente do tipo gama, de diferentes energias, dependendo do elemento radioativo empregado. A reação nuclear envolvendo isótopos de cobalto é representada na equação:
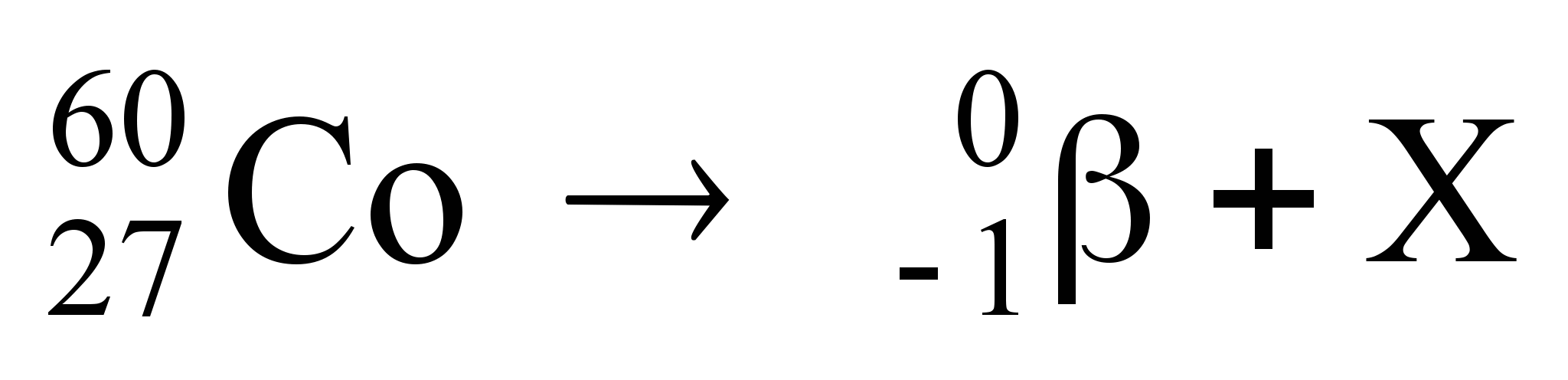
Na equação, o número atômico do elemento X é
a) 26. b) 27. c) 28. d) 59. e) 60.
13 - (Fac. de Ciências da Saúde de Barretos SP/2013)
O magnésio é um mineral essencial para o corpo humano, necessário para processos biológicos tais como a produção de ATP e a contração muscular. É muito consumido por pessoas que desejam evitar cãibra muscular, manter o bom funcionamento de músculos e nervos, a densidade óssea e aliviar contusões. A vitamina B6 aumenta a quantidade de magnésio absorvida pelas células. Existem à venda suplementos alimentares cuja composição inclui esses dois nutrientes.
Uma das propriedades observadas em uma solução aquosa de 5 g/L de carbonato de magnésio é:
a) temperatura de ebulição mais baixa que a da água pura.
b) diminuição gradativa da concentração durante a ebulição.
c) temperatura de solidificação mais alta que a da água pura.
d) aumento gradativo da temperatura de ebulição durante a fervura.
e) mesma pressão máxima de vapor que a da água pura.
TEXTO: - Comum às questões: 14, 15 ( consulte uma tabela )
O 99mTc (tecnécio-99 metaestável) é um emissor gama com meia vida de 6 horas amplamente utilizado em procedimentos de Medicina Nuclear. É produzido pelo decaimento do 99Mo (molibdênio-99), que tem uma meia-vida de 66 horas. O gerador de tecnécio consiste em um recipiente com pequenas esferas de alumina sobre as quais o 99Mo (molibdênio- 99), produzido em um reator nuclear, liga-se firmemente. Quando decai em tecnécio este, por ser quimicamente diferente, desliga-se da alumina, e pode ser “lavado” do recipiente por uma solução salina.
14 - (Fac. Santa Marcelina SP/2013)
Comparando-se os números atômicos do molibdênio e do tecnécio, pode-se afirmar que o decaimento do molibdênio-99 em tecnécio-99 metaestável ocorre com a emissão radioativa constituída por
a) elétrons (partículas β–). b) prótons. c) pósitrons (partículas β+).
d) núcleos de hélio (partículas α). e) nêutrons.
15 - (Fac. Santa Marcelina SP/2013)
Grande parte do molibdênio-99 utilizado em clínicas e hospitais do mundo todo é obtida em um reator nuclear do Canadá, fato que implica na necessidade de transporte aéreo para os demais países. Caso haja uma greve que acarrete um atraso de 132 horas em um voo que transportará o gerador de tecnécio, a atividade radioativa inicial do molibdênio-99, durante este período de greve, terá caído, em relação à inicial
a) 12,5%. b) 3,12%. c) 50%. d) 6,25%. e) 25%.
16 - (ESCS DF/2013)
Os soros fisiológico e glicosado são soluções aquosas de NaCl e glicose (C6H12O6), respectivamente. O soro fisiológico é empregado principalmente para a reposição de água e sais minerais perdidos pelo organismo. Já o soro glicosado, além de sua função hidratante, atua como fonte de energia para o organismo por meio do metabolismo da glicose. Esses soros, quando injetados nas veias de pacientes, devem apresentar pressão osmótica similar à do sangue, para não danificarem os glóbulos vermelhos.
Considerando as informações do texto e considerando, ainda, que a constante universal dos gases seja igual a 0,082 atm*L*mol–1*K–1, que o NaCl sofra dissociação completa em solução e que o soro fisiológico seja uma solução ideal com pressão osmótica igual a 7,7 atm a 298 K, verifica-se, com relação ao soro fisiológico, que
a) ele apresenta pressão de vapor superior à da água pura.
b) ele entra em ebulição em temperatura inferior à de ebulição da água pura.
c) sua pressão de vapor diminui com o aumento da temperatura.
d) ele congela em temperatura inferior à temperatura de congelamento da água pura.
e) a concentração de NaCl é superior a 0,20 mol/L.
17 - (Fac. Santa Marcelina SP/2013)
O Tl-201 é um isótopo radioativo do tálio que, na forma de cloreto de tálio, é usado na medicina nuclear nos exames diagnósticos de doenças coronárias e na detecção de tumores. A figura apresenta a radioatividade em função do tempo para uma amostra de Tl-201, contida num frasco hermeticamente fechado no instante zero.
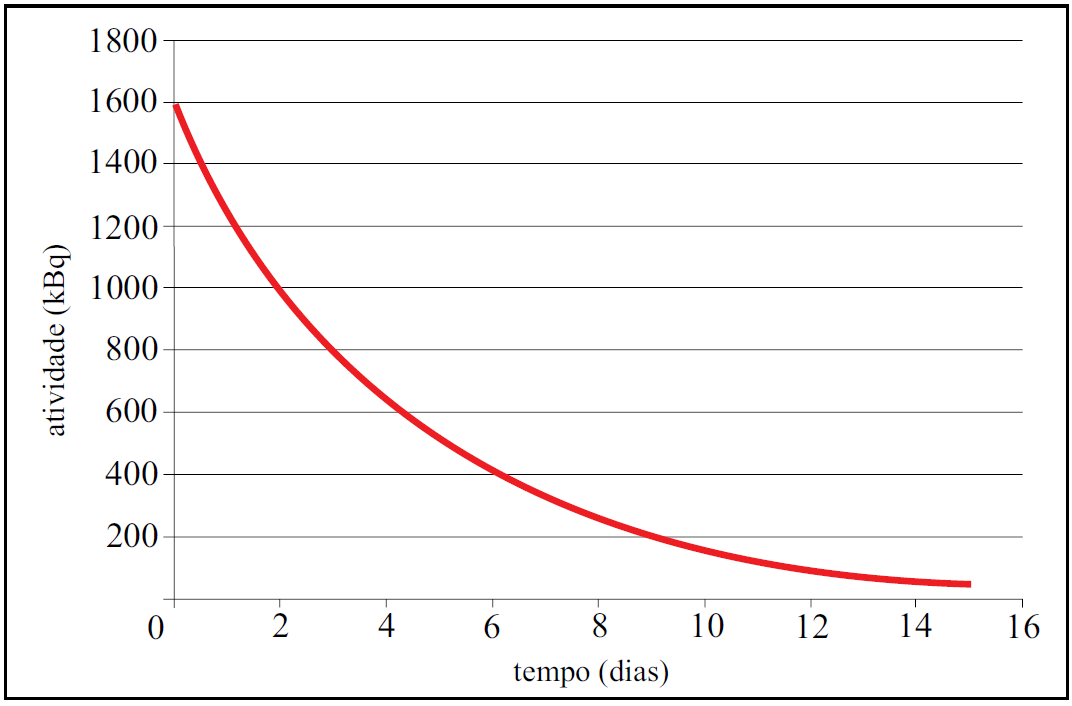
O tempo necessário para que a radioatividade da amostra de Tl-201 decaia para 25 kBq, em dias, é
a) 16. b) 15. c) 21. d) 20. e) 18.
18 - (Unicastelo SP/2013)
Um estudo publicado na revista científica eletrônica PLos One revela hábitos do paulista mais antigo de que se tem notícia. A ossada do caçador, que viveu há 10 mil anos, foi encontrada enterrada com as pernas flexionadas, como se estivesse sentado, no Vale do Ribeira (SP). Os pesquisadores analisaram isótopos de nitrogênio e carbono obtido no colágeno dos ossos.
Considerando o isótopo de 14C, cuja meia-vida é de 5 600 anos, a ossada do caçador tinha um teor desse isótopo por volta de
a) 10%. b) 30%. c) 50%. d) 60%. e) 70%.
TEXTO: - Comum às questões: 19, 20
A figura mostra um gerador de 99mTc (tecnécio-99 metaestável) produzido no Brasil pelo IPEN. Este radionuclídeo, utilizado na medicina nuclear, é produzido continuamente pelo decaimento do radionuclídeo “pai”, que é o 99Mo (molibdênio-99). O gráfico mostra uma atividade típica de 99Mo desses geradores, em função do tempo em dias.
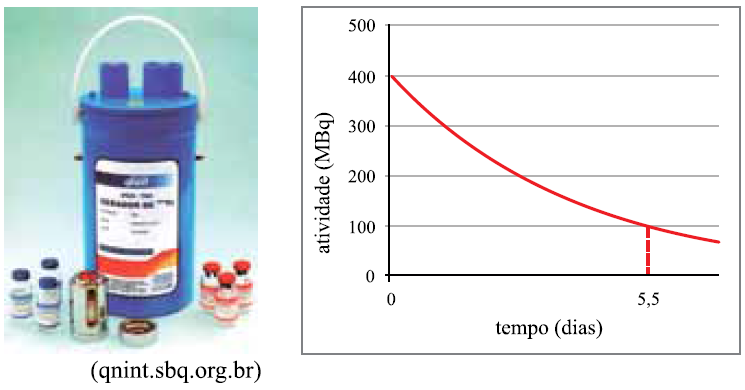
19 - (FAMECA SP/2014)
Na equação nuclear referente ao decaimento do 99Mo, nuclídeo “pai”, para o 99mTc, nuclídeo “filho”, há liberação de
a) partículas alfa. b) partículas beta negativas. c) partículas beta positivas.
d) nêutrons. e) prótons.
20 - (FAMECA SP/2014)
A partir do gráfico, pode-se concluir corretamente que a meia-vida do 99Mo, em horas, é
a) 11. b) 5,5. c) 66. d) 44. e) 88.
21 - (ESCS DF/2014)
As emissões radioativas são empregadas na radioterapia para destruir células doentes ou impedi-las de se reproduzirem. Em 1987, uma cápsula contendo cloreto de césio-137 foi abandonada junto a um equipamento nas antigas instalações do Instituto Goiano de Radioterapia, em Goiânia. A cápsula foi encontrada e aberta pelo dono de um ferro-velho, o que causou o maior acidente radioativo da história do Brasil.
A seguir, são apresentados três tipos de emissões radioativas.
• partícula α: constituída por dois prótons e dois nêutrons
• partícula β: constituída por um elétron gerado a partir da conversão de um nêutron em um próton
• radiação γ: radiação eletromagnética
Considerando as informações acima, é correto afirmar que a transformação do césio-137 em bário-137 pode ser explicada por meio da emissão de ( consulte uma tabela )
a) uma partícula α e radiação γ. b) radiação γ. c) uma partícula β. d) uma partícula α.
Resolução dos Exercícios




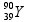
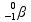 +
+ 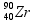
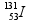
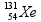
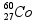
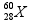
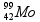
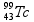
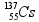
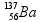




 = 3 x 1 = 3 mol.L-1 .
= 3 x 1 = 3 mol.L-1 . RADICAL CARBOXÍLA
RADICAL CARBOXÍLA )
)